Tim-3调控巨噬细胞极化在克罗恩病发生发展中的作用
2022-12-16林道泼邵晓晓胡定元吴昊蒋益
林道泼,邵晓晓,胡定元,吴昊,蒋益
温州医科大学附属第二医院育英儿童医院 消化内科,浙江 温州 325027
肠道巨噬细胞是参与肠黏膜免疫系统构建的重要细胞之一,在保护肠黏膜免遭病原体侵害以及调节肠道炎症反应中均发挥重要作用[1]。研究表明,M0型巨噬细胞在不同局部微环境因素作用下可极化为促炎的经典激活型巨噬细胞(M1型)和抗炎的替代激活型巨噬细胞(M2型)两种表型[2]。当微环境发生改变,将触发巨噬细胞的表型和功能在M1和M2型之间动态变化,称为巨噬细胞极化[3]。
克罗恩病(Crohn’s disease, CD)是一类病因不明的慢性非特异性肠道炎症性疾病,可累及口腔至肛门的各段消化道。多数研究提示巨噬细胞数目和功能异常与CD发病密切相关[4]。目前治疗CD常用的一线生物制剂如英夫利昔单抗(infliximab,IFX)和乌司奴单抗(ustekinumab, UST)均能通过抑制巨噬细胞相关炎性信号通路和(或)诱导抗炎型巨噬细胞极化,影响巨噬细胞功能[5-6]。研究表明IFX治疗后黏膜愈合的炎症性肠病(inflammatory bowel diseases, IBD)患者肠组织中,CD68+CD206+M2型巨噬细胞的数量显著增多,提示M2型巨噬细胞的诱导可能参与黏膜愈合过程[6]。亦有学者通过调节巨噬细胞相关信号通路开发治疗IBD的新型药物,如磷酸二酯酶4(phosphodiesterase-4, PDE4)抑制剂[7]。因此,积极研发新的靶向巨噬细胞的药物,可能有助于IBD疾病控制。
人类T淋巴细胞免疫球蛋白黏蛋白3(T cells immunoglobulin domain and mucin domain protein 3, Tim-3)最初被发现于辅助性T细胞(T helper cell, Th)1上,Tim-3与其配体半乳糖凝集素(galectin, GAL)-9结合后能诱导已激活的Th1凋亡,直接抑制Th1型免疫反应。近期研究发现,Tim-3在各种固有免疫细胞,如自然杀伤细胞、巨噬细胞中都存在表达且发挥不同调控作用[8]。与其公认的对T细胞免疫的负调节作用相反,Tim-3对巨噬细胞的作用是复杂且有争议的,取决于不同的疾病微环境[9]。因此本研究拟基于生物信息学,探索Tim-3在CD患者肠组织中的表达及其可能的临床意义,并进一步分析Tim-3表达与巨噬细胞的关系,为诠释Tim-3影响IBD发病的潜在机制提供线索。
1 对象和方法
1.1 数据来源 从美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)的公共基因表达数据库(gene expression omnibus, GEO)中下载CD的表达谱芯片。表达谱芯片下载编号为GSE112366、GSE75214、GSE16879和GSE186582。GSE112366共包含66例活动期CD患者、35例缓解期CD患者和26名健康受试者的人肠组织标本,测序平台为GPL13158;GSE75214包含59例活动期CD患者、16例缓解期CD患者和22名健康受试者的人肠组织标本,测序平台为GPL6244。GSE16879共包含37例活动期CD患者和12名健康受试者的人肠组织标本,测序平台为GPL570;GSE186582共包含102例活动期CD患者和25名健康受试者的人肠组织标本,测序平台为GPL570。
1.2 数据标准化 使用GEO2R在线工具,通过探针ID号查找到Tim-3基因在肠组织中的mRNA表达量,当多个探针对应Tim-3基因时取最大值。同时获取各芯片中CD患者对应的临床数据(内镜下评分和生物制剂应答情况),以分析Tim-3的mRNA表达与生物制剂疗效和疾病严重程度的相关性。GSE16879数据集共筛选37例CD患者,其中结肠型CD患者19例,回肠型CD患者18例,均为经糖皮质激素或免疫抑制剂治疗失败的活动期CD患者。在IFX首次静脉输注前1周内进行内窥镜检查并取治疗前活检。如果患者只接受IFX(5 mg/kg)单剂静脉注射治疗诱导缓解,于第4周进行治疗后内镜下组织活检;如患者采用IFX(5 mg/kg)于第0、2、6周静脉注射治疗诱导缓解,则于第6周接受治疗后内镜下活检。所有活检均取肠道炎症部位。根据D’HAENS等[10]的评分标准进行CD患者肠组织内镜下组织学评分。对结肠型CD患者,内镜下组织学评分下降至少3分认为黏膜改善,11例患者达到黏膜改善为IFX应答组,8例患者未达到黏膜改善为IFX无应答组。而对回肠型CD患者,内镜下溃疡明显改善或内镜下组织学评分出现下降即认为IFX应答,共8例患者纳入IFX应答组,10例患者纳入IFX无应答组。GSE112366数据集共筛选37例中重度活动期CD患者,其CD活动指数(Crohn’s disease activity index, CDAI)为220~450分,既往均为激素、免疫抑制剂或IFX治疗失败,统一采用UST于第0周静脉注射治疗诱导缓解,给药剂量根据体质量计算[260 mg(体质量≤55 kg),390 mg(55 kg<体质量≤85 kg),520 mg(体质量>85 kg)],首次注射后随访6周,依据CDAI评分进行疗效评估。CDAI评分下降大于100分,或者CDAI基线水平为220~248分的CD患者经治疗后CDAI<150归为UST应答组,反之为UST无应答组,在第0周及第8周进行内窥镜检查并取肠道炎性部位组织进行活检。
1.3 CD肠组织巨噬细胞浸润分析 采用Cibersort计算方法估算所有活动期CD样本中的巨噬细胞比例,计算次数设定在100次,然后进行质量过滤,只选择P<0.05的CD样本进行巨噬细胞与Tim-3的mRNA表达之间的相关性分析。
1.4 免疫荧光技术检测CD患者和健康对照者肠组织中Tim-3及CD68表达和CD68+Tim-3+巨噬细胞的比例 收集2020年10月至2021年9月温州医科大学附属第二医院育英儿童医院行结肠镜检查的12例活动期初治CD患者的炎性肠组织标本,其中男10例,女2例,年龄(26±6)岁。疾病部位:回肠末端型6例,结肠型0例,回结肠型6例,上消化道型2例。疾病行为:非狭窄非穿透型5例,狭窄型6例,穿透型1例,合并肛周疾病3例。依据2016年欧洲克罗恩和结肠炎组织(European Chron’s and Colitis Organization, ECCO)颁布的CD诊治指 南[11],经临床、消化内镜、实验室、影像学及病理组织学等综合确立CD诊断。纳入前排除糖尿病、类风湿性关节炎、系统性红斑狼疮、肠结核、缺血性肠炎、放射性肠炎和肿瘤等疾病。研究方案取得医院伦理委员会批准(伦理批件号:2021-K-90-02),观察对象均知情同意。同期在温州医科大学附属第二医院育英儿童医院体检中心收集15名健康对照者肠组织作为对照组,其中男12名,女3名,年龄(25±7)岁。纳入前排除糖尿病、类风湿性关节炎、系统性红斑狼疮、肠结核、缺血性肠炎、放射性肠炎和肿瘤等疾病。将收集到肠组织进行免疫荧光双染。按照三色多重荧光染色试剂盒的操作步骤进行操作,具体如下:肠组织标本常规行石蜡包埋、切片、脱蜡,使用3% H2O2封闭内源性过氧化物酶,3% BSA封闭。在切片上滴加用抗体稀释液稀释好的一抗[抗兔CD68,1:1 000,英国Abcam公司;抗兔Tim-3抗体,1:300,美国CST公司],避光湿盒内4 ℃孵育过夜。PBS洗涤3次,每次5 min,加 HRP二抗覆盖组织,避光室温孵育50 min。滴加不同发射波长的TYR荧光染料(TYR-488或TYR-CY3荧光染料)反应10~15 min。取出37 ℃复温45 min后用PBS漂洗3次,每次5 min。切片稍甩干后滴加DAPI染液室温避光孵育10 min。PBS再洗3次,切片甩干后用抗荧光淬灭封片剂封片。用Image proplus 6.0计算每个样本CD68+和CD68+Tim-3+细胞的数量,取5个视野平均值,由两名研究者分别独立阅片,最后计算CD68+Tim-3+细胞占CD68+细胞的比例。
1.5 实时荧光定量PCR法检测CD患者和健康对照者肠组织中Tim-3及M1、M2型巨噬细胞相关细胞因子的mRNA表达 收集2022年7月至2022年10月温州医科大学附属第二医院育英儿童医院行结肠镜检查的6例活动期初治CD患者的炎性肠组织标本,其中男4例,女2例,年龄(28±5)岁。疾病部位:回肠末端型4例,回结肠型2例。疾病行为均为非狭窄非穿透型。同期在温州医科大学附属第二医院育英儿童医院体检中心收集8名健康对照者肠组织作为对照组,其中男5名,女3名,年龄(29±6)岁。诊断及排除标准同前。将收集到的肠组织置于TRIzol液中裂解,0.2 mL氯仿抽提,离心,70%乙醇洗涤,DEPC水溶解,使用分光光度计测定总RNA的含量及浓度。cDNA合成具体步骤按照TaKaRa试剂盒说明书进行。引物序列见表1,基因PCR反应条件为95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。以标准管家基因(GAPDH)为参照,采用2-ΔΔCT法计算目的基因的相对表达水平。

表1 CD患者肠组织基因引物序列
1.6 统计学处理方法 本研究中GEO数据库的原始数据采用GEO2R在线工具或GraphPad Prism软件(version 8.0.1)分析。采用Shapiro-Wilk检验分析连续变量是否符合正态分布。正态分布的计量资料以±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。偏态分布的计量资料以M(P25,P75)表示,两组间比较采用Wilcoxon Signed Rank检验,多组间比较采用Kruskal-Wallis检验。采用Spearman秩相关进行相关性分析。将IFX治疗第0周CD患者肠组织中Tim-3的mRNA表达水平作为参数,采用受试者工作特征(ROC)曲线分析这些参数对预测IFX疗效的临床价值。P<0.05为差异有统计学意义。
2 结果
2.1 Tim-3的mRNA水平在CD和正常肠组织中的表达差异 初步利用GEO数据库分析CD患者肠组织和正常组织中Tim-3基因的转录水平,结果表明活动期CD患者肠组织中Tim-3的mRNA表达水平显著高于对照组(P<0.01)。对GSE112366和GSE75214数据集进一步分析发现,与缓解期CD患者相比,活动期CD患者肠组织中Tim-3的mRNA表达水平亦显著升高(P< 0.01)。见图1。
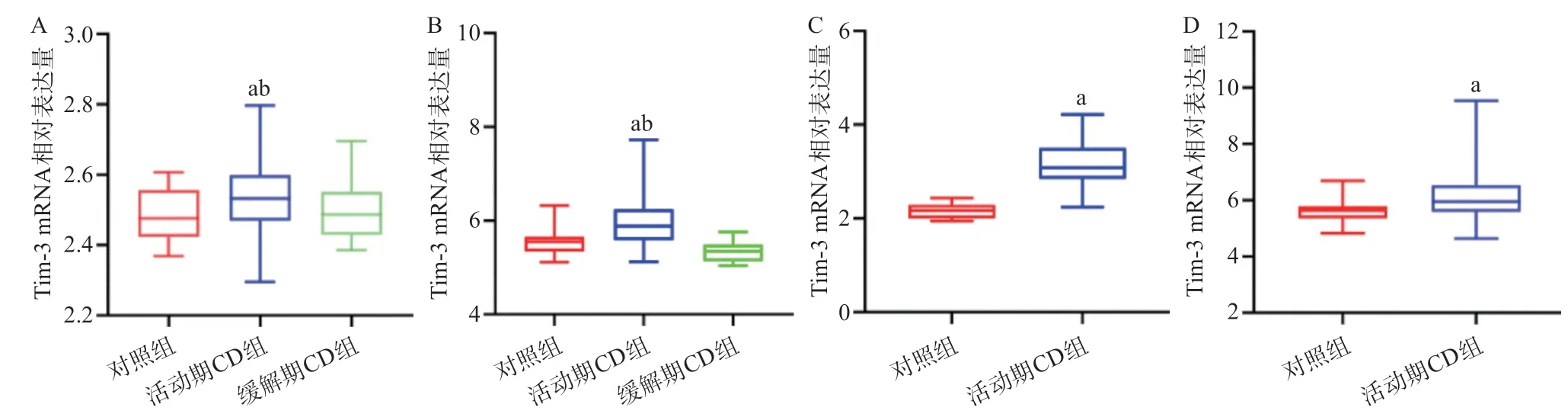
图1 利用GEO数据库中的转录组芯片GSE112366(A)、GSE75214(B)、GSE16879(C)和GSE186582(D)分析肠组织中Tim-3的mRNA表达水平
2.2 Tim-3的mRNA表达水平与CD患者疾病严重程度的关系及与CD患者生物制剂疗效的关系 从GSE112366数据集中筛选有记录CD简化内镜(SES-CD)评分的活动期CD患者,利用Spearman秩相关分析,观察肠组织Tim-3的mRNA表达水平与SES-CD评分之间的关系。活动期CD患者肠组织Tim-3的mRNA表达水平与SES-CD评分呈正相关(r=0.39,P<0.001)。根据初次IFX治疗4~6周有无内镜下缓解,从GSE16879数据集中筛选对IFX治疗有应答的活动期CD患者19例,发现IFX治疗后CD患者肠组织中Tim-3的mRNA表达水平较IFX治疗前显著降低(P<0.01)。根据初次UST治疗6周有无临床应答,从GSE112366数据集中筛选对UST有应答的活动期CD患者16例,发现UST治疗后肠组织中Tim-3的mRNA表达水平较UST治疗前降低,但差异无统计学意义(P=0.07)。
为尝试探索肠组织Tim-3的mRNA表达水平在CD患者中是否可以发挥早期的生物制剂疗效预测作用,我们比较第0周CD患者IFX或UST治疗前,IFX应答组与IFX无应答组肠组织中Tim-3基因的表达差异。与IFX无应答组相比,IFX应答组第0周肠组织Tim-3表达水平较低(P<0.05);而CD肠组织Tim-3表达水平在UST应答组和UST无应答组间差异无统计学意义(P>0.05)。为进一步评估CD患者肠组织Tim-3的mRNA表达水平对预测IFX临床疗效的价值,本研究采用ROC曲线分析CD患者治疗第0周检测的肠组织Tim-3的mRNA表达水平对预测第4~6周IFX疗效的价值(AUC=0.70,P=0.04)。见图2。
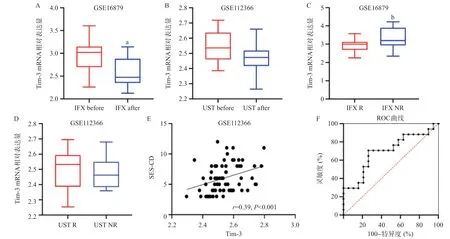
图2 利用GEO数据库中的转录组芯片GSE112366、GSE16879分析CD患者肠组织中Tim-3基因表达与疾病严重程度和生物制剂疗效的关系
2.3 Cibersort方法估算活动期CD样本中的巨噬细胞比例及其与肠组织中Tim-3 mRNA表达水平的相关性 基于Cibersort算法分析CD肠组织中浸润的M0、M1和M2巨噬细胞比例。相关性分析结果显示,在GSE186582、GSE75214和GSE112366数据集中,活动期CD患者肠组织Tim-3的表达水平与巨噬细胞M0比例呈正相关(r=0.45,P<0.05;r=0.48,P<0.05;r=0.34,P<0.05),见图3。在GSE186582、GSE16879和GSE75214数据集中,活动期CD患者肠组织Tim-3的mRNA表达水平与巨噬细胞M1比例呈正相关(r=0.54,P<0.001;r=0.53,P<0.01;r= 0.61,P<0.001),见图4。而仅在GSE186582数据集中发现,活动期CD患者肠组织Tim-3的mRNA表达水平与巨噬细胞M2比例呈负相关(r=-0.43,P<0.001),见图5。

图3 肠组织中Tim-3的mRNA表达水平与M0型巨噬细胞比例的相关性分析
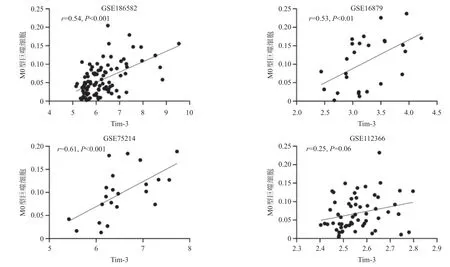
图4 肠组织中Tim-3的mRNA表达水平与M1型巨噬细胞比例的相关性分析

图5 肠组织中Tim-3的mRNA表达水平与M2型巨噬细胞比例的相关性分析
2.4 免疫荧光技术检测CD患者和健康对照者肠组织中Tim-3及CD68表达和CD68+Tim-3+巨噬细胞的比例 免疫荧光染色结果显示,CD患者炎性肠黏膜中CD68和Tim-3表达均高于健康对照者正常肠黏膜。此外,CD68+Tim-3+双阳性巨噬细胞占CD68+巨噬细胞比例在CD患者炎性部位亦显著增多(P<0.05)。见图6。

图6 免疫荧光技术检测CD患者和健康对照者肠组织中Tim-3、CD68的表达和CD68+ Tim-3+巨噬细胞占CD68+巨噬细胞的比例
2.5 荧光定量PCR法检测CD患者和健康对照者肠组织中Tim-3及M1、M2巨噬细胞相关细胞因子的表达 活动期CD患者肠组织中Tim-3 mRNA表达水平显著高于对照组,差异有统计学意义(P<0.05)。Spearman秩相关分析结果显示,活动期CD患者肠组织Tim-3 mRNA表达水平与M1型巨噬细胞相关细胞因子TNF-α和IL-1β的表达呈正相关(r=0.93,P<0.01;r=0.85,P<0.05),而与M2型巨噬细胞相关细胞因子IL-10和TGF-β的表达无明显相关性(r=-0.04,P>0.05;r=0.22,P>0.05)。
3 讨论
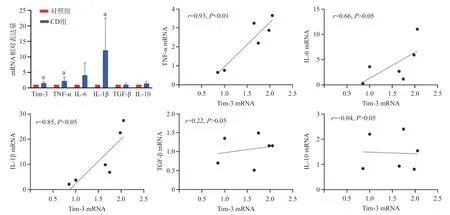
图7 荧光定量PCR检测活动期CD肠组织中Tim-3和M1、M2相关细胞因子的mRNA表达水平观察活动期CD患者中Tim-3表达水平与M1、M2相关细胞因子水平之间的关系
KIM等[12]研究发现,活动期儿童CD患者肠组织中Tim-3的mRNA表达水平较健康对照者升高,而这些患者经IFX治疗后肠组织中Tim-3的mRNA表达水平显著降低,此外,在IFX治疗期间,CD患者结肠黏膜中的Tim-3的mRNA表达水平与儿童CDAI呈正相关。与之一致,本研究通过生物信息学分析发现,与健康对照组相比,活动期CD患者肠组织中Tim-3表达升高,且与内镜下SES-CD评分呈正相关。此外,对同一CD患者IFX或UST治疗前后的情况进行自身比较发现,生物制剂治疗后肠组织Tim-3的mRNA表达水平亦显著下降。基于生物信息学的研究基础,本研究进一步通过免疫荧光技术和实时荧光定量PCR法在本中心的临床标本中进行验证,结果显示活动期CD患者炎症肠组织中Tim-3表达较健康对照者正常肠黏膜显著升高。上述结果提示活动期CD患者肠组织Tim-3表达变化与疾病活动密切相关。
迄今为止,多项研究表明Tim-3表达水平是反映自身免疫性疾病活动度的重要参数。ASANO等[13]研究发现,与健康对照者相比,SLE患者血清中可溶性Tim-3(soluable Tim-3, sTim-3)水平升高,且与SLE疾病活动指数SLEDAI-2K评分显著正相关,进一步分层分析发现,合并肾脏受累的SLE患者血清sTim-3水平较无肾脏病SLE患者显著升高,提示血清sTim-3可以作为SLE疾病活动度的预测指标。而对类风湿性关节炎患者的研究发现,类风湿性关节炎患者外周血单个核细胞和关节液中Tim-3+细胞比例较健康对照者升高,进一步流式细胞术证实CD4+、CD8+、自然杀伤T细胞和单核细胞上的Tim-3表达均增高,但外周血Tim-3+细胞比例与疾病活动指数和血清TNF-α水平呈负相关[14]。
研究表明,CD患者肠道手术史、疾病部位、是否合用免疫抑制剂、CRP等可能是影响IFX疗效的重要因素[15]。但目前仍缺乏统一认可的,可特异性用于评估和预测IFX临床疗效的指标。本研究创新性采用ROC曲线评估CD患者肠道Tim-3的mRNA表达水平对预测IFX疗效的临床价值,结果发现在活动期CD患者接受IFX治疗前,检测肠组织Tim-3表达水平对IFX治疗第0~6周的临床疗效可能具有预测价值,有望成为评估IFX疗效的新指标。
目前普遍认为M1/M2型巨噬细胞极化是维持体内免疫炎症稳态的重要机制,但Tim-3在巨噬细胞中的作用仍有争议,在不同疾病中,巨噬细胞上的Tim-3可以调节M1和M2巨噬细胞之间的比例,作为促炎或抗炎调节因子[16-17]。YU等[16]研究发现,与野生型小鼠比较,脑出血小鼠脑血肿组织中M1型巨噬细胞比例增多,从而引起脑组织损伤。JIANG 等[17]对DSS诱导的急性结肠炎小鼠研究发现,注射抗Tim-3抗体会导致小鼠结肠组织中M1型巨噬细胞增加,小鼠病情加重,而Tim-3的转基因过表达则可诱导M1型巨噬细胞减少,缓解病情。进一步分析发现Tim-3可能通过下游转录因子TRIF和IRF3促进M1巨噬细胞极化。本研究基于Cibersort算法分析CD肠组织中浸润的巨噬细胞比例,发现活动期CD患者肠组织Tim-3的mRNA表达水平与巨噬细胞M0和M1比例呈正相关,免疫荧光结果亦发现,活动期CD患者炎性肠组织中CD68+Tim-3+巨噬细胞较正常肠黏膜显著增多,荧光定量PCR结果提示Tim-3的mRNA表达水平与巨噬细胞M1相关细胞因子水平呈正相关,这提示Tim-3表达上调可能导致局部肠组织促炎型巨噬细胞应答上调,从而在CD疾病进展中发挥重要作用。导致本研究结果与基于小鼠的研究相矛盾原因可能如下:体外研究结果发现脂多糖可能通过Tim-3/galectin-9影响M1/M2巨噬细胞极化,且在不同时间点M1/M2比例存在动态变化[18],因此我们推测在疾病的不同阶段,Tim-3可能发挥不同作用。而既往的动物研究仅通过化学诱导方式模拟急性肠炎的过程,未模拟慢性活动性肠炎,这可能是本研究结果与既往基于小鼠的研究相矛盾的原因之一,此外,化学诱导的结肠炎模型仅能模拟IBD的某一方面,本研究拟后续采用基因工程模型或转基因IBD动物模型进一步探讨Tim-3在IBD中的作用。
综上所述,本研究采用生物信息学和免疫荧光方法探讨Tim-3表达水平与CD发生发展的关系,结果表明Tim-3可能通过影响M1型巨噬细胞极化在CD发生发展中扮演重要角色,且可能预测早期IFX疗效(高水平Tim-3表达提示预后较差)。这些结果为Tim-3在临床治疗中的应用和CD的分子靶向治疗提供了新的理论支持,但本研究患者样本量较少,仍需后续加大样本量,及更深入的机制研究加以证实。
