生物固碳:从自然生物到人工合成
2022-12-14肖璐李寅
肖璐,李寅
(1中国科学院微生物研究所中国科学院微生物生理与代谢工程重点实验室微生物资源前期开发国家重点实验室,北京 100101;2中国科学院深圳先进技术研究院合成生物学研究所,广东,深圳 518055)
近年来,由于大气中二氧化碳(CO2)浓度上升所导致的全球气候变暖引起了全世界的高度关注。2020年9月,我国宣布了“二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”的目标。“碳达峰、碳中和”的“双碳”目标,已经成为产业结构再升级和区域发展格局再重构的重大历史契机。为实现这一目标,一方面需要在建筑、工业、交通、电力、炼油、农业等现有经济部门布局下做“减法”,调整能源和产业结构,大规模减少碳排放,同时增加碳捕集与封存,如植树造林等活动,尽早实现“碳达峰”。另一方面则应在未来绿色产业布局方面大力做“加法”,加速摆脱由煤炭、石油和天然气为主要燃料和原料的传统能源和工业体系,快速培育形成低碳、“零”碳排放的工业技术体系和产业布局,推动区域经济在实现“碳中和”目标下的高速可持续发展。
将CO2转化为人类可以利用的有机物是利用CO2的有效途径之一。在自然界中,植物和微生物利用自养固碳途径将CO2转化为有机物,每年可固定超过7×1016g的无机碳[1]。通过合成生物学和代谢工程的手段对蓝藻等自养微生物进行改造,可以将CO2转化为乙醇、乙酸、丙酮、丁醇、乳酸等化学品[2-4]。随着合成生物学和生物技术的发展,近年来生物固碳的相关研究取得了很大进展,已有一些文献进行评述。如Gong等[5-6]详细介绍了六条天然固碳途径,并总结了合成生物学应用于生物固碳研究取得的进展;Correa等[7]在天然固碳途径的基础上,讨论了人工固碳途径的最新进展和嗜热微生物代谢在生物固碳领域的重要性。本文从天然固碳途径、人工固碳途径以及生物固碳途径的能量供给三个方面,总结和介绍人工生物固碳研究的最新进展。
1 天然固碳途径的改造和应用
如表1所示,自然界中已经发现六条天然固碳途径,分别为卡尔文循环(Calvin-Benson-Bassham cycle)、还原性TCA循环(reductive tricarboxylic acid cycle)、WL途径(Wood-Ljungdahl pathway)、3-羟基丙酸双循环(3-hydroxypropionate bi-cycle)、3-羟基丙酸/4-羟基丁酸循环(3-hydroxypropionate/4-hydroxybutyrate cycle)和二羧酸/4-羟基丁酸循环(dicarboxylate/4-hydroxybutyrate cycle)[5]。

表1 六种天然固碳途径的比较Tab.1 Comparison of six natural carbon fixation pathways
卡尔文循环是最早发现的生物固碳循环,也是被研究最多的生物固碳循环[8]。卡尔文循环是自然界中最主要的固碳途径,地球上超过90%的碳固定是由卡尔文循环完成的[1,14]。2016年,Antonovsky等将卡尔文循环中的1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)和磷酸核酮糖激酶(PRK)的基因导入大肠杆菌中,实现了卡尔文循环在异养微生物中的重构[15]。近年来对卡尔文循环的应用研究也较多。将卡尔文循环中的Rubisco等酶导入大肠杆菌、酵母等异养菌中,可以减少在发酵生产目标化学品时放出的CO2,从而提高产物的得率。例如,在大肠杆菌中单独或组合表达卡尔文循环中的Rubisco和PRK两个酶,可将每消耗1 mol阿拉伯糖放出的CO2从0.731 mol减少至0.621 mol[16];而在酿酒酵母中表达卡尔文循环中的Rubisco和PRK,则可以减少副产物的产生,将乙醇产量提高10%[17]。
对卡尔文循环的改造,主要集中在对Rubisco的改造上[18]。Rubisco是一个双功能酶,会同时催化底物RuBP与CO2和O2分别发生羧化反应和氧化反应,由于O2会竞争该酶的活性中心,从而影响其固碳活性[19-20]。为了提高Rubisco的羧化活性,本研究组前期开发了一种基于大肠杆菌的活性导向筛选系统,使大肠杆菌的生长与Rubisco的羧化活性关联起来。利用该系统对聚球藻(Synechococcussp.)PCC7002的Rubisco进行定向进化,得到的突变体对CO2的比酶活提高了85%[21]。不同来源的Rubisco在酶学性质上差异较大。蓝藻Rubisco的固碳效率高,但对CO2/O2的选择性低;而C3植物中Rubisco的固碳效率低,但对CO2/O2的选择性高[18]。在一些研究中,为了解Rubisco的小亚基对酶学性质的影响,将不同来源Rubisco的小亚基与大亚基进行组装,获得了杂合的Rubisco,可以提高羧化活性或者对CO2/O2的选择性[22-23]。Rubisco改造的主要挑战是Rubisco高羧化活性和对CO2/O2的高选择性不能共存,需要对二者进行平衡[19,24]。对卡尔文循环进行改造,除了改造Rubisco,还可以改造途径中的景天庚酮糖-1,7-二磷酸酶、果糖-1,6-二磷酸醛缩酶和转酮醇酶等。在蓝藻中过表达这三种限速酶可以提高卡尔文循环的效率,从而提高蓝藻生产化合物的产量[25]。在烟草中过表达景天庚酮糖-1,7-二磷酸酶也可以提高卡尔文循环的固碳效率,进而改善烟草的生长[26]。
含有WL途径的微生物可以利用合成气发酵生产化学品。一些产乙酸菌中存在WL途径,所以它们可以利用CO2和CO作为碳源,利用H2作为能量来源产生乙酰辅酶A,合成乙酸、乙醇、丙酮、丁酸、丁醇和丁二醇等化学品[27-29]。合成气的主要成分为CO2、CO和H2,主要来源于煤、石油、生物质和有机废物等物质的气化,来源广泛且具有能量,是非常具有潜力的生物制造原料[30-31]。对含有WL途径的产乙酸菌等微生物进行改造,可以使它们能够将合成气高效转化为大宗化学品(表2),并且可以减少CO2和CO等废气对空气的污染。从表2中可以看出,微生物合成气发酵产丙酮、甲醇、乙醇和乙酸等化学品的产量很高(>40 g/L),其中丙酮的产量已经超过100 g/L[32]。

表2 含有WL途径的微生物利用合成气发酵生产化学品的产量Tab.2 Production of chemicals from syngas fermentation using microorganisms equipped with the WL pathway
3-羟基丙酸双循环与3-羟基丙酸/4-羟基丁酸循环的固碳酶相同,都是乙酰辅酶A羧化酶和丙酰辅酶羧化酶,两条途径也共有许多中间代谢产物,但是关于这两条途径的酶学比较研究表明,它们是独立进化的[40-41]。Liu等[42]通过定向进化对这两个途径的固碳酶丙酰辅酶A羧化酶进行改造,使其羧化活性提高了94倍,实现了从乙酰辅酶A高效地合成丁二酸。二羧酸/4-羟基丁酸循环的固碳酶为丙酮酸合酶和磷酸烯醇式丙酮酸羧化酶。磷酸烯醇式丙酮酸羧化酶的酶活较高,因此该途径的限速酶是丙酮酸合酶。丙酮酸合酶的还原羧化活性很低,且在体外环境中难以发生,反应所需的外源电子供体电势需低于−500 mV,才能有效驱动丙酮酸合酶还原羧化反应的发生[14,43-44]。目前仅有极少数丙酮酸合酶体外还原羧化反应的报道[45-47]。与丙酮酸合酶相似,α-酮戊二酸合酶催化的羧化反应也难以发生,需要极低电势的还原态铁氧还蛋白(Ferrodoxin,Fd)提供还原力来推动反应,这极大地限制了还原性TCA循环的应用。
2 人工固碳途径的研究进展
天然固碳途径存在一些缺陷,如固碳酶活性低导致途径的固碳效率较低;需要经过多步反应,对固碳效率有较大影响;有些天然固碳途径的固碳酶比较复杂且难以异源表达等。这些问题影响了天然固碳途径的应用。近年来,在合成生物学思想指导下,人工固碳途径得到广泛重视。相关研究主要包括两个方面:一是利用天然固碳途径中的固碳酶重新设计新的人工固碳途径;二是寻找新的高效固碳酶设计新的人工固碳途径。
2.1 利用天然固碳途径中的固碳酶重新设计途径
天然固碳途径一般比较长并且其中的固碳酶大多比较复杂,但也有一些固碳酶的活性很高,且结构比较简单,如磷酸烯醇式丙酮酸羧化酶等。一些研究者利用这些简单且活性高的固碳酶重新设计固碳途径,希望可以减少反应步骤,提高固碳效率。2010年,Bar-Even等利用自然界中已知的约5000种酶,计算设计了一系列人工固碳途径,对天然固碳途径和这些人工固碳途径进行比较后,发现高固碳效率的途径都具有比较相似的核心结构,他们将这一结构称为丙二酰辅酶A-草酰乙酸-乙醛酸(MOG)途径,其固碳效率比卡尔文循环高2~3倍[48]。作者使用MOG途径设计的C4-乙醛酸循环,理论上可以将C4植物中草酰乙酸被还原为苹果酸再脱羧生成丙酮酸时释放的CO2转化为乙醛酸,提高整体固碳效率。虽然到目前为止,C4-乙醛酸循环还没有在体外或微生物体内实现,但是可以为后续设计人工固碳途径提供新思路。
卡尔文循环不能直接生成2C产物,而需要先生成3C产物,再释放一个CO2生成乙酰辅酶A,从而造成碳损失。2018年,Yu等针对这一问题,设计了一条丙二酰辅酶A-甘油(MCG)途径[图1(a)]来增强卡尔文循环,从而实现卡尔文循环到乙酰辅酶A的高效合成[49]。Yu等在体外和大肠杆菌体内都证明了MCG途径的功能,并且将MCG途径导入聚球藻(Synechococcus elongates)中,证明了它可以增加聚球藻细胞中乙酰辅酶A的浓度,且碳酸氢盐的同化作用也增强了2倍左右。已有的天然和人工固碳途径通常包含了多个反应,大多超过10个反应。通常,固碳途径中的反应步骤越多,整体的固碳效率就会越低。针对这个问题,作者设计了一条最小化的人工合成固碳途径——POAP循环[50][图1(b)]。POAP循环是一个只包含四步反应的最简酶促碳固定循环,通过丙酮酸合酶和丙酮酸羧化酶两步反应进行固碳。丙酮酸合酶是POAP循环中最关键也最难实现羧化功能的酶,需要非常低电势的电子供体来驱动反应[46]。前已述及,在生物体内驱动这个反应的天然电子供体一般是Fd[51]。通过筛选一系列低电势的Fd,作者实现了丙酮酸合酶的还原羧化反应,在体外构建了POAP循环并实现了固碳功能,固碳速率达到8 nmol CO2/(min·mg固碳酶)。与已发现的天然固碳途径和人工固碳途径相比,POAP循环固定1分子CO2只需要消耗1分子ATP和0.5分子还原力,具有较高的能量效率。由于丙酮酸合酶是高温厌氧酶[52],所以POAP循环可以在厌氧和相对较高温度(50℃)下进行CO2固定,为了解和研究远古生物中CO2的固定提供一个可供选择的模型。
2.2 寻找新的高效固碳酶用于人工固碳途径
除了天然固碳途径中的固碳酶外,自然界中可以用于固碳的羧化酶非常多,其中有一些羧化酶活性非常高。利用这些羧化酶设计全新的固碳途径,可以显著提高固碳效率。2016年,Schwander等成功在体外构建了一条以CO2为底物从头合成终产物乙醛酸的固碳循环——CETCH循环[53][图1(c)]。CETCH循环的核心固碳酶是巴豆酰辅酶A羧化酶/还原酶,该酶的比酶活可以达到110 U/mg,是迄今为止固碳活性最高的羧化酶,但这个酶在进化过程中并没有用于自养固碳途径[57-58]。CETCH循环仅利用巴豆酰辅酶A羧化酶/还原酶作为固碳酶,途径的固碳效率就达到了5 nmol CO2/(min·mg核心酶)。CETCH循环是第1条非天然人工固碳途径,其在体外实现固碳功能,为创建人工固碳途径开辟了新的道路[59]。2021年,人工生物固碳领域在CETCH循环之后又迎来了重大突破。淀粉是具有重要营养价值的主要碳水化合物,而合成人造淀粉是一个较大的挑战。Cai等设计了一条ASAP途径[图1(d)],利用化学-生物无细胞系统,实现以CO2和H2为原料合成淀粉[54]。ASAP途径在H2驱动下将CO2转化为淀粉的速率可以达到22 nmol C/(min·mg总催化剂),比玉米中的淀粉合成速率高约8.5倍,为淀粉合成走出农业路线开辟了新的道路。
除了设计利用CO2的人工固碳途径外,因为CO2可以高效地转化为一碳化合物[60],所以通过利用一碳化合物也可以实现固碳。CO2直接电化学还原可以产生甲酸,能量效率大于40%[61];CO2加氢可以生成甲醇,这个过程的能量效率可以达到50%以上[62]。Lu等设计和构建了从甲醛到乙酰辅酶A的全新途径(SACA途径)[图1(e)],可以利用甲醛生成乙酰辅酶A[55],体外构建的SACA途径对甲醛的转化率达到了50%。这条途径是乙酰辅酶A生物合成途径中最短的途径,并且不依赖于ATP,为未来从一碳化合物生产乙酰辅酶A及其衍生化学品提供了可能性,具有很大的应用潜力。
SACA途径的第一步和第二步的酶分别是乙醇醛合酶和磷酸酮醇酶,顺序催化两个甲醇分子缩合为一个乙醇醛及将乙醇醛转化为乙酰磷酸。这两个酶都是通过人工设计得到,然后应用于人工固碳途径中。在人工固碳途径中,酶是核心,为了提高酶的活性、选择性等,对这些酶进行计算设计和改造具有重要的意义和应用价值。Siegel等[56]通过计算设计获得了一种甲醛酶,能够催化3个甲醛分子生成1个二羟丙酮分子,实现一碳化合物向三碳化合物的转变。作者利用所获得的甲醛酶,设计了一条固碳途径并命名为甲醛酶途径[图1(f)],该途径通过五步反应可将CO2转化为磷酸二羟丙酮,表明新酶设计可以促进构建全新的人工固碳途径。
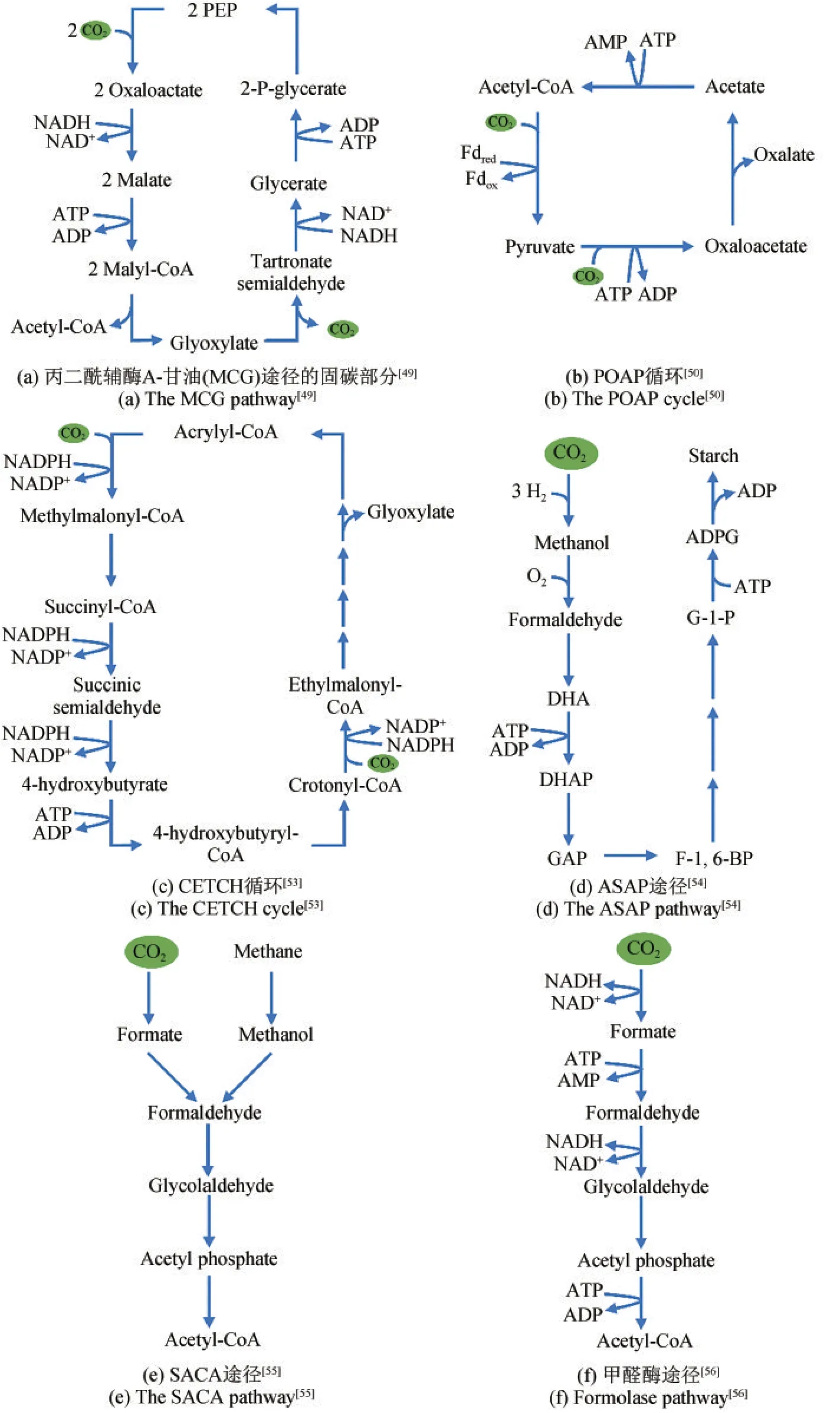
图1 代表性的人工固碳途径Fig.1 Representative synthetic carbon fixation pathways
2.3 人工固碳途径的讨论
从第一条人工固碳途径CETCH循环到CO2合成淀粉的ASAP途径,近年人工固碳途径的研究取得了突破性进展。这些人工固碳途径总体可以分为两类(表3):一类是需要添加共底物辅助固碳的途径,如已经在体内成功构建和应用的MCG途径,需要磷酸烯醇式丙酮酸(PEP)作为共底物;另一类是可以利用CO2从头合成有机物的途径,如CETCH循环、POAP循环和ASAP途径。从固碳效率来说,这些人工合成固碳途径已经超过天然的卡尔文循环[2.58 nmol C/(min·mg总酶量)][54],其中ASAP途 径固碳速率最高,淀粉合成速率可以达到22 nmol C/(min·mg总酶量)。从反应数来看,SACA途径由于以乙醛作为底物合成乙酰辅酶A,只需要3步反应即可实现;在以CO2为原料从头合成产物的途径中,POAP循环只需要4步反应,是目前最短、最简单的固碳途径。从能量消耗来说,人工固碳途径普遍低于天然固碳途径,如CETCH循环和POAP循环固定酶分子CO2只需要1分子ATP和0.5/1分子还原力。这与固碳途径的产物有关,CETCH循环和POAP循环的产物乙醛酸和草酸的氧化程度较高,因此需要的能量输入较少。

表3 人工固碳途径的比较Tab.3 Comparison of artificial carbon fixation pathways
除了这些人工固碳途径外,在改造大肠杆菌实现基于一碳化合物的半自养生长方面,相关研究也取得了很大的进展。如Gleizer等[63]在大肠杆菌中表达Rubisco和磷酸核糖激酶,使大肠杆菌能够固定CO2合成生物质。在该菌中共表达甲酸脱氢酶,再经过适应性进化后,实现了大肠杆菌利用甲酸作为碳源和能源进行自养生长。Chen等[64]和Chen等[65]敲除了大肠杆菌磷酸戊糖途径中的戊糖利用必需基因,然后表达了核酮糖-单磷酸(RuMP)途径中的相关酶,构建了一株“合成甲醇营养缺陷”菌株,该菌株只有在甲醇存在时才能利用木糖或核糖生长。在此基础上,对“合成甲醇营养缺陷”菌株的代谢进行重新编程和适应性进化,最终得到了能以甲醇为唯一碳源生长的大肠杆菌。
3 生物固碳途径的能量来源
生物的营养方式一般分为自养和异养。异养微生物通过有机物提供碳源和能量,而自养微生物利用无机碳作为碳源,通过固碳途径将无机碳转化为有机碳所需的能量一般来源于光能或无机物氧化。化能自养型微生物的能量一般来源于硫化合物、氢气、金属和氨等物质的氧化[66-67],在这一生命过程中能量主要是通过两种形式被消耗,即还原力和ATP。
3.1 固碳途径的还原力来源
CO2的固定需要摄入还原力。CO2中的碳是+4价,是碳的最高价态,而在有机物中碳是低价态的,所以需要还原力将CO2中高价态的碳还原为有机物中低价态的碳。在固碳途径中还原力的表现形式主要有:NAD(P)H和还原态Fd等,如还原性TCA循环中异柠檬酸脱氢酶利用NAD(P)H中的还原力来固定CO2,而二羧酸/4-羟基丁酸中丙酮酸合酶固定CO2需要还原态的Fd提供还原力。
天然固碳途径一般存在于自养生物中,固碳途径所需的还原力一般来源于光能和化学能。在光合自养生物中,还原力来源于光合作用[68]。光反应过程中生成的NADPH和还原态的Fd可以作为还原力用于固碳途径[69]。而在化能自养生物中,还原力一般来源于硫化合物、H2、CO等物质的氧化[70]。例如一些微生物体内的氢酶可以吸收H2,放出电子传递给NADP+和氧化态的Fd,从而生成NADH和还原态的Fd[71],然后通过体内的一些转氢酶将电子传递给NADP+生成NADPH,从而用于固碳途径[72,73]。一些极端环境微生物体内的异化亚硫酸盐还原酶和硫酸腺苷还原酶等,可以催化含硫化合物氧化并放出电子,从而生成NAD(P)H和还原态Fd,驱动固碳反应[74,75]。
近年来,也有一些研究将天然固碳途径或者人工固碳途径导入异养微生物中,使它们能够利用有机物中的能量来固定CO2供给微生物生长或生产化学品,如前文中提到的在大肠杆菌体内构建MCG途径并进行固碳[49]。异养微生物中的能量来源于有机物,还原力的来源主要是有机物氧化释放出电子,电子传递到NAD(P)+和氧化态的Fd等电子受体中,从而生成NAD(P)H和还原态Fd。所以,对微生物体内还原力的研究也可以应用于微生物体内固碳途径,从而提高固碳能力。在光合微生物中,NADPH是光合作用产生还原力的主要形式,但大多数脱氢酶更偏向于利用NADH作为还原力,若还原力的需求和供给耦合效率不高,就会造成光合微生物还原力的浪费。针对这一问题,本研究组将电子传递蛋白OmcS引入到聚球藻(Synechococcus elongatusUTEX 2973)中,证明了OmcS可以将多余的电子从质体醌(PQ)传递至光系统Ⅰ(PSⅠ)中,从而推动循环电子转移,使细胞内的NADH浓度增加了60%,乳酸产量增加了4倍,生物量增加了60%,改善了蓝藻中光合作用的NADH/NADPH辅因子不平衡问题[76]。在另外一些研究中,也通过在微生物中引入催化NAD(P)H再生的酶来提高体内NAD(P)H水平。Wang等在克雷伯氏菌(Klebsiella pneumoniae)中引入NAD+依赖的甲酸脱氢酶、吡啶核苷酸转氢酶和葡萄糖脱氢酶等催化NADH再生的酶,使胞内NADH/NAD+比例增加了78%~135%[77]。Xu等在大肠杆菌中引入巨大芽孢杆菌(Bacillus megaterium)来源的两个葡萄糖脱氢酶,使大肠杆菌胞内的葡萄糖脱氢酶活性增强了近10倍。葡萄糖脱氢酶可以催化葡萄糖发生脱氢反应生成NADPH,所以这一策略使NADPH在体内和体外都能有效再生[78]。
还原态Fd也是还原力的一种表现形式。Fd是一类分子量很小的可溶性铁硫蛋白,是一种重要的电子载体,可为众多的反应提供还原力[79]。Fd可以根据铁原子氧化态的变化来接受或者释放电子。Fd的氧化还原电位通常低于−200 mV,在专性厌氧微生物中可以低至−500 mV以下[80-81],因此Fd不仅在各种代谢过程中充当电子载体,在一些需要低电势驱动的氧化还原反应中也具有重要作用[82-83]。在天然固碳途径中,α-酮戊二酸合酶和丙酮酸合酶等酶催化的反应需要很低的电势(低于-500 mV)[44],这些反应都需要还原态Fd的参与。在近年的研究中,厌氧微生物来源的[4Fe-4S]等低电势Fd已经可以通过异源表达纯化,并在大肠杆菌体内和体外发挥作用[84-85]。
3.2 固碳途径中的ATP来源
ATP是一种高能磷酸化合物,水解时能够释放出大量的自由能。细胞中多种代谢反应都需要ATP的参与,每条固碳途径都需要消耗ATP。ATP在胞内的生成主要是通过两种方式:一种是底物水平磷酸化;一种是ATP合酶利用膜内外质子梯度来合成ATP,包括氧化磷酸化和光合磷酸化等。
生物固碳途径需要固定CO2并将其还原为有机物,这些反应通常在热力学上是不利的,所以固碳途径需要ATP摄入,ATP水解释放的大量自由能可以为这些反应提供能量[86-87]。提高ATP的水平对固碳途径具有推动作用,相关研究主要包括提高底物水平磷酸化酶表达、增强电子传递链和质子梯度以及提高ATP合酶的活性等方面[88]。
在微生物体内提高催化底物水平磷酸化反应的酶表达水平和活性可以提高胞内的ATP水平,从而提高目标化合物的产量。例如,在大肠杆菌中提高磷酸烯醇式丙酮酸羧激酶的基因表达水平和活性,可以增强CO2的固定并增加ATP产量[89]。ATP合成主要是通过电子传递链传递电子形成的质子梯度驱动,所以电子传递链和质子梯度的强度对ATP合成有很大影响。pH值对质子梯度的影响很大,酸性条件有利于质子梯度的产生。例如,在酸性条件下,出芽短梗霉(Aureobasidium pullulans)和白色链霉菌(Streptomyces albulus)的胞内ATP水平都有明显提高[90-91]。ATP合酶是生成ATP的关键酶,提高胞内ATP水平最直接的方法是对ATP合酶进行改造和过量表达,以提高ATP合酶活性。虽然ATP合酶非常复杂,但是在一些研究中,过表达体内ATP合酶,对提高胞内ATP水平也有一定的效果。Xu等通过在念珠菌(Candida utilis)中表达来自拟南芥的ATP合酶基因,增强了ATP再生和胞内ATP供应[92]。此外,在酵母和拟南芥中过表达拟南芥来源的ATP合酶,都能提高ATP合成水平[93]。
3.3 非生物能驱动的固碳途径研究进展
还原力和ATP是生物固碳途径的直接能量来源,而光能和有机物、硫化物、H2等化学能可以转化为还原力和ATP,从而间接为生物固碳途径提供能量。近年来,一些研究者们尝试在固碳途径中直接引入化学能、光能以及电能等能量形式,使生物固碳与化学催化、光催化和电催化等相结合。由于热力学限制,CO2的还原不能自发进行,需要外部能量来驱动,这些能量形式为CO2的还原提供了更强的驱动力,而将它们与生物固碳结合可以将CO2转化为更高价值的C2+产品[94]。如前文提到的ASAP途径中,Cai等在途径的第一步利用ZnO-ZrO2催化剂催化令CO2和氢气生成甲醇,催化甲醇生成速率达到0.25 g/(h·g催化剂),甲醇再经过一系列的酶催化合成淀粉[54]。
光催化CO2的还原类似于自然界的光合作用,植物和光合微生物通过吸收光能将CO2和H2O转化为有机物的过程,这一过程的能量来源是光能。而光催化CO2的还原可以看做是人工光合作用,其中的光催化剂是半导体或者染料。光催化CO2的还原反应条件非常温和,可与生物固碳相结合,将半导体光催化纳米材料与微生物形成杂化体系,即半人 工光合作 用系统[95]。Sakimoto等[96]和Zhang等[97]用硫化镉纳米材料CdS和金纳米材料AuNCs诱导非光合细菌Moorella thermoacetica自光敏化,从而利用光能将CO2还原为乙酸。在模拟日光下,量子产率分别达到了2.44%±0.62%和2.86%±0.38%,前者在435~485 nm LED灯下量子产率达到52%±17%的极高水平。Wang等[98]将硫化镉(CdS)纳米颗粒覆在光合细菌Rhodopseudomonas palustris表面。在可见光作用下,R.palustris的生物质、类胡萝卜素和聚-β-羟基丁酸酯(PHB)的产量分别增加到148%、122%和147%,并且光合效率从原来的4.31%提高到5.98%,这表明CdS纳米颗粒在电子产生和传导中发挥了重要作用。
CO2电化学还原就是一个利用电能将CO2在电解池中还原的过程。通过将电能引入到酶催化反应中可以实现生物固碳,如甲酸脱氢酶、甲醛脱氢酶等催化的固碳反应[99]。Reisner团队[100]将甲酸脱氢酶与金属氧化物TiO2偶联,实现高效电催化CO2还原为甲酸,转换数达到(11±1)s-1,是Rubisco转换数的近10倍。还有一些微生物可以耐受低电压,并利用电子作为能量来源,利用这些微生物可以开发用于CO2还原的微生物电催化,如Methanococcus maripaludis、Methanolacinia petroleumearia、Methanobacterium congolense等产甲烷菌。Schlager等[101]利用产甲烷菌制造微生物电解池,以CO2作为唯一碳源,利用电能生产甲烷,生产率达到了22%。
4 生物固碳面临的问题及发展趋势
目前,大多数研究集中在利用天然固碳途径来固定CO2生产化学品,或对天然固碳途径进行改造来提高它们的固碳效率。其中,考虑到Rubisco是自然界中分布最广泛的固碳酶,与所有植物的生长和农业生产息息相关[102],因此关于Rubisco改造和卡尔文循环应用的研究较多。自然界中可能还存在未被发现的天然固碳途径,挖掘新的、高效的天然固碳途径并实现应用,是生物固碳的一个重要方向。从设计新的高效人工固碳途径角度,固碳酶的选择和设计是关键。天然固碳途径中一些酶活性很高,如磷酸烯醇式丙酮酸羧化酶等。除了这些酶外,大自然中可以固碳的羧化酶非常多,其中有一些酶活性很高,但是在生物进化的过程中却并没有用于固碳途径中。以这些高活性的羧化酶为基础,有可能设计出更高效的人工合成固碳途径,提高固碳途径的效率。因此,挖掘或设计新型、高效固碳酶,并用于人工固碳途径的设计与应用,也是一个重要的方向。
对CO2固定的研究除了设计人工固碳途径外,另一个重要的因素就是能量,而目前对于CO2固定的能量研究较少。很多自养微生物可以利用光能和H2、硫化物等无机化学能进行固碳[74]。对这些自养微生物进行工程改造,使它们能够生产目标化学品,是一个重要的努力方向。但是自养微生物一般生长比较慢,生产化学品的产量较低,一般难以满足工业化的需求。因此,将自养微生物的固碳途径导入异养微生物中进行异养固碳也是目前的一个热点。大肠杆菌的遗传背景清晰、遗传操作简单、生长速度快,是异养固碳生产化学品非常合适的宿主。另外,也可以考虑引入新的能量利用途径以及新的能量形式进行生物固碳研究。对光能的利用不仅可以通过光合作用,也可以通过一些非典型光合系统,例如视紫红质和一些可以吸收光能的生物材料等。近年来,电化学研究的发展也为利用电能进行生物固碳提供了可能性,未来生物电能利用系统的设计、构建在生物固碳应用方面,还有很大的想象和发展空间。
合成生物学和生物技术的迅速发展为生物固碳研究提供了多种方向和可能性。研究者们对自养生物、固碳途径、固碳酶和能量的认识和应用越来越丰富。但是由于CO2是高度氧化的产物,电子输入CO2的速度决定了CO2还原的速度。未来,生物-化学相组合的技术体系,或许会成为廉价、高效CO2还原和固定转化的核心方向。
