蟾蜍类用药对结直肠癌的影响及潜在机制
2022-12-14彭琰杨柱黄洪李应杰杨兵唐东昕吴文宇龙奉玺
彭琰, 杨柱, 黄洪, 李应杰, 杨兵, 唐东昕, 吴文宇, 龙奉玺
1.贵州中医药大学,贵州 贵阳 550002;2.贵州中医药大学第一附属医院,贵州 贵阳 550001
结直肠癌(colorectal cancer,CRC)是全球常见的恶性肿瘤之一,其发病率仅次于肺癌[1]。在我国CRC 的发病率呈上升趋势,且CRC 致病因素复杂,涉及遗传、环境、饮食习惯及息肉病变等,对于CRC 新药的开发及多靶点治疗研究已刻不容缓[2-3]。据相关临床诊疗研究提示,中医药可全程参与CRC 的治疗,且通过中医药联合放化疗或单纯中医药治疗可影响患者术后的康复,以防止肿瘤的增殖、侵袭或转移[4]。蟾蜍作为药物在临床中应用历史悠久,其全身皆可作为药用,临床上常以蟾蜍药用部位蟾酥和蟾皮入药,诸多古籍中记载了蟾蜍具有治疗痈肿、肿痛、热病之功效[5]。现代药理研究表明,蟾蜍药用部位及蟾蜍类制剂具有广谱抗癌作用,临床中主要用于CRC 患者[6-8]。因此,本文总结了CRC 的病因病机及临床诊疗现状,归纳整理了蟾蜍的主要有效成分治疗CRC 的药理作用及相关制剂的临床运用,以期为进一步开发抗CRC药物及临床用药提供理论参考。
1 CRC的病因认识及治疗现状
1.1 西医认识
CRC 的发病机制尚不完全明确。有研究表明,CRC 的发生发展与遗传,环境和生活方式等多方面因素有关[9]。研究发现,CRC患病的高危因素还与家族史、肥胖、吸烟、红肉和加工肉类摄入、糖尿病、饮酒、慢性炎症性肠病等密切相关[10]。CRC发病机制与多条靶点通路有关,如Wnt/β-catenin 通路、血管内皮生长因子(vascular endothelial growth factor,VEGF)通路、法尼醇X 受体(farnesoid X receptor,FXR)信号传导、核因子-κB(nuclear factor kappa-B,NF-κB)信号通路等[2]。根据美国癌症联合会(American Joint Committee on Cancer,AJCC)TNM 分期系统(第八版)报道显示,CRC病理分期分为0期、Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期[11]。处于早期的CRC 患者临床表现无明显症状,随着病情发展继而出现排便习惯改变,大便性状改变,伴随着腹痛或腹部不适,肠梗阻或贫血、消瘦、乏力、低热等全身症状[12]。
在CRC 患者临床治疗中,常结合患者病情进行综合考虑,合理选择具备可行性的治疗方案。以手术切除为主的多学科综合治疗是CRC 治疗的重要原则,但不同的手术方式选择也各有利弊[13]。为降低术后转移风险,放化疗可在手术治疗前后进行辅助配合,术前放化疗为新辅助疗法,术后为辅助放化疗。高度微卫星不稳定(microsatellite instability-high,MSI-H)或错配修复功能缺陷(deficient mismatch repair,d-MMR)的CRC 患者对免疫治疗较为敏感,转移性结直肠癌(metastatic colorectal cancer,mCRC)患者可使用免疫检查点抑制剂帕博利珠单抗[14]。局部晚期直肠癌治疗以放疗为主,但远处转移风险仍高达30%[15]。对于晚期CRC,靶向药物治疗已趋于成熟,已发现并在临床运用的CRC 分子靶点有表皮生长因子受体(epidermal growth factor receptor,EGFR)、血管内皮 生 长 因 子(vascular endothelial growth factor,VEGF)、 人 类 表 皮 生 长 因 子 受 体 2(human epidermal growth factor receptor 2,HER2)等[16]。多学科协作组(multi-disciplinary team,MDT)诊疗模式在CRC 全程治疗中被广泛运用,一项荟萃分析结果表明,MDT 对延长CRC 患者生存期有积极作用[17]。
1.2 中医认识
中医上并无“结直肠癌”这一病名,而是根据其发病及临床特点将CRC 归属于中医学的“肠蕈”“肠积”“积聚”“肠风”等病的范畴。CRC发病因素分为内因和外因,内因主要为正气虚损,外因为邪毒侵犯,两者在病情发展中相互影响,导致人体正气虚损,邪毒更易入侵,正气既虚,无力抵抗外邪,易使毒邪留于体内,瘀、毒留滞于大肠,导致腑气不通,大肠传导失司,日久壅塞不通,传导失职,则积生于内,化郁化火而发为CRC。因此,CRC 本因是正气亏虚,标邪是气、瘀、毒,但随着CRC 的发生发展,患者常表现出早期以实证为主,中晚期以虚实夹杂证为主的证候特点[18]。
中医治疗CRC 注重辨证施治。目前,中医对CRC 证型尚无统一标准,临床用药亦是如此。陈叶青等[19]通过数据挖掘的方法整理相关文献进行分析,结果显示未行手术放化疗的CRC 患者多见脾虚,瘀毒内阻证、气血亏虚证。刘尚义认为CRC为虚实夹杂之证,临床辨治要分清本虚标实的轻重地位,肝肾脾虚是为其中关键,临床治疗中常使用软坚散结、滋阴清热和破血化瘀消癥、清热解毒、行气止痛、健脾燥湿消肿等为治疗原则[20]。尤松鑫认为CRC 的发病关键在于脾胃虚损,加之外感邪气,故蕴积成癌,临床上提倡分期辨治,初期肝脾不调,常用柴胡疏肝散联合痛泻要方治疗;中期热毒瘀结,常用方为润肠丸、槐角丸等;末期若为脾肾阳虚,常用参苓白术散加减[21]。
综上,CRC 临床中以本虚标实为主,其病因由内外因素相互作用,相互影响而导致;临床治疗注重灵活辨治、审明病情、扶正祛邪应贯彻CRC治疗的始终。
2 蟾蜍在CRC治疗中的研究进展
在中医应用方面,蟾蜍的药用价值早已被发掘。蟾蜍药用首载于《神农本草经》,历代本草古籍记载蟾蜍可入药部位达11 种之多,如《本草纲目拾遗》载“《纲目》蟾蜍条主治,皆全用,无单用其皮者”。在现代临床运用中,也将蟾蜕入药[22],说明蟾蜍药用价值前景可观,有较大的应用潜力,也进一步反映了蟾蜍全身皆可用药的特点[23]。
目前,国内蟾蜍主要有中华大蟾蜍、黑眶蟾蜍两种品种。蟾蜍药用本品为蟾蜍科动物中华大蟾蜍或黑眶蟾蜍的全体,其中含有多种抗肿瘤活性成分,如蟾毒灵、华蟾酥毒基、沙蟾毒精、蟾毒它灵、华蟾毒精、华蟾毒它灵和树脂蟾毒配基[24-26]。蟾蜍具有解毒散结、消积利水、杀虫消疳的功效,主要用于疔疮、水肿、癥瘕、慢性咳喘等病症。现代临床应用证明,蟾蜍类药物具有抗肿瘤血管生成、抑制肿瘤细胞侵袭与转移、逆转肿瘤多药耐药、抗炎、抗菌、强心等作用,常用于胃癌、结直肠癌、肝癌、慢性乙型肝炎等疾病的治疗[26-27]。对于CRC,中药常以蟾酥、蟾皮入药,而蟾酥、蟾皮的相关研究也较完善,故对蟾蜍药用部位治疗CRC 的作用机制及临床应用展开阐述。
2.1 抑制CRC细胞增殖
过度增殖是肿瘤细胞重要的行为特征[28],也是CRC 发生发展的主要途径。CRC 细胞在增殖过程中亦遵循细胞周期的规律,进而有序完成细胞增殖活动。阻滞CRC 细胞周期可通过调控细胞周期相关蛋白,破坏细胞增殖活动,达到限制肿瘤生长的目的。酯蟾毒配基可引起结肠癌细胞HT-29在G0/G1期阻滞,通过下调细胞周期蛋白cyclin D1和cyclin E,降低RB 蛋白磷酸化来实现[29]。Zhang等[30]研究表明,蟾毒灵可以抑制LoVo 和SW620 细胞的增殖和迁移活动,诱导细胞凋亡,能使细胞阻滞在G2/M期。
2.2 诱导CRC细胞凋亡
细胞凋亡作为一种程序性细胞死亡形式,其机制较为复杂和精密,凋亡途径多样,主要有外在或死亡受体和内在或线粒体两种凋亡途径[31]。研究提示,诱导细胞凋亡是抗肿瘤治疗中较有前景的治疗方案,作用形式是抗癌药物干预调控相关凋亡因子,诱导肿瘤细胞凋亡[32]。远华蟾蜍精(telocinobufagin,TBG)是从蟾酥中提取纯化的活性成分之一,梁顺添等[33]研究发现,TBG能显著抑制CRC 细胞HCT116、SW480 的细胞活力,并呈现一定的量效关系,TBG能够诱导HCT116细胞形态改变,表现为染色质凝集,发生核固缩,形成典型凋亡小体。蟾毒灵通过激活包括PTEN、AKT、Bad/Bax 和Caspase-3 在内的内在凋亡途径基因诱导HCT116 细胞凋亡,且对抑制HCT116 细胞增殖及原位异种移植动物模型肿瘤生长具有显著作用,蟾毒灵组肿瘤组织中Bax 和Caspase-3 的表达增加,小鼠生存时间显著延长[34]。沙蟾毒精(Arenobufagin)是从蟾酥中提取的蟾毒内酯类化合物,可通过Bax-PGAM5L-Drp1复合物介导内源性凋亡,进而影响结肠直癌的生长和转移[35]。
2.3 逆转CRC细胞多药耐药性
多药耐药性的产生是由于细胞解除药物活性分子发生变异或过度表达。导致肿瘤细胞产生多药耐药性与多种机制相关,涉及遗传、生长因子、药物流出、外源物质代谢、DNA 修复能力等方面[36]。多药耐药是肿瘤化疗失败的主要原因,故使用药物逆转肿瘤细胞多药耐药是治疗肿瘤的主要途径。Chen 等[37]发现,蟾毒灵可以通过在体外和体内调节化学抗性细胞来减少M2 巨噬细胞极化,其作用机制是靶向SRC-3 蛋白以减少巨噬细胞迁移因子(macrophage migration factor,MIF)在化学抗性细胞中释放以调节M2巨噬细胞的极化。研究提示,肿瘤干细胞作为肿瘤化疗耐药重要原因,成为逆转肿瘤细胞多药耐药的研究突破口[38]。蟾毒灵可以通过抑制CRC 的干性并降低干性标志物 CD133、CD44、OCT4、SOX2 和 NANOG 以及耐药蛋白ABCG2 的表达,在体外和体内逆转获得性顺铂耐药[39]。P-gp 是研究最多的ABC 转运蛋白,可以从癌细胞中排出多种抗癌药物,导致耐药。华蟾素(cinobufagin,CBF)通过非竞争性抑制P-gp ATP 酶活性来影响P-gp 的外排功能,从而逆转P-gp 介导的多药耐药,并使用裸鼠异种移植模型证明了CBF和阿霉素(doxorubicin,DOX)的联合应用抑制肿瘤生长作用显著,抑制率为40.9%,且各组织病理学未显示异常变化,说明CBF 联合DOX在体内的有效性和相对安全性[40]。
2.4 抑制CRC血管生成
血管生成是由多种血管生长因子调控的复杂过程,肿瘤新生血管生成通常从毛细血管开始,在肿瘤生长、维持和转移中有着至关重要的作用[41]。血管生成在CRC 生长进展中起关键作用,随着对血管生成机制、潜在治疗靶点及肿瘤耐药认识的不断拓展,抗肿瘤血管生成药物研发对于治疗CRC 具有重要意义[42]。活性氧(reactive oxygen species,ROS)在细胞信号传导和体内平衡中发挥作用,内源或外源性ROS 可通过刺激生长因子、细胞因子和转录因子传导促进肿瘤迁移和增殖[43]。Li等[44]研究发现,华蟾素通过破坏内皮细胞mTOR/HIF-1α 通路,触发ROS 介导的血管内皮细胞凋亡,从而抑制CRC 新生血管生成。CRC 血管生成是肿瘤微环境(tumor microenvironment,TME)所有细胞相互作用的结果,对TME 进行干预是治疗CRC的有效途径[45]。Fang等[46]通过体内体外实验结果表明,TME 通过激活血管内皮细胞中的STAT3促进肿瘤血管生成,而蟾毒灵通过减少血管数量和血管内皮细胞中STAT3 磷酸化来抑制CRC 的生长和转移,证明蟾毒灵可以通过靶向激活肿瘤血管中的STAT3 信号通路精确抑制TME 介导的CRC血管生成,从而抑制CRC 细胞异种移植模型中的肿瘤生长,并阻滞CRC肝转移的进程。
2.5 抑制CRC细胞迁移
细胞迁移是通过胞体形变进行的定向移动,在肿瘤上皮-间质转化(epithelial-mesenchymal transition,EMT)、侵袭和转移活动中有着不可忽视的作用。细胞迁移作为EMT 的基本特征,是抑制mCRC的治疗靶点。研究提示,蟾酥提取物华蟾素在体外体内均能抑制CRC 的侵袭和转移,实验结果表明CRC 转移和上皮间质转化相关基因MMP9、MMP2、N-cadherin 和 Snail 明显下调,而E-cadherin 表达上调,说明该机制与抑制Wnt/βcatenin 信号通路进而抑制 CRC 的 EMT 有关[47]。韩钦芮通过体内实验研究证明酯蟾毒配基(resibufogenin)通过RIP3介导的细胞坏死抑制CRC的生长和转移,结果表明resibufogenin 诱导SW480裸鼠异位肿瘤模型肿瘤组织坏死,其作用机制与RIP3、GLUD1、GLU、PYG1 蛋白表达水平上调有关;体外实验结果表明,resibufogenin通过上调E-cadherin 和 ZO-1 蛋白表达,下调 fibronectin,vimentin 和Snail 蛋白的表达抑制HCT116 细胞的迁移,免疫组化结果提示,resibufogenin 干预后E-cadherin 表 达 上 调 ,KI-67 明显 下降[48]。 Wnt/β-catenin 信号通路的异常激活是CRC 生长侵袭活动中的关键驱动因素,β-catenin 作为Wnt 信号传导的关键介质,参与了转录调控和染色质相互作用[49-50]。陈丹等[51]研究发现,华蟾毒精能够抑制CRC 细胞SW480 细胞活性及迁移能力,其作用机制是华蟾毒精结合β-catenin 第332 位苏氨酸,促进β-catenin的磷酸化,抑制了β-catenin进入细胞核的量,降低了Wnt/β-catenin 信号通路下游的关键 基 MYC、 COX2、 WISP1、 BIRC5、 CCND1、AXIN2、EPCAM的转录。
2.6 联合其他抗肿瘤药物
2.6.1 增效
随着中医药在辅助化疗药物减毒增效方面研究不断深入,使用中医药联合化疗药物治疗CRC在临床治疗中普遍应用,中西医结合治疗的优势愈加明显[52]。Dai 等[53]研究表明,5-FU 联合蟾毒灵组与单药组相比,联合组抑制HCT116细胞效果更佳,结果显示Mcl-1、XIAP和Bcl-2等抗凋亡蛋白的表达水平下调,促凋亡蛋白Bax和Bad的水平上调,蟾毒灵通过诱导线粒体凋亡的途径增强了HCT116 对 5-FU 的细胞毒性。Sun 等[39]在研究中发现,蟾毒灵联合顺铂抑制HCT116荷瘤小鼠疗效优于蟾毒灵和顺铂单药组,并降低了干性标记物蛋白表达。
2.6.2 增敏
临床上,放疗作为肿瘤疾病重要的治疗手段在mCRC 中广泛运用,但由于CRC 细胞对放疗敏感性降低,导致放疗疗效并不理想,增强CRC 细胞的放疗敏感性已成为亟待探索解决的问题[54]。研究报道,华蟾毒精联合X 射线应用对SW-480、HT-29、HCT-116细胞有明显抑制作用,能够诱导和促进人CRC细胞的凋亡发生,与单独放疗相比,联合应用可以增强SW-480、HT-29、HCT-116 细胞的放疗敏感性[55]。蟾蜍有效成分抗CRC 作用机制及蟾蜍有效成分联合放化疗抗CRC 作用总结见表1及表2。
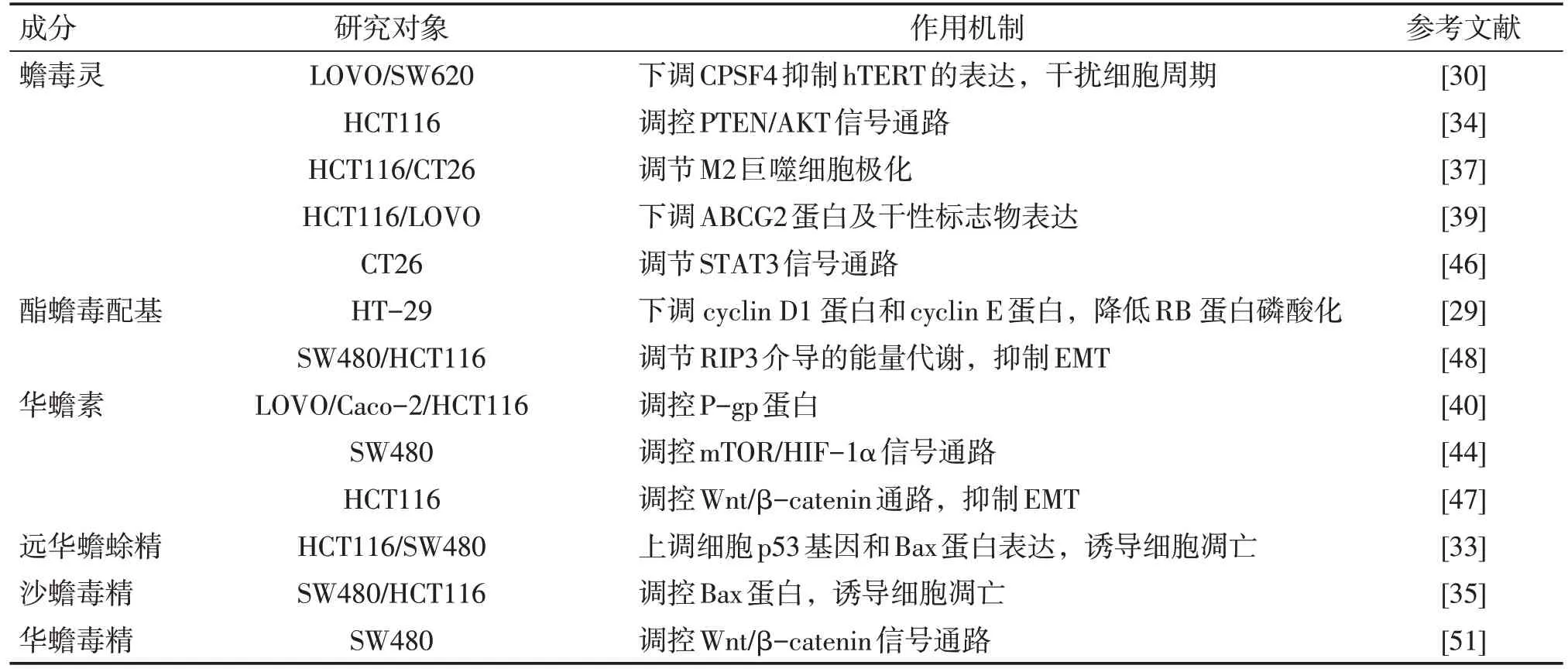
表1 蟾蜍有效成分抗CRC作用机制Table 1 Anti-CRC Mechanism of Toad Effective Components

表2 蟾蜍有效成分联合放化疗抗CRC作用Table 2 Anti-CRC effect of active ingredients of toad combined with radiotherapy and chemotherapy
2.7 蟾蜍类药用相关复方
蟾蜍作为传统中药材,其制剂形式膏、丸、散剂都有涉及。在中医领域应用经验丰富,特别在肿瘤防治方面应用广泛[56-57]。蟾灵膏为国医大师刘尚义教授拟定的抗肿瘤膏方,研究发现,蟾灵膏(主药为干蟾皮)具有抑制原位结直肠癌肝转移模型鼠腹腔移植瘤与肝脏转移瘤的生长,其作用机制可能是通过影响HIF-1α/SDF-1α 轴的信号传导调控Warburg 效应而实现的[58]。邱艳艳等[59]研究结果表明六神丸(组成为制蟾酥、牛黄、冰片、珍珠、麝香、明雄黄)抑制结肠癌炎症相关增殖和转移且下调SRC-3 表达,六神丸抑制SRC-3 高表达结肠癌肿瘤增长和肝转移,其机制可能与SRC-3途径介导的EMT 有关。芪蟾口服结肠靶向片(黄芪、干蟾皮、地黄、苦参)在临床主要用于脾虚湿热型结肠癌的治疗及术后综合征的防治,有研究报道,芪蟾口服结肠靶向片有效组分联合5-FU抑瘤作用优于单药组,可能是通过免疫功能调节及上调Bax蛋白,下调Bcl-2蛋白表达实现[60]。
3 临床研究
临床上,化疗是治疗结直肠癌的常用手段之一,但会引起恶心、呕吐、食欲不振或便秘等不良反应,影响患者生活质量,严重者导致中断治疗。中医药的介入可降低化疗的毒副作用,联合化疗还可增强疗效,减少不良反应发生率,提高患者生活质量。临床研究发现,蟾酥注射液保留灌肠的治疗方法可使药物直接作用于病灶,纳入研究患者肿瘤标志物CEA、CA199 检测结果提示,实验组直肠癌术后复发的肿瘤标志物指标较对照组有所改善,说明蟾酥注射液可以在局部杀伤肿瘤细胞,能够促进局部炎症的消散吸收[61]。潘静等[62]通过华蟾素注射液联合化疗方案治疗晚期结直肠癌患者,结果提示华蟾素注射液联合化疗能够提高临床治疗效果,降低不良反应发生率。据报道,华蟾素片联合XELOX 方案治疗结直肠腺癌可取得明显疗效,联合用药组生活质量优于单纯化疗组,且联合组CEA 值下降较对照组下降更为显著[63]。方国娅等[64]临床研究结果表明,华蟾素胶囊联合化疗组肿瘤标志物CEA、CA724、CA199水平低于对照组,且疾病控制率明显高于对照组,说明华蟾素胶囊联合化疗可改善患者的生存质量,并对化疗引起的毒副作用有所缓解。蟾蜍提取物制剂抗结直肠癌的临床疗效总结见表3。
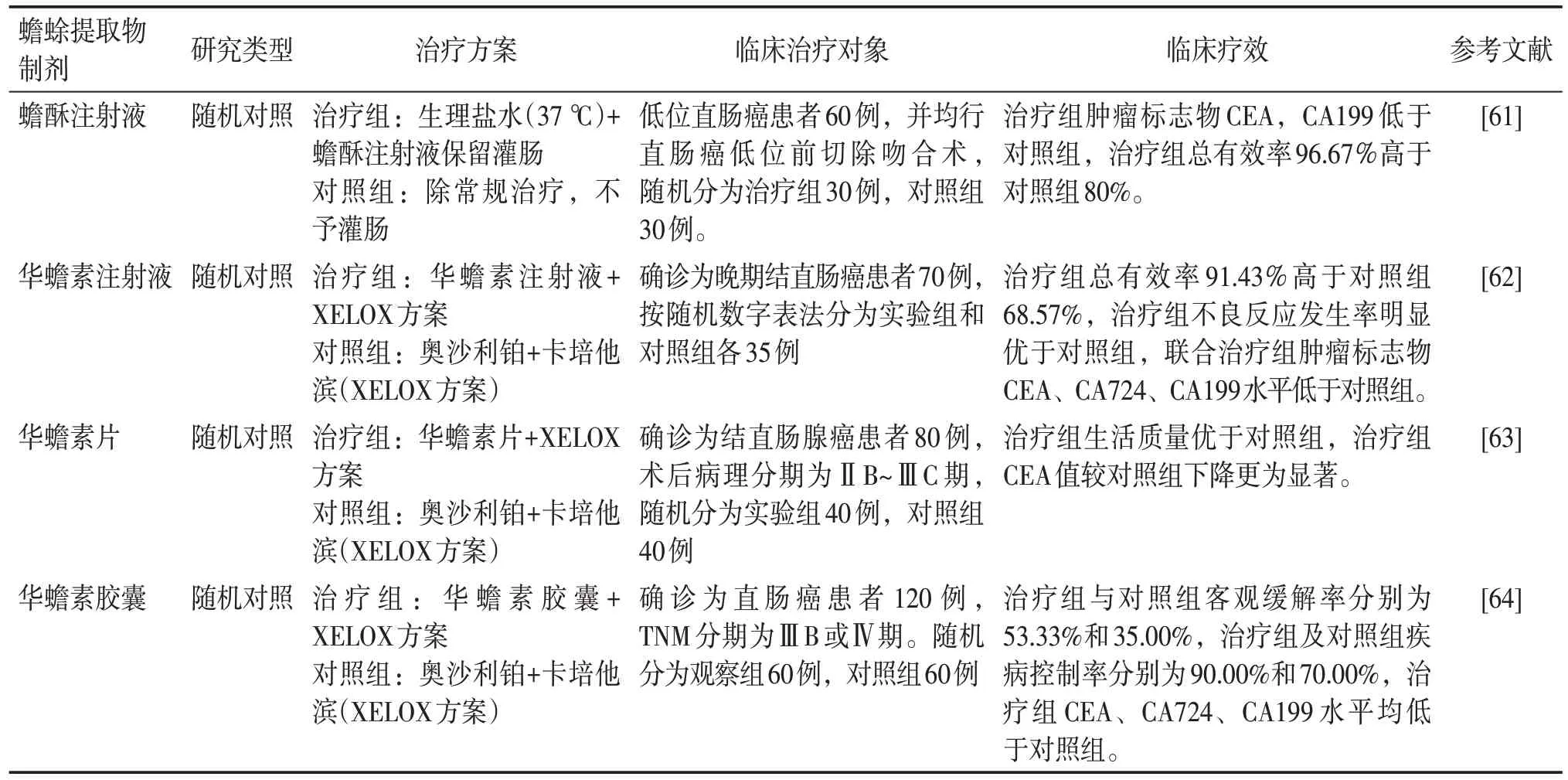
表3 蟾蜍提取物制剂抗结直肠癌的临床疗效Table 3 Clinical efficacy of toad extract against colorectal cancer
4 小结与展望
中医认为CRC 因正气不足,体内酿生病邪,加之外邪侵犯机体,内外合邪,共发为CRC,治疗上以扶正祛邪为主。蟾蜍作为解毒消肿的常用药,能够通过多种途径影响CRC 发生发展,其中含有的蟾毒灵、酯蟾毒配基、华蟾毒精、远华蟾蜍精、华蟾素、沙蟾毒精等活性成分具有抑制CRC 细胞增殖、诱导细胞凋亡、抑制新生血管生成、逆转多药耐药及细胞迁移的作用,其作用机制可能与抑制CRC 增殖、新生血管生长、逆转肿瘤多药耐药、调控肿瘤细胞转移及凋亡相关基因靶点以及增强CRC 放射治疗效果、辅助提高化疗药效有关。总的来说,蟾蜍对CRC 的影响是多靶点作用,多个不同机制参与,多效应途径的综合,说明蟾蜍对于治疗CRC具有较大的潜在价值。
蟾蜍提取物中含有多种抗肿瘤活性成分,抗CRC 作用显著,但当前蟾蜍抗结直肠癌药理研究仍存在以下不足之处:①蟾蜍具有“毒性”,使用不当容易产生毒副作用,其毒理作用机制有待证明。故在临床及科研中,应兼顾考虑其化学提取物的毒理性质,今后可通过体内体外实验明确其不良反应及产生机制或探索创新蟾蜍提取物药物载体形式,药物剂型的转变利于促进药物有效成分的代谢吸收、提高药物疗效、增强药物安全性。在科研研究中,可参考以往实验数据明确其合理用量,或设置长短期毒理实验进行观察取样,做全方面的病理检测获取参考数据。在临床使用中,应严格遵守炮制加工、配伍、制剂等各项运用规则,减少其产生的毒副反应。②蟾蜍治疗CRC 的分子机制尚不完全明确,目前研究对象仅局限于其中的几个主要成分,仍有许多蟾蜍成分抗CRC 作用及机制有待深入研究发现。将来可使用现代生物信息学相关技术扩大蟾蜍对CRC 基因靶点的机制研究,并进一步通过实验进行验证。③蟾蜍及其有效成分可通过多效应途径抗结直肠癌,但多数机制研究不够深入且缺乏系统性阐述,导致药物研发临床转化率较低。可结合现代研究方法如多组学技术、网络药理学和单细胞测序等,为开发蟾蜍抗CRC 制剂打下良好基础,为多靶点高精准多途径治疗CRC 和提高患者生存质量、延长患者生存时间发挥作用提供可行条件。综上所述,蟾蜍治疗CRC 有着独特优势,其前景广阔,值得深入研究探讨。
