威灵仙治疗癌性疼痛“成分-靶点”网络机制探索
2022-12-14郝腾腾袁菊花吴煜王静徐晓华安佰平
郝腾腾, 袁菊花, 吴煜, 王静, 徐晓华, 安佰平
1.中国中医科学院西苑医院,北京 100091;2.北京中西医结合医院,北京 100039;3.北京市丰台妇幼保健院,北京 100069;4.成都中医药大学附属医院,四川 成都 610072
70%以上的癌症患者会出现不同程度的疼痛,是最常见和难以忍受的症状之一,但近50%的癌性疼痛即使应用阿片类药物也没有得到充分的控制[1-2]。虽然世界卫生组织的阶梯止痛治疗提供了缓解癌症疼痛的有效方法,但同时对止痛药的成瘾性和药物干预的不良反应给疼痛的临床管理带来了严峻的挑战[3]。由于癌痛发生机制复杂,病因涉及原发肿瘤、治疗以及社会心理等多维度,所以需要多学科的综合方法来控制疼痛[4]。中药可行气活血、化瘀通络、补虚止痛,内服或外用具有明显镇痛效果,可以提高疼痛缓解率,且不良反应少,无成瘾性[5-7]。
《本草新编》载:“威灵仙,味苦,气温,可升可降,阴中阳也,无毒……散爪甲皮肤风中痒痛,利腰膝胫踝湿渗冷疼,尤疗折伤,治风湿各病,皆宜用之,以其十二经络无处不到也……用之于补气补血之中,自得祛痛祛寒之效。”威灵仙为毛茛科植物威灵仙的干燥根及根茎,为祛风湿药,主要功效为“祛风、通经络、止痛”,多用于“腰脚诸痛、手足麻痹”等[8]。威灵仙被明代医家王肯堂称为“止痛之要药”,是传统的一味镇痛良药,在痛症中应用广泛,如风湿痹痛、骨性痛、肌肉痛、关节痛和内脏痛等病证[9-11]。
临床诊疗过程中运用威灵仙治疗癌性疼痛,具有一定的疗效。亦有学者先后报道了运用威灵仙复方治疗癌性躯体痛及骨癌痛[12-13]。现代药理学研究发现威灵仙可以消炎镇痛并具有抗肿瘤作用[11,14]。但是,威灵仙治疗癌性疼痛的研究报道较少,具体机制尚未清楚。本研究采用网络药理学研究方法,筛选出威灵仙治疗癌性疼痛的关键作用靶点,并通过生物信息学分析,构建“药物成分-作用靶点-信号通路”网络。为系统阐释威灵仙治疗癌性疼痛的作用机理及物质成分基础提供进一步的认识,并为后续药物的基础研究指明方向。
1 资料与方法
1.1 威灵仙化学成分及作用靶点
采用中药系统药理学数据库网络平台(TCMSP)检索威灵仙药物的活性成分及作用靶点[15]。根据成分的药物动力学参数进行筛选,其中筛选条件设定为药物口服生物利用度( oral bioavailability,OB)≥30%,以及类药性( drug likeness,DL)≥0. 18,获得威灵仙的有效成分(ingredients)[16]。并通过该数据库并获得相应有效成分的作用靶点(related targets)。利用平台Uniprot将基因ID 与基因Symbol 进行转换,以实现对有效成分所对应的基因名称进行标准化的目的。
1.2 癌性疼痛靶点
本研究中癌性疼痛靶点的获取来源于Genecards 信息平台[17]和OMIM 网络数据库。OMIM源于生物医学文献,由NCBI 支持,是一个具有全面性、权威性和及时性的关于人类基因和遗传疾病的知识库,库中记录所有已知疾病的遗传成分,并可链接至其他遗传数据库[18]。通过输入关键词“cancer pain”获取与癌性疼痛相关靶基因,合并两个数据库检索结果。运用R 语言将威灵仙的活性成分相关的靶点和癌性疼痛的靶点匹配,并通过韦恩图(venn diagram)得到威灵仙有效成分的潜在作用靶点。
1.3 药物-成分-靶点网络的构建
将威灵仙活性成分所对应的靶点基因和癌性疼痛相关的靶点基因进行匹配,获得交集基因即为威灵仙治疗癌性疼痛的关键靶点。借助Cytoscape 软件(Version3.7.2)构建“药物-成分-靶点”关系网络。通过此网络的构建,实现对威灵仙治疗癌性疼痛作用机制的可视化,初步展现药物-成分-疾病靶点之间的相互关系。
1.4 关键靶蛋白相互作用网络的构建
运用STRING 信息平台预测蛋白-蛋白之间的相互作用关系。将威灵仙关键靶点导入String 信息库,获得蛋白互作关系。将所得数据导入Cytoscape 软件进行可视化分析,绘制蛋白互作网络图。网络中节点大小和颜色深浅被设置为反映Degree 值的大小,边的粗细被设置为反映Combine score 大小。
1.5 关键靶点基因本体(gene ontology,GO)
分析和KEGG 通路分析借助Bioconductor 平台(http://bioconductor.org/biocLite.R)和R 软件对获得的基因进行GO 富集分析和KEGG 通路分析[19]。首先在R 软件中进行安装包的安装,并执行相关安装包语言,通过R软件运行命令,导出GO富集分析表格,并绘制柱状图和气泡图。R软件运行命令后可导出KEGG 富集分析表格以及KEGG 通路图,并绘制柱状图和气泡图。
2 结果
2.1 威灵仙有效成分
通过TCMSP 数据库检索的威灵仙化学成分57个,通过OB ≥30%,DL ≥0.18进一步筛选,结合文献报道及中药特性[11,20-21],共得到潜在活性成分28个,见表1。
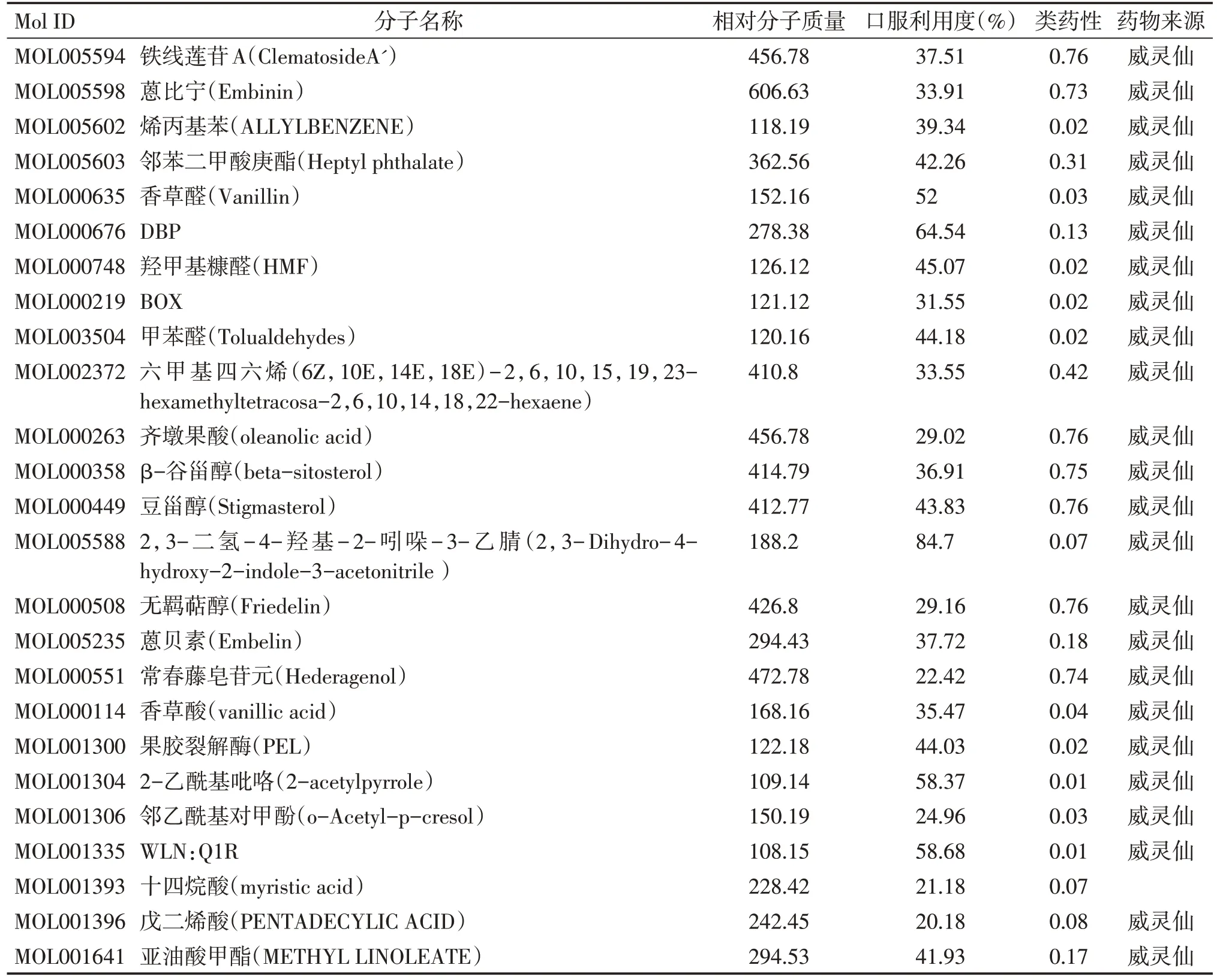
表1 威灵仙中潜在活性成分Table 1 Potential active components of Radix Clematidis

(续表1)
2.2 威灵仙有效成分治疗癌痛的潜在作用靶点预测
通过GeneCards 数据库与OMIM 数据库,检索“cancer pain”,合并去重后得到与癌性疼痛相关靶点基因共8886个。通过TCMSP 数据库筛选威灵仙的有效成分对应的作用靶点,去除重复以及无效的作用靶点后,得到威灵仙的有效成分作用靶点88 个。利用R 软件将药物有效成分靶点和疾病靶点进行映射匹配,绘制韦恩图(图1)。共获得交集靶点基因33 个,分别为PTGS1、NOS3、TYRP1、ADH1B、 PGR、 NR3C1、 NCOA2、 NCOA1、LCAT、 RHO、 CHRM1、 ADRA2C、 CHRM2、ADRA1A、 DAO、 CHRM3、 GABRA1、 CASP9、CASP3、 ICAM1、 NQO1、 CHRNA2、 BCL2、CASP8、 PRKCA、 PON1、 NR3C2、 AKR1B1、PLAU、ACHE、PPARG、GSK3B、GRIA2。
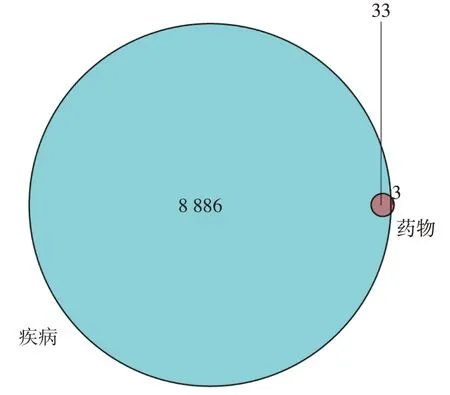
图1 疾病靶点基因与药物作用靶点基因的匹配Figure 1 Cancer pain target genes and Radix Clematidis target genes
2.3 药物-潜在活性成分-关键作用靶点网络构建分析
威灵仙与癌性疼痛相关的潜在有效成分21个,分别为有香草酸、碱性果胶酶、2-乙酰基吡咯、邻乙酰基对甲酚、WLN:Q1R、十四烷酸、戊二烯酸、亚油酸甲酯、丁香酚、异香草酸、BOX、齐墩果酸、甲苯醛、β-谷甾醇、豆甾醇、蒽贝素、2,3-二氢-4-羟基-2-吲哚-3-乙腈、烯丙基苯、香草醛、DBP、羟甲基糠醛。将威灵仙潜在活性成分及33 个关键靶基因导入Cytoscape,构建药物-潜在活性成分-关键作用靶点网络图(图2)。结果显示,连接度前5 的关键靶点基因为PTGS1、ADH1B、NCOA2、GABRA1、CHRM2。连接度前5的药物有效成分为beta-sitosterol、Stigmasterol、HMF、DBP、BOX。
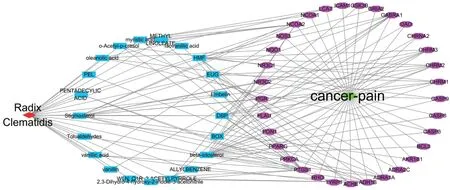
图2 威灵仙有效成分与癌性疼痛的关键作用靶点网络Figure 2 Target network for active ingredients of Radix Clematidis in cancer pain
2.4 关键靶点基因蛋白质相互作用网络分析
运用String信息平台将威灵仙治疗癌性疼痛可能的33 个潜在作用靶点基因导入,获得所表达蛋白之间相互作用的关系网络(图3)。结果显示,蛋白质间网络图包括33 个节点,预期86 条边,实际257 条边,这种富集结果表明作为一个基团,这些蛋白质至少在生物上是部分相连的。基于此结果进一步运用R 软件绘制前30 位核心基因的可视化柱状图(图4),得出CASP3 的邻接节点为13 个靶蛋白基因,NOS3的邻接节点为12个靶蛋白基因,PPARG 的邻接节点为10 个靶蛋白基因,NR3C1 的邻接节点为8 个靶蛋白基因,CHRM1 与PRKCA 的邻接节点均为7 个。证明以上六个基因在整个蛋白质网络中位于调控网络的核心,可能在威灵仙的活性成分参与治疗癌性疼痛过程中发挥关键作用。
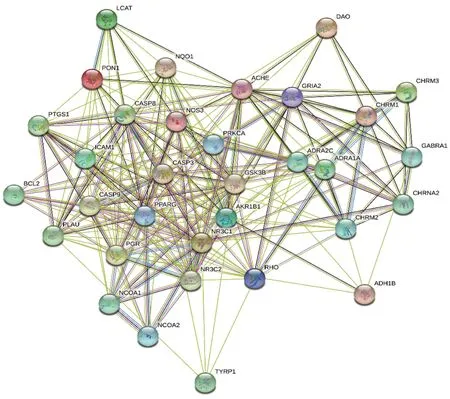
图3 威灵仙治疗癌性疼痛关键基因的蛋白互作网络Figure 3 Protein interaction networks of Radix Clematidis in cancer pain

图4 威灵仙治疗癌性疼痛核心基因Figure 4 Core gene of Radix Clematidis in cancer pain
2.5 威灵仙中关键靶点基因生物功能分析
GO 注释结果显示,富集后排名靠前的生物学功能主要为神经递质受体活性、G蛋白偶联胺受体活性及乙酰胆碱受体活性。其余依次为半胱氨酸型内肽酶活性参与细胞凋亡过程、类固醇激素受体活性、乙酰胆碱结合、G 蛋白偶联的5-羟色胺受体活性、荷尔蒙结合等(图5)。气泡图同理,圆点越大,富集越多,P值越小,表明该生物功能的富集显著性越可靠,颜色越红(图5)。表明威灵仙可能通过调控多种生物学过程发挥治疗癌性疼痛的作用。

图5 威灵仙活性成分治疗癌性疼痛关键靶点的GO 富集分析Figure 5 Enrichment analysis on GO biological processes of key targets from active compounds of Radix Clematidis
2.6 威灵仙关键靶点基因富集通路分析
通过注解及分析共得到44 条作用通路,结合P值分析,其中与癌性疼痛相关的有20 条。主要富集通路为神经活性配体-受体相互作用、PI3KAkt信号通路、胆碱能突触、钙信号通路、糖尿病并发症的AGE-RAGE 信号通路、甲状腺激素信号通路、雌激素信号通路等。同时还涉及麻疹、乙肝、甲型流感、卡波西肉瘤相关疱疹病毒感染、爱泼斯坦-巴尔病毒感染、弓形虫病、p53 信号通路、铂类耐药、结直肠癌、前列腺癌等通路,表明威灵仙潜在活性成分靶点基因可以作用于不同的通路和癌种。P值与该差异表达基因在此条通路中富集的显著性相关,P值越小越可靠,颜色越红(图6)。此处参照P值列出了与癌性疼痛相关度较可靠的3条关键通路,见表2。
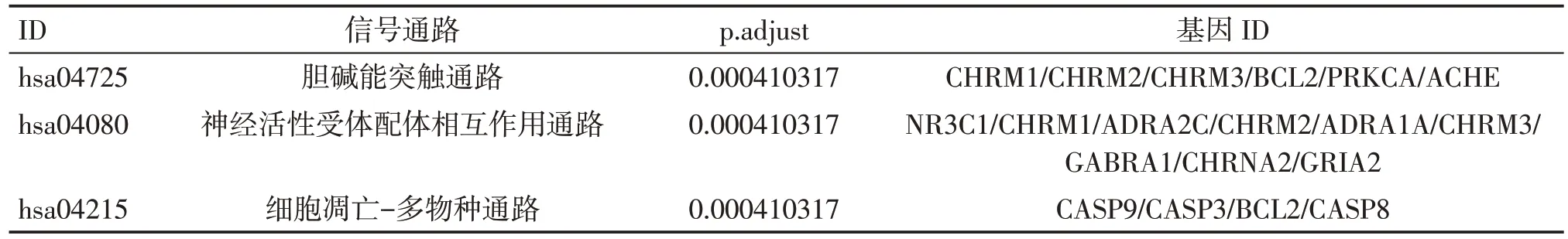
表2 威灵仙治疗癌性疼痛的关键通路Table 2Figure Key pathway of Radix Clematidis in cancer pain
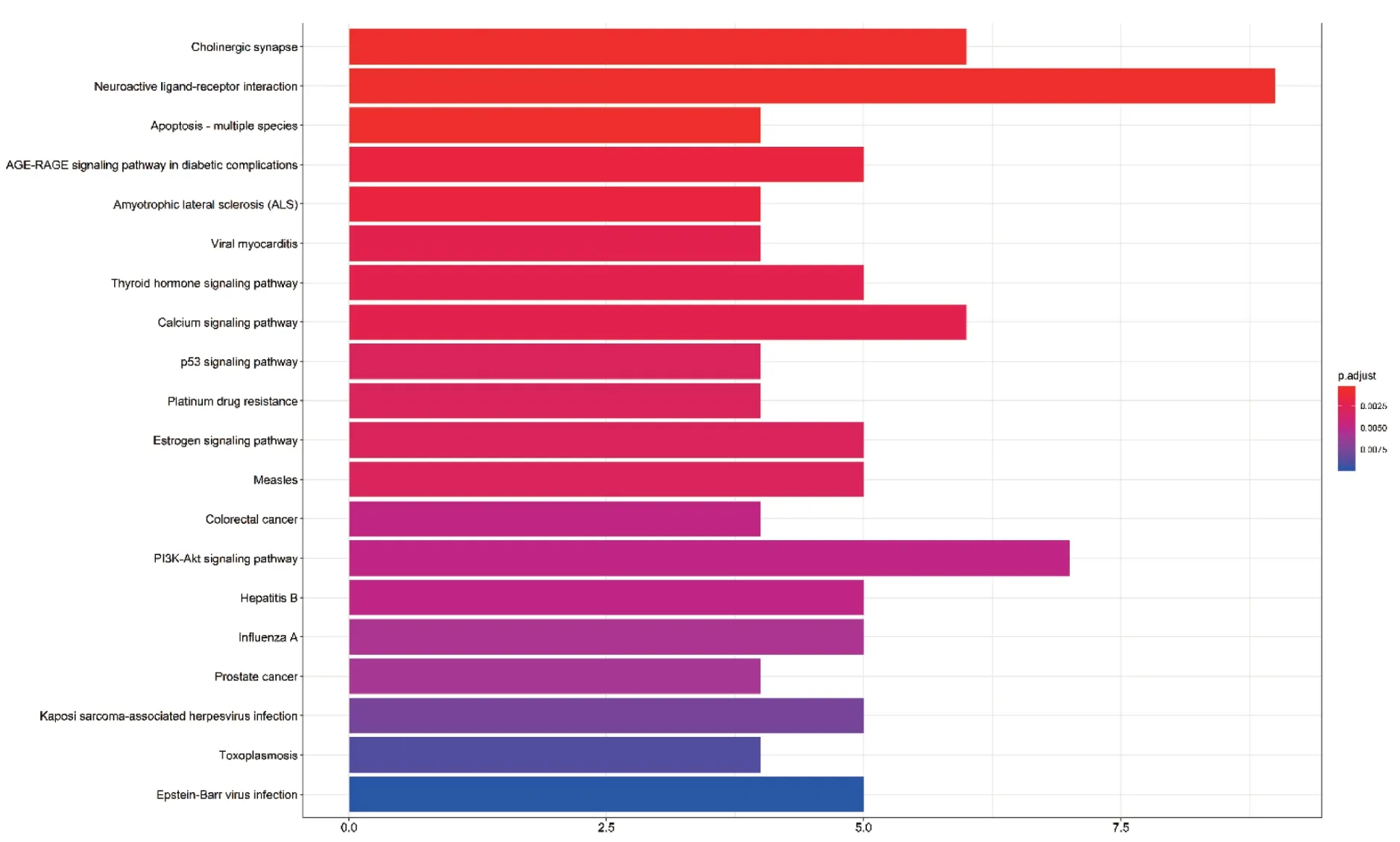
图6 威灵仙活性成分治疗癌性疼痛关键靶点的KEGG 代谢通路富集分析Figure 6 Enrichment analysis on KEGG pathways of key targets from active compounds of Radix Clematidis
3 讨论
中药复方及单体是现代中医治疗疾病的主要方法,通过潜在的多成分、多靶点相互作用起到治疗效果,在复杂疾病的治疗中发挥了重要作用。但中药成分复杂,采用传统研究方法分离活性成分然后进行实验研究验证其作用靶点,工作量大,经济成本及人力物力投入较高,且目的不够精准。当今网络药理学结合了生物信息学知识,强调用网络来呈现“药物-靶点-疾病”之间的复杂关系[22]。网络药理及生物信息学的结合能够系统、综合分析中药“多成分”的作用位点,展示疾病相关的靶标和通路,通过网络映射,揭示中药的药效物质基础及分子水平的作用机制,体现出中药多成分、多靶点干预的特点,有效推动了中药复方及单体的研究。本研究运用生物网络信息分析,探索了威灵仙治疗癌性疼痛的核心机理。
本研究直观地呈现了21 个化合物成分、33 个靶蛋白、20 条作用通路和癌性疼痛疾病间的关联。威灵仙作用于癌性疼痛靶基因的主要活性成分为β-谷甾醇(beta-sitosterol)、豆甾醇(Stigmasterol)、齐墩果酸(oleanolic acid)、HMF、DBP、BOX、EUG、邻乙酰基对甲酚(o-Acetyl-p-cresol)、肉豆蔻酸(myristic acid)等。β-谷甾醇属于植物甾醇中重要组成,可以直接镇痛,抗炎作用类似激素样,但无激素类药物副作用[23],且对乳腺癌、肝癌、结肠癌等具有抑制肿瘤细胞生长增殖以及诱导凋亡的作用[24-25],而肿瘤可以通过侵犯神经、血管、骨骼及软组织、释放促炎症和促痛觉过敏介质等引起疼痛[26]。豆甾醇对急慢性疼痛均具有镇痛作用[27],可抑制肿瘤细胞增殖、迁移并促进凋亡[28-29],且可以抗炎[30],从而间接发挥镇痛作用。威灵仙三萜皂苷主要由齐墩果酸衍生而来,根据所结合糖的数目及种类而异。齐墩果酸可以诱导caspase 活化,增加凋亡蛋白CASP3 的表达,从而诱导肿瘤细胞凋亡[31],体外实验发现可以抑制肺癌、肝癌及结直肠癌等细胞株生长[32-34]。结合上述研究结果,说明本研究中筛选出的活性成分具有直接镇痛及通过抑制肿瘤,促进肿瘤细胞凋亡达到间接镇痛的作用。提示我们在后续中药现代化制剂研发中,应保证有效活性成分的最大程度保留。
威灵仙药物活性成分作用靶点与33 个主要蛋白有很强的相互作用,其中CASP3,NOS3,PPARG,NR3C1,CHRM1 与 PRKCA 为关键靶蛋白,且与其他多个蛋白发生相互作用。其中半胱天冬酶原3(CASP3)主要参与细胞的凋亡程序,无论外源性信号途径和内源性信号途径,最终都必须激活CASP3 转化为活化形式的半胱天冬酶3(CCASP3)才能执行细胞最终凋亡程序,诱导凋亡是多种化疗药和靶向治疗药的共同通路[35-36]。NOS3为结构型一氧化氮合酶(constitutive nitric oxide synthase,cNOS),在生理状态下产生低浓度和中等浓度水平的NO,而NO 可以通过使p53 基因失活、促进肿瘤血管生成、影响肿瘤细胞代谢等多重机制促进肿瘤形成及发展[37-38]。PPARG基因是过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARy)的编码基因,其在多种肿瘤组织中呈低表达,PPARy 被配体激活后可抑制肿瘤细胞增殖、抑制肿瘤血管形成、促进细胞凋亡,故PPARG 可能是抑癌基因[39]。NR3C1 通过激活 PI3K/AKT/GSK3β 信号通路、促进BCL-2 促凋亡蛋白表达[40]。蛋白激酶Cα(protein kinaseC-alpha,PRKCA)可诱导细胞癌变,促进肿瘤细胞的增殖、侵袭等,在肿瘤的发生发展中起到了重要作用[41]。CHRM1 属于毒蕈碱型胆碱能受体中5个亚型之一,主要激活磷脂酶C(phospholipase C),通过ERK通路促进肿瘤细胞的增殖,从而在多种肿瘤中发挥促进肿瘤的作用,药物抑制或敲除M1 受体可明显减少肿瘤细胞的转移[42-43]。可以看出威灵仙潜在活性成分治疗癌性疼痛的关键作用包括上调CASP3、NR3C1 凋亡蛋白的表达促进肿瘤细胞凋亡,上调PPARG 的表达并下调PRKCA、NOS3、CHRM1 的表达,从而抑制肿瘤细胞增殖侵袭。
通过对威灵仙治疗癌性疼痛的33 个疾病靶点进行GO生物进程富集,显示威灵仙可以通过中枢镇痛相关通路如神经活性配体-受体相互作用、胆碱能突触、钙信号通路,及炎症相关通路如PI3KAkt 信号通路、糖尿病并发症的AGE-RAGE 信号通路、p53信号通路,激素调节相关通路如甲状腺激素信号通路、雌激素信号通路等发挥镇痛作用。KEGG分析提示,影响上述生物进程的重要通路为胆碱能突触信号通路、神经活性配体-受体相互作用通路及细胞凋亡-多物种通路。由此,我们推测威灵仙治疗癌性疼痛可能通过调控胆碱能信号通路及神经活性配体-受体相互作用通路降低平滑肌细胞内钙离子内流以及肌肉的收缩发挥直接止痛作用,且可以通过细胞凋亡-多物种通路,抑制肿瘤细胞增殖并促进肿瘤细胞凋亡,起到抑制肿瘤的作用,从而有可能间接控制了癌性疼痛。
综上,本研究初步阐释了威灵仙治疗癌性疼痛的潜在活性成分及其可能的作用机制,为进一步药效物质基础和作用机制的实验研究提供了依据。本研究虽然采用了网络药理学的方法对威灵仙主要药效成分的治疗癌性疼痛作用机制进行了理论预测,但其进一步的机制还需要通过生物学技术进行验证。
