载阿霉素脂质体在胶质瘤治疗中的应用
2022-12-14王梦欣罗岚姚荣权林淑萍陈芸
王梦欣 罗岚 姚荣权 林淑萍 陈芸
1北京大学深圳医院超声科(广东 深圳 518000);2北京大学医学部(北京 100089)
脑胶质瘤起源于星形细胞、少突胶质细胞,也可以是这两种细胞共同来源,占所有原发性脑肿瘤的80%,是最常见的中枢神经系统异质性肿瘤,根据细胞种类来源的不同可以分为胶质母细胞瘤(50%)、星形细胞瘤(10%)、少突胶质细胞瘤等多种类型[1]。目前,手术切除是所有胶质瘤确诊患者的首选治疗方案。同时,术后辅助放化疗也是一线治疗方案[2]。由于具有通过血脑屏(Blood Brain Barrier,BBB)的特性,替莫唑胺(Temozolomide,TMZ)是化疗的首选用药,但治疗后患者的预后仍然很差,通常在原肿瘤的2 cm范围内复发。复发后洛莫司汀、卡莫司汀和再次使用TMZ都是常用的选择方案,但60%~75%患者无法从TMZ治疗中受益[3]。挽救化疗使用丙卡巴嗪、洛莫司汀及长春新碱的联合方案,可有一定获益,但有较大的毒性及较严重的副作用[2]。鉴于对常规疗法的耐药性和频繁复发是胶质瘤治疗的主要障碍,迫切需要新的治疗方案来提高治疗效果并靶向肿瘤细胞[4]。基于文献调研,本综述将概述载阿霉素脂质体在脑胶质瘤治疗中的应用,并针对不同的脂质体表面修饰策略展开讨论。
1 阿霉素及其脂质体制剂
阿霉素又称多柔比星(doxorubicin,DOX),作为化疗药广泛用于骨肉瘤、宫颈癌、乳腺癌等多种血液和实体癌症的治疗。DOX常作为颅脑肿瘤疾病模型动物的治疗用药,也可在脑胶质瘤首次和复发治疗的临床试验中使用[5]。由于DOX不具备靶向性,它会诱导健康组织中的细胞凋亡和坏死,导致肝脏、肾脏和心脏的一些剂量依赖性副作用。据文献报道,蒽环类药物诱导的心脏毒性通过引起早期心肌病来限制癌症化疗效果,并且可能在治疗结束数年后产生晚发性心室功能障碍[6]。为避免发生严重的心脏毒性反应,对于无心脏疾病风险的患者,一般要求其累积终生剂量上限为500 ~ 550 mg/m2[5];对于其他有风险或是多药联合化疗的患者,其使用剂量上限更低,这大大限制了其应用。
研究提出DOX联合表观遗传治疗来减少DOX药物心脏毒性[7],但将特定的表观遗传学与心脏保护联系起来的研究还未得到完善。此外,蒽环类药物与心血管保护药物同时使用是预防和减少其心脏毒性的做法之一[8]。目前,右雷佐生是唯一获得美国食品和药物管理局批准的心脏保护剂,然而右雷佐生的有益作用仍然存在争议[9]。故更有效地做法应是改用蒽环类类似物或是使用新型药物递送系统进行局部给药或是靶向给药,在不减弱药物疗效的前提下降低药物的使用剂量。近些年,脂质体作为一种可用于在体内目标部位以受控和持续的方式递送药物的方式,被用作DOX药物的载体,通过使用基于脂质体载体的DOX递送系统可以最大限度地减少心脏毒性,改变其药理学分布,最终减少其在心脏中的积累[10]。非聚乙二醇化脂质体Myocet和聚乙二醇化脂质体Doxil(国际上称Caelyx)两者均表现出了良好的心血管安全性,鼓励了研究者对DOX的纳米制剂进行探索,目前有多种DOX脂质体制剂在进行不同阶段的临床试验[11]。
2 DOX脂质体与血脑屏障
正常情况下,DOX不能穿过BBB,增加BBB的通透性是增强药物递送的重要方法,聚焦超声(FUS)在这一领域显示出巨大的潜力。FUS可以通过其独有的空化效应打开内皮细胞间的紧密连接,从而开放BBB,目前已应用于临床实验中向中枢神经系统递送药物。BELLARY等[12]将DOX脂质体与FUS联合使用,通过评估治疗后的再灌注率来判断和预测DOX脂质体的药物摄取率,结论证明FUS可以通过促进脂质体阿霉素的递送和肿瘤摄取增强原位异种移植模型的化疗效果。PARK等[13]将FUS与DOX脂质体在大鼠脑肿瘤模型的应用也验证了类似的疗效。虽然FUS的引入增强了DOX脂质体的化疗效果,但有学者提出FUS开放BBB潜在的危险是可能会引发脑组织的血管损伤和无菌性炎症,并且其程度与缺血或轻度创伤性脑损伤类似[14]。因此,FUS的安全性有待进一步验证。
3 不依赖FUS的DOX脂质体表面修饰策略
由于脂质体具备化学修饰的便利性,通过对脂质体进行修饰可以帮助药物依赖内源性转运系统穿过BBB,通过主动靶向的方式更精确地到达肿瘤部位,提高肿瘤部位的药物浓度。
3.1 基于细胞穿膜肽的DOX脂质体表面修饰 细胞穿膜肽(cell-penetrating peptide,CPPs)通常由30个或更少的氨基酸组成,它们通过直接渗透、内吞作用或是短暂膜孔的形成穿透细胞膜跨越BBB,增强药物治疗效果[15]。CPPs的内化摄取是非特异性的,与肿瘤靶向肽结合使用可以增强药物向靶向部位的递送[16]。DOX脂质体跨越BBB治疗脑胶质瘤的实验研究中运用的CPPs包括:TAT[17]、iNGR[18]、R8[19]、CB5005[20]、PFV[21]、HTK(R2)2[22]等等,均取得了不错的靶向效果。
3.2 靶向血管内皮细胞和肿瘤细胞表面受体的DOX脂质体表面修饰 不同于CPPs,研究发现在脑毛细血管内皮细胞表面有几种过表达的受体,包括转铁蛋白受体、血管内皮细胞生长因子受体(VEGFR2)和低密度脂蛋白受体(LDLR)等等[23],可以利用此类受体的配体修饰脂质体增强其BBB穿透性。不仅如此,这些受体在一些脑肿瘤中也由于各种原因(包括肿瘤的新生血管增多、增殖旺盛、侵袭力强等等)上调,同时具备靶向胶质瘤的特点。配体修饰的脂质体通过主动靶向方式与细胞结合,可以提高疗效并降低全身毒性。表1总结了通过DOX脂质体表面修饰内皮细胞和胶质瘤细胞表面受体配体跨越BBB和靶向肿瘤的实验研究。
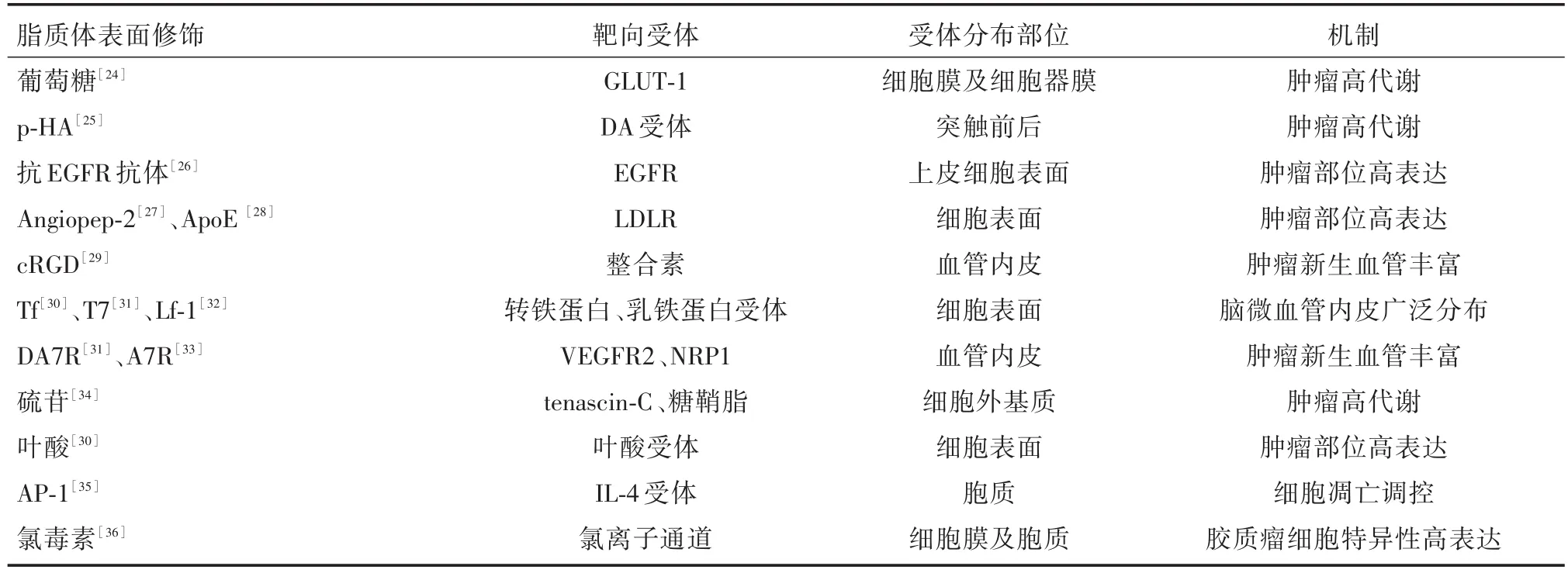
表1 靶向血管内皮细胞和肿瘤细胞表面受体的脂质体修饰Tab.1 Liposome modification targeting vascular endothelial and tumor cell surface receptors
3.3 DOX脂质体的其他表面修饰 脂质体表面的其他修饰主要是聚乙二醇(polyethylene glycol,PEG)化,PEG可以增加脂质体在体内循环时间,是目前临床应用中最常见的修饰方式。PEG可以帮助纳米颗粒从网状内皮系统的捕获中逸出,延长脂质体在循环中的半衰期,这种被动靶向肿瘤组织称为增强通透性和保留(EPR)效应[37]。此外,磷酸三苯酯(TPP)修饰的亲脂性阳离子脂质体对线粒体膜有高度亲和性,可以达到高效杀伤肿瘤细胞的目的,常用作pH敏感性DOX脂质体的表面修饰策略之一[24-25]。
4 讨论
脂质体作为纳米药物递送载体已经获得了很多关注和应用。在脑胶质瘤这类中枢神经系统疾病中使用脂质体包裹药物的优点主要表现在其具备化学修饰的便利性、携带不同类别药物的能力以及可通过不同途径递送药物的潜力[38]。BEIER等[39]在63例新诊断的胶质母细胞瘤患者中采取了PEG化DOX脂质体与TMZ联用的治疗方案,但其结果没有对患者的预后产生有效改善,可能是因为添加PEG和/或长期给予TMZ会适度增加TMZ的骨髓毒性。GLASS等[40]的一项49例复发性高级别胶质瘤患者临床研究中使用了靶向表皮生长因子受体的DOX脂质体与TMZ联用可延长患者中位总生存期两个月。此外,KASENDA等[26]在胶质母细胞瘤患者中使用靶向表皮生长因子受体的DOX脂质体作为新辅助给药的研究表明其对结局产生积极影响。因此,阿霉素脂质体在脑胶质瘤患者的临床应用应着重考虑那些具有表面修饰的制剂类型。
表面修饰后的脂质体可以克服化疗药不具备靶向性的缺点,多种表面功能化和修饰方法使药物具有可控释放、靶向精确、安全、稳定的特点[38]。然而,由于药物传递系统的有效转换依赖于对其物理化学特征如大小、电荷、形态等的严格控制,其表面被做了各种改变和修饰,需要考虑其在血清中的稳定性,同时要关注纳米粒子进入血液后发生的变化,应当考虑它是否会和血液中生化物质发生反应形成蛋白冠等结构[41],目前对于这些方面的研究仍有欠缺。此外,脂质体的临床应用研究不够完善,对多功能脂质体是否引发并发症的考虑也不全面,仍缺乏药物监管机构对于靶向脂质体制剂的评估和指南[38]。相信随着这些问题的解决,DOX脂质体在胶质瘤的应用将取得更大进展。
