细胞膜H+-ATP酶在植物矿质营养中的作用
2022-12-13戴森焕吴海诚张茂星朱毅勇曾后清
戴森焕,吴海诚,张茂星,丁 明,朱毅勇,曾后清*
(1 杭州师范大学生命与环境科学学院,浙江杭州 311121;2 佛山科学技术学院,广东佛山 528225;3 南京农业大学资源与环境科学学院,江苏南京 210095)
质子泵 (即H+泵)是植物体内一类非常重要的转运蛋白。质子泵通过消耗腺嘌呤核苷三磷酸 (ATP)或焦磷酸盐 (pyrophosphate)储存的能量,使H+逆浓度梯度跨生物膜进行转运,从而为养分离子、糖、有机酸等物质的跨膜转运提供质子驱动力和电化学势。植物中的质子泵一般分为细胞膜 (也叫质膜) H+-ATP 酶 (plasma membrane H+-ATPase, PMA)、囊泡型H+-ATP 酶 (vacuolar H+-ATPase, VHA)和 H+焦磷酸酶(H+-pyrophosphatase, H+-PPase)[1–2]。VHA 是一类多亚基质子泵。植物VHA一般由13个亚基组成,主要定位在液泡膜和分泌途径的内膜隔间[2–3]。H+-PPase主要定位在液泡,但也有部分定位在高尔基体和细胞膜[1, 4–5]。大多数PMA蛋白定位在细胞膜,但也有少部分定位在液泡膜,比如拟南芥AHA10与矮牵牛PH5等,它们在进化关系上属于PMA家族的同一个亚组[2, 6–7]。PMA 属于 P 型 ATP 酶超基因家族中的P3A亚家族。PMA在结构上与其他P型ATP酶,如Ca2+-ATP酶、Cu2+/Zn2+-ATP酶和Na+/K+-ATP酶等类似[8]。P型ATP酶在催化ATP水解过程中形成磷酸化的中间体 (phosphorylated intermediate),在排出H+后又回复到原先的构象,从而完成一个循环。
与具有多个亚基的VHA不同,PMA由一条多肽链构成,大小约为100 kDa。PMA一般含有10个跨膜结构域 (transmembrane domain),除跨膜结构域之外,其余部分基本上位于细胞质,包括蛋白的氨基端 (N端)和羧基端 (C端)的自抑制结构域[9](图1)。位于第4和第5个跨膜结构域之间的磷酸化结构域 (phosphorylation domain)主要负责酶的催化水解,而氨基和羧基亲水性末端主要发挥酶活性调节的功能[9]。PMA普遍存在于植物和真菌,但不存在于动物[10]。拟南芥AHA1、AHA3是植物中最早被克隆的细胞膜H+-ATP酶基因[11–12]。PMA是一个多基因家族,例如拟南芥、水稻和大豆分别有11、10和24个成员[13]。植物中PMA基因家族一共可以分成10个亚类,其中维管植物的PMA主要分布在5个亚类 (I~V)中[2]。
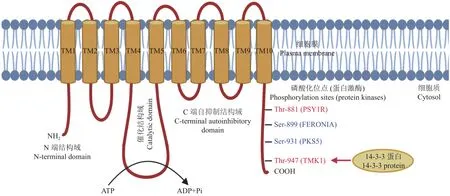
图1 PMA蛋白及C端磷酸化位点的结构示意图Fig.1 Schematic structure of PMA protein and its phosphorylation sites
PMA是植物体内一种极其关键的主宰酶,在各种生理活动中都发挥重要的作用[2, 14–15]。PMA在维持细胞膜电位以及细胞质pH的平衡方面具有不可替代的作用。植物细胞中的大多数转运蛋白都依赖质膜内外H+的电化学梯度,因此各种养分离子和有机酸等物质的跨膜运输需要PMA提供质子驱动力和细胞膜电位。PMA在调节细胞生长、花粉管伸长、气孔开度、养分吸收、糖类运输与装卸,以及生物与非生物胁迫应答 (如养分胁迫、盐胁迫、水分胁迫和病原菌侵染)等方面都具有重要的作用[2, 15–17]。著名的“酸生长”理论,就是指生长素通过激发PMA活性,促进H+从细胞质泵出,使质外体酸化引起细胞壁松弛,从而有利于细胞伸长和膨大[18–19]。本文主要综述了PMA在植物根系生长、有机酸分泌、养分吸收与转运,以及营养缺乏反应中的生理功能。
1 细胞膜H+-ATP酶 (PMA)活性的调控机制
PMA蛋白末端结构域的状态有两种情况:一种是自抑制状态,此时ATP水解与H+转运之间的联结相对松散;另一种是激活状态,此时ATP水解和H+转运紧密结合[9, 20]。PMA活性的调控主要是通过改变N端和C端的自抑制域的空间结构,从而激活或抑制质子泵活性[9, 21]。这种调控方式主要是通过蛋白磷酸化介导[9, 22–23]。蛋白激酶使PMA磷酸化,而蛋白磷酸酶使PMA去磷酸化,这两种蛋白酶的联合作用决定了质子泵的活性状态[2, 24]。目前已经发现多种蛋白激酶和磷酸酶对PMA进行这种翻译后的调控,主要作用在C端自抑制结构域的某些氨基酸残基上[23, 25]。比如,拟南芥 AHA2中Ser-899和 Ser-931的磷酸化会降低质子泵活性,而Thr-881和Thr-947 的磷酸化则会增强质子泵活性[26–29](图1)。PMA倒数第二个Thr (拟南芥AHA2为Thr-947)的磷酸化可以促进PMA与14-3-3蛋白结合,从而解除质子泵C端的自抑制,进一步激活质子泵活性[30–31]。然而,PMA中有些氨基酸残基的磷酸化可以激活质子泵活性但并不依赖于14-3-3蛋白,比如烟草PMA2 Thr-889的磷酸化[32]。然而,有些氨基酸残基的磷酸化反而会阻碍PMA与14-3-3蛋白结合,从而负调控质子泵活性,比如拟南芥AHA2 Ser-931和Thr-924 的磷酸化[26, 33]。PKS5、FERONIA、PSY1R 和TMK1 等蛋白激酶[26–28, 34–35],以及 PP2C-D 和 ABI1 等磷酸酶[36–38]参与调控了PMA的磷酸化与去磷酸化(图1)。植物激素 (如生长素和脱落酸等)、真菌毒素、脂质以及环境因子等,可以通过诱导PMA的磷酸化和去磷酸化来调节质子泵的活性[2, 25, 39–40]。
此外,PMA的活性还受到转录水平上的调控。比如,有些PMA基因的表达受低pH、盐、营养缺乏等环境因素的影响[41–44]。有些PMA基因在植物的各个组织中都有表达,例如水稻OSA7在叶片、根系、保卫细胞及叶肉细胞中组成型表达[45]。但有些PMA基因的表达具有组织特异性,比如拟南芥AHA3在维管组织的韧皮部伴胞特异表达[46–47],水稻OSA9在根系特异表达[45]。在不同组织中特异表达的PMA基因可能具有组织部位特异的功能。然而,目前对PMA家族基因的组织特异表达以及它们对外界环境应答的分子机制还不清楚。
2 PMA在根系生长中的作用
植物根系与养分的吸收密切相关,特别是侧根与根毛。激素是根系发育的关键调控因子。研究表明,外源茉莉酸甲酯诱导莴苣幼苗根毛的形成与PMA活性增强以及根际酸化有关[48]。一般而言,生长素促进地上部的生长 (如下胚轴伸长),抑制根系生长。最近的研究表明,生长素通过胞内TIR1/AFB信号途径引起H+内流而使质外体碱化,从而抑制根系生长;胞外生长素信号通过TMK1引起AHA2蛋白Thr-947的磷酸化修饰,从而激活质子泵活性,这个过程与胞内生长素信号引起的质外体碱化相互拮抗[35](图2)。此外,PMA还参与调控养分缺乏导致的根系构型的改变。低氮可以诱导拟南芥AHA2基因的表达;在不同氮素水平条件下,aha2敲除突变体的主根和侧根的长度均显著降低[49]。拟南芥AHA2和AHA7主要在根系的表皮细胞中表达,它们可能通过驱动细胞扩张而调节根系生长,但AHA2和AHA7负向调节根毛的伸长[50]。拟南芥AHA2和AHA7在根系均受低磷诱导表达;通过介导H+外流,AHA2调节了主根的生长,而AHA7调节了根毛的生长[51]。
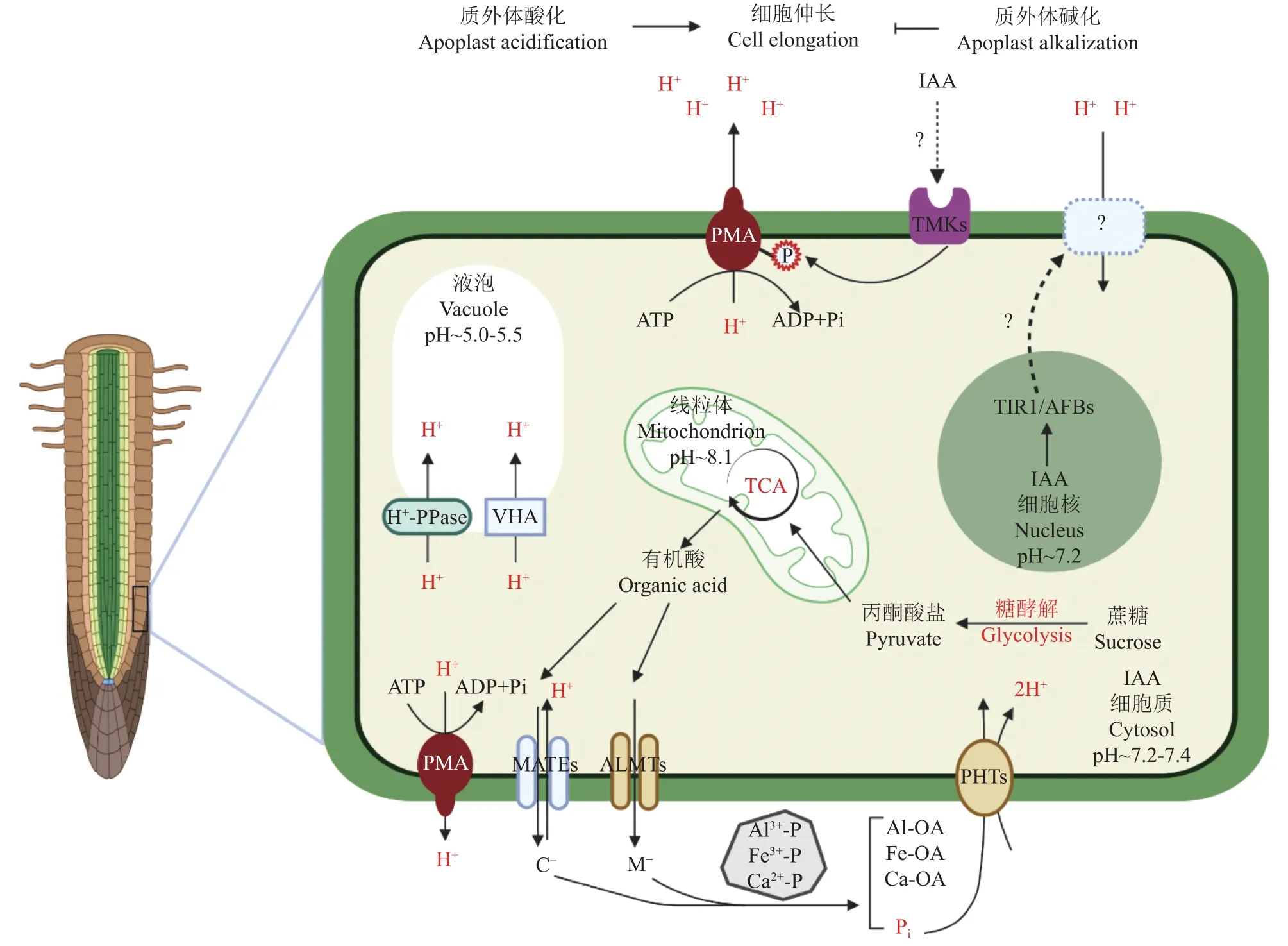
图2 PMA在根系细胞生长和有机酸分泌中的作用Fig.2 Physiological functions of PMA in root cell growth and organic acid exudation
3 PMA在有机酸分泌中的作用
植物根系可以释放有机酸、多肽和酚类等物质以协调植物各种生命活动,包括对养分缺乏和环境胁迫的适应。根系有机酸的分泌由细胞膜上的有机阴离子转运蛋白 (organic anion transporter)或通道蛋白介导,如转运苹果酸的铝激活苹果酸转运蛋白(aluminum-activated malate transporter, ALMT)、转运柠檬酸的多药和有毒化合物转运蛋白 (multidrug and toxic compound extrusion, MATE)[52](图2)。在酸性土壤中,铝毒害是影响植物生长的一个主要限制因子[53]。铝毒能够影响质膜结构,抑制根系生长,降低养分和水分的吸收,从而抑制植物生长和发育。由于土壤中的磷酸盐容易被铁、铝、钙等阳离子固定,使得可供植物吸收的有效磷含量通常很低。铝毒和低磷等环境胁迫均可以诱导植物根系分泌有机酸,如苹果酸、柠檬酸和草酸等[53–56]。根系分泌的有机酸可以通过螯合根际的铝离子,形成不溶性化合物,从而有效降低游离态铝离子的毒害。有机酸分泌还是促进植物获取磷营养的一种重要策略,因为有机酸可以帮助磷酸盐从难以利用的磷酸铁、磷酸铝以及腐殖质中释放出来。研究表明,根系柠檬酸的分泌是以阴离子的形式通过MATE从细胞内以H+反向协同的方式跨膜转运的[57–58]。在铝胁迫下,大豆根尖柠檬酸的分泌和PMA的激活同步进行,且PMA的活化剂壳梭孢素 (fusicoccin)和抑制剂钒酸盐(vandate)对铝诱导的柠檬酸分泌分别具有促进和抑制的效果[59]。蚕豆中铝诱导柠檬酸的分泌还与PMA的翻译后修饰及其与14-3-3蛋白的互作有关[60]。低磷诱导植物柠檬酸的分泌也与PMA有关;低磷可显著诱导白羽扇豆排根PMA的活性和柠檬酸的分泌,且柠檬酸的分泌受到壳梭孢素的诱导,而受到钒酸盐的抑制[61–63]。因此,铝毒和缺磷诱导柠檬酸的分泌都需要依赖PMA提供细胞膜电位并维持质膜内外H+的平衡[64–65]。此外,苹果酸的分泌也可能与PMA介导的H+外排有关,因为在缺磷条件下白羽扇豆排根中苹果酸的分泌与H+分泌成正相关,且它们均受到壳梭孢素的促进,而受到钒酸盐的抑制[56]。然而也有研究表明,有机酸的分泌并不依赖PMA。比如,铝毒诱导番茄分泌草酸不依赖于PMA活性[61, 66];铝诱导白羽扇豆柠檬酸的分泌不依赖PMA活性,而与钾离子外排有关[67]。
4 PMA在氮营养中的作用
氮素 (N)是植物必需的矿质营养元素,也是植物有机体构成最为重要的一种元素。土壤中的氮主要以无机形态的铵态氮 (NH4+)和硝态氮 (NO3–)被植物吸收与利用。NO3–被植物吸收后,需要经过硝酸还原酶 (NR)和亚硝酸还原酶 (NiR)还原为NH4+,然后在根系的质体或茎叶的叶绿体中通过谷氨酰胺合成酶/谷氨酸合成酶 (GS/GOGAT)途径被同化成氨基酸[68]。一般而言,一个NO3–分子还原成NH4+,需要消耗两个H+。植物根系通过铵转运蛋白 (AMT)吸收NH4+,大部分NH4+在根系中很快被同化;一个NH4+同化为氨基酸会产生两个H+[69]。NRT是一个NO3–/ H+同向转运蛋白 (symporter),转运一个 NO3–同时协同运输两个 H+[69–70](图3)。NO3–的吸收通常导致细胞膜电位的去极化[71–73]。NO3–同化过程对H+的消耗可以部分抵消NO3–吸收时伴随的H+流入。通常,供应铵营养导致根际酸化,而硝营养导致根际碱化[74–76]。水稻耐低pH与其偏好铵营养有关,且铵营养引起的根际酸化可以显著提高PMA活性[42]。
研究表明,NO3–对玉米根系中PMA活性也具有诱导作用[77],而PMA的抑制剂可以显著降低玉米根系对NO3–的吸收[78]。香豆素促进玉米根系对NO3–的高亲和性吸收与其促进PMA活性有关[79]。玉米根系PMA家族基因MHA3和MHA4的表达还受到NO3–诱导[80],且其他植物PMA基因,如葡萄VvHA2和VvHA4也受NO3–诱导[81]。在玉米中,耐低氮品种的MHA1基因的表达显著高于低氮敏感品种[82]。水稻在缺氮后恢复供应NO3–,也可以显著诱导OsA2、OsA5、OsA7和OsA8等基因的表达[83]。由此可见,根系对NO3–的吸收与PMA有关。因此,PMA参与调节植物对低氮环境的适应,但其具体机制还不清楚。此外,根系对NH4+的吸收也与PMA有关。研究表明,PMA抑制剂钒酸盐可消除水稻NH4+吸收所产生的细胞膜电势的去极化[84],并显著抑制NH4+吸收,而PMA激活剂则显著提高了水稻根系吸收NH4+的速率[85]。敲除OSA1显著降低水稻根系对NH4+的吸收,而过表达OSA1则显著提高了H+的外排和NH4+的吸收[85]。通过人工microRNA降低水稻OSA2基因表达后,影响了低硝营养条件下水稻对NO3–的吸收,导致叶片中氮浓度显著降低,产量也显著降低[86]。可见,水稻PMA基因同时参与调节NH4+和NO3–的吸收。此外,PMA在氮素的同化过程中也具有重要的调节作用。NH4+的同化过程会产生两个分子的H+,过量的H+如果不能及时排出将会使细胞质急剧酸化从而引起铵中毒[87]。过表达OSA1基因会显著提高水稻根系和叶片中谷氨酰胺合成酶基因 (GS1;2和GS2)和谷氨酸合成酶基因 (NADH-GOGAT1、NADHGOGAT2和Fd-GOGAT)的表达[85],表明过表达OSA1可能增强了GS和GOGAT活性,从而可能促进根系将吸收的NH4+更快速的转化为氨基酸。NH4+的吸收与同化是两个紧密相连的过程。PMA能够将NH4+同化产生的过多的H+排出细胞质,以维持细胞pH的平衡,从而能够促进GS和GOGAT活性,使NH4+的吸收与同化有效的协同起来。这可能是过表达水稻OSA1能够显著提高NH4+的吸收与同化速率,以及氮素利用率的一个主要原因[88]。
土壤中的氨氧化细菌 (ammonia-oxidizing bacteria, AOB)和氨氧化古菌 (ammonia-oxidizing archaea,AOA)等微生物可以将NH4+氧化成NO3–,这个过程被称为土壤硝化作用 (图3)。带负电的NO3–不易被土壤吸附,故容易被淋失,或通过土壤细菌的反硝化作用转化为气态的N2或N2O,从而造成氮素损失和环境污染。一些植物的根系可以分泌抑制硝化细菌活性的有机化合物,比如臂形草内酯 (brachialactone)、3- (4-羟苯基)丙酸甲酯、1,9-癸二醇等,这些物质被称为生物硝化抑制剂 (biological nitrification inhibitors,BNIs),与植物对低氮环境的适应和氮素利用率紧密相关[89–91]。BNIs有亲水性和疏水性两类。研究表明,铵营养条件促进亲水性BNIs的分泌,这个过程与PMA活性有关[44, 89]。钒酸盐可抑制高粱根系BNIs的分泌,而壳梭孢素可促进BNIs的分泌[92]。臂形草内酯作为一种亲水性BNI,其分泌也依赖PMA提供的质子驱动力[93]。总之,亲水性BNIs可能通过未知的阴离子通道从细胞质中排出,这个次级转运过程可能依赖PMA提供的质子驱动力和细胞膜电位。
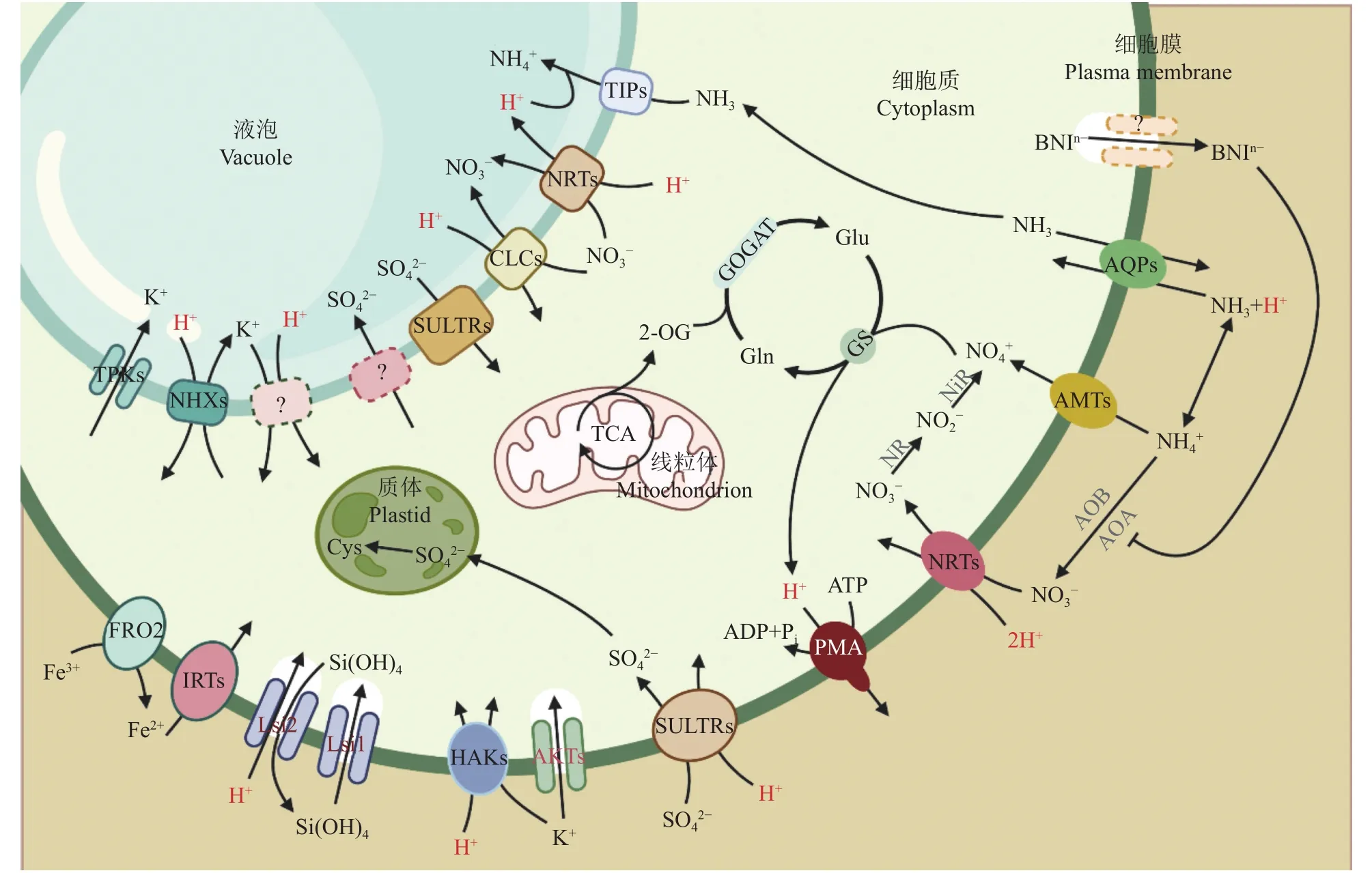
图3 PMA与矿质养分的吸收与同化的关系Fig.3 Roles of PMA in the uptake and assimilation of various nutrients
5 PMA在磷营养中的作用
磷 (P)是核酸和磷脂的重要组成部分,在植物生长与代谢过程中具有关键的作用。磷酸一氢根 (HPO42–)和磷酸二氢根 (H2PO4–)是可供植物吸收的有效态磷酸盐。植物根系通过磷酸盐转运蛋白 (PHT)从外界吸收磷酸盐;PHT是H+伴随的同向协同转运蛋白,通常转运一个磷酸根伴随着2~4个H+的同向运输[94](图3)。因此,磷酸盐的吸收,特别是低磷浓度条件下磷酸盐的吸收 (通过高亲和性转运蛋白),需要依赖PMA提供质子驱动力和电化学势。在低磷条件下,羽扇豆、大豆和水稻等植物根系的PMA活性显著升高[61],可促进磷的吸收和有机酸分泌[62–63, 95]。外源添加可调节PMA活性的化合物可以显著改变磷的吸收[96–97]。水稻铵营养可以通过促进PMA活性,提高根系对磷酸盐的吸收,使铵营养条件下根系和叶片磷的浓度显著高于硝营养下[96]。过表达水稻G蛋白γ亚基qPE9-1通过增强PMA活性和根鞘形成提高了水稻根际有效磷的浓度[98]。敲除OsA8的水稻突变体,其地上部磷浓度显著降低[99]。此外,PMA还通过调节低磷胁迫下根系的生长,参与植物对低磷的响应。比如拟南芥AHA2和AHA7的表达受低磷诱导;AHA2通过介导根系伸长区H+外流调节主根的伸长,而AHA7通过介导根毛区H+外流在根毛的形成中起重要作用[51]。因此,在低磷条件下,植物通过调节PMA活性改变根系构型,提高了磷吸收和有机酸分泌的能力,从而增强植物对低磷胁迫的适应性。
大多数陆生植物可以与丛枝菌根真菌 (arbuscular mycorrhizal fungi, AMF)形成共生,AMF 帮助植物获取养分,植物为AMF提供碳水化合物。低磷环境会促进植物与AMF形成互利共生,以获取更多的磷[100]。植物中一些PMA基因受到丛枝菌根真菌共生的诱导,比如水稻OSA8/OsHA1、苜蓿MtHA1、番茄SlHA8等。这些PMA蛋白为与AMF交界的植物根系细胞膜提供膜电位和运输磷、氮等养分需要的质子驱动力,从而在根系吸收AMF提供的养分方面发挥着重要作用;敲除这些PMA基因则影响丛枝菌根的生长,也减弱了植物通过与AMF共生获取营养的能力,而过表达这些PMA基因促进了AMF在植物根系的定植,也增强了植物对氮、磷的获取[101–103]。
6 PMA在钾营养中的作用
钾 (K)是植物体内含量仅次于氮的必需矿质营养元素,具有维持酶的活性、调节渗透势等重要功能。PMA是细胞膜电位建成的主要因素,而K+的跨膜运输对细胞膜电位具有很强的依赖。很多年前就有研究表明,K+的吸收与H+外排紧密联系[104]。后来的研究表明,K+的吸收通过K+/H+逆向转运蛋白运输并受到膜内外H+浓度梯度的驱动[105]。植物体内KUP/HAK/KT家族的K+转运蛋白通过以H+协同运输的方式吸收或转运K+[106](图3)。在气孔保卫细胞中,PMA通过调节K+运输在气孔运动方面发挥了重要作用。当PMA被激活后,通过外排H+导致细胞膜超极化,进而激活钾离子通道KAT,从而引起K+内流,保卫细胞吸水膨胀后导致气孔打开[107]。反之,当PMA活性受到抑制,导致细胞膜去极化,从而激活K+外流通道蛋白GORK,使气孔关闭[108]。在盐胁迫条件下,植物可以通过激发PMA活性进而促进K+吸收或抑制K+外排,从而增强植物体内的钾含量以应对盐胁迫[109–110]。此外,外源化合物,比如缩节胺 (mepiquat chloride,赤霉素生物合成抑制剂),可以增强PMA活性从而提高棉花根系对K+的吸收[111]。
PMA还参与调节植物对低钾胁迫的响应。当外界K+缺乏时,植物可能通过促进PMA活性,增强H+外排和质外体酸化[104],从而为K+的吸收提供更高的膜电位和质子驱动力[112]。有研究表明,K+可以与PMA蛋白的细胞质磷酸化结构域中包含Asp-617的位点结合,通过使ATP水解和H+外排解耦联从而负向调节跨膜电化学势[113]。在低K+条件下,外界NH4+可以通过促进PMA的活性,增加H+的外排,从而提高K+的吸收[114]。然而,PMA与KUP/HAK/KT和HKT等低K+诱导的K+转运蛋白之间的具体联系的分子机制还不清楚。最近的一项研究表明,过表达OsHAK5增加了水稻根系PMA的活性,并影响了生长素的运输[115]。此外,在某些条件下,K+还可能激活PMA的活性。比如,在高NH4+条件下,提高营养液中K+的浓度可以通过促进PMA的活性从而抑制水稻根系对NH4+的吸收并减轻NH4+毒害[116–117]。可见,K+与PMA之间具有复杂的相互调控的关系。
7 PMA在铁营养中的作用
铁 (Fe)是植物体内必需的微量元素之一,常作为功能蛋白的辅助因子参与细胞的各种活动。虽然土壤铁含量较高,但大部分是无法被植物直接吸收利用的氧化铁或氢氧化铁,缺铁是影响植物生长与发育的一个主要的土壤养分限制因子,特别是在碱性或石灰性土壤。土壤中铁的有效性与土壤pH高度相关,随着土壤pH 的降低铁的有效性显著增强[118]。植物铁吸收机制可以分成两种,即双子叶和非禾本科单子叶植物所共有的以高价铁还原和二价铁吸收为特征的机理І (strategy I) (图3),以及禾本科植物特有的通过分泌高价铁载体来提升根际铁有效性的机理Ⅱ[76, 119]。机理I植物在缺铁条件下可以诱导PMA活性,通过分泌H+酸化根际而增加铁的有效性;但目前尚未在机理Ⅱ植物中发现缺铁诱导H+分泌的现象,说明基于H+分泌的根际铁活化机制是机理I植物所特有的[120]。研究表明,PMA参与调控植物对铁的活化与吸收。在缺铁条件下,拟南芥AHA2、AHA3、AHA4和AHA7受诱导表达,AHA蛋白量显著升高,其中AHA2在缺铁引起的根际酸化中起主导作用[41]。过量表达苹果bHLH转录因子MdbHLH104显著提高缺铁条件下苹果幼苗中PMA的活性和铁的浓度;MdbHLH104可以正向调控PMA编码基因MdAHA8的表达,从而通过促进H+分泌来提高根际铁的有效性和对缺铁的耐受性[121]。MdbHLH104介导的PMA对缺铁的反应还受到类泛素化修饰 (small ubiquitin-like modifier, SUMO) E3 连接酶的正向调节;MdSIZ1可以抑制MdbHLH104蛋白的泛素化降解,从而提高PMA的活性[122]。
8 结论和展望
PMA通过维持细胞膜电位和细胞pH的平衡,在植物根系生长,以及土壤氮、磷、钾、铁等养分的活化与吸收中发挥重要的生理功能。鉴于PMA在植物营养中的重要功能,通过生物技术手段改造作物PMA基因的表达以提高作物对养分获取的能力和对营养逆境的抗性,是提高农业资源的有效利用以及保护生态环境的一种有效策略。然而,我们对PMA在植物营养中的作用和分子调控机制的认识还非常有限。目前,仍有很多问题尚待回答,比如,PMA基因如何受缺磷、缺铁等营养信号诱导,调控PMA基因表达的转录因子有哪些,它们和养分信号是如何关联的,PMA是否以及如何在翻译后水平上受到营养信号的调控。此外,PMA在其他营养元素的吸收与利用中是否发挥作用还不明确。比如,硫、硅等养分的吸收或转运也需要H+的协同作用,但PMA在这些营养元素的吸收与转运中是否发挥作用仍不清楚。
在农业生产中,作物往往面临土壤中的多种养分逆境,比如同时出现缺氮和缺磷、缺磷和缺钾、缺磷和铝毒等问题。通过遗传途径改良作物PMA基因,促进作物对多种养分的获取、吸收和转运,是增强作物抵抗多重营养逆境的一种有效策略。通过根系特异表达的强启动子或营养胁迫诱导型启动子驱动特定的PMA基因,或通过CRISPR/Cas9系统对特定PMA基因的启动子进行编辑[123–124],是提高作物在营养逆境下PMA活性,增强作物养分吸收与利用效率的有效办法。改变PMA上游的调控因子,如转录因子、蛋白激酶、蛋白磷酸酶等基因的表达量,也可以调节植物PMA的活性。此外,对PMA蛋白的某些氨基酸位点 (含磷酸化位点)进行突变,也可以改变PMA活性。值得注意的是,PMA是一种具有多重生理功能的消耗ATP的酶,其活性如果过高可能会导致植物出现能量消耗过大、生长受到抑制、离子毒害、气孔无法正常关闭等负面效应[125]。由于植物所需的碳水化合物来源于光合作用,因此植物养分吸收和碳同化之间具有相互协同的关系。最近的一项研究表明,过表达水稻OSA1可以促进水稻光合作用,同时提高氮、磷、钾等养分的吸收,达到既增加产量又减少肥料使用的效果[85]。如何通过调节PMA活性,将碳同化和营养元素的吸收与同化高效的协同起来,既提高植物生长又提高养分利用效率是一个值得深入研究的问题。
