气管罗萨伊-多尔夫曼病1 例
2022-12-12韩志巍文娣娣郭宁魏梦绮张崴琪张劲松
韩志巍,文娣娣,郭宁,魏梦绮,张崴琪,张劲松
空军军医大学西京医院放射诊断科,陕西 西安 710032
1 病例简介
男,18岁,主诉:胸闷、气短1年余,咳嗽2个月余;患者于2个月前无明显诱因出现阵发性咳嗽,咳少量白色黏液痰,咳嗽剧烈时伴胸痛,活动后气促,影响日常生活,睡眠时可闻及喉部吹哨音。1年前因慢性鼻窦炎、鼻腔息肉行手术治疗。无吸烟史、饮酒史,无家族遗传病史。电子支气管镜示:气管上段右侧壁距隆突4 cm左右处黏膜不规则隆起,致管腔狭窄。右主支气管开口处黏膜不规则隆起,致管腔狭窄,病灶活检,易出血。CT示气管壁多处肿块样增厚,平扫病灶呈等密度,增强扫描呈渐进性强化,病灶跨气管壁生长,管腔狭窄,气管外病变与周围组织分界清楚(图1A~D)。MRI扫描示病灶T1WI呈等信号,T2WI呈稍高信号,信号均匀,边界清楚,相应水平气管狭窄,扩散加权成像呈稍高信号,表观扩散系数为1.3~1.7×10-3mm2/s。与气管周围组织分界不清(图1E、F)。PET/CT示病灶葡萄糖代谢异常增高,最大标准化摄取值为4.2~8.2(图1G、H)。
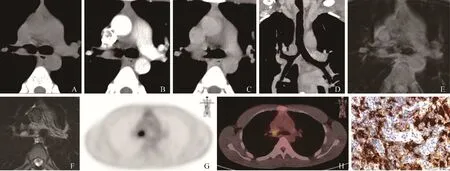
图1 男,18岁,气管罗萨伊-多尔夫曼病。CT平扫(A)示右侧主支气管软组织结节呈低密度、动脉期(B)呈明显强化,延迟期(C)强化稍减弱,冠状位CT重建(D)示病灶致气管及右侧主支气管狭窄,气管左侧壁略厚,纵隔无肿大淋巴结。MRI T1WI(E)、T2WI(F)示右侧主支气管病灶呈长T1(低)长T2(高)信号。PET/CT(G、H)示右侧主支气管病灶核素浓聚明显。免疫组化(×40,I)示:组织细胞S-100蛋白(胞核/胞质)阳性,组织细胞胞质内见吞噬的淋巴细胞(“伸入”现象)
病理镜下见右主气管黏膜慢性炎症伴大量淋巴细胞浸润,未见恶性细胞,深染、淡染区域交错,高倍镜见深染区主要为淋巴细胞及浆细胞,淡染区为胞质丰富淡染的组织细胞,部分组织细胞质内可见淋巴细胞“伸入”现象,免疫组化(图1I):CD1a(-),CD30(-),CD68(+),S-100(+)。增殖指数Ki-67约40%,EBER原位杂交(-),高度提示罗萨伊-多尔夫曼病(Rosai-Dorfman disease,RDD)。一般细菌培养(肺组织、气管、右主支气管):肺炎克雷伯菌(少量);嗜肺军团菌抗体IgM、流感病毒B型抗体IgM、巨细胞病毒抗体IgG、单纯疱疹病毒I型IgG、风疹病毒抗体IgG(+)。给予化痰、舒张气道对症治疗,经3次电子支气管镜下肺活检取材后气道肿物明显缩小,患者症状明显好转。
2 讨论
RDD病因尚未阐明,关于其发病机制的假说有多种,可能为感染性因素、免疫缺陷、自身免疫性疾病、细胞微环境失稳和遗传基因突变等[1]。本例患者无家族史和自身免疫疾病史、无自身免疫异常,也不存在BRAF-V600E突变,因部分病毒抗原阳性,推测可能与病毒感染有关。
RDD常见于10~20岁人群,男性略多,根据病变累及范围不同分为淋巴结型、结外型和混合型[1-2]。在2016版组织细胞和肿瘤修订分类中,RDD属于R组,分为家族型、经典型(淋巴结型)、结外型、肿瘤相关型和自身免疫疾病相关型[3],本例为结外型。RDD约3/4位于头颈部,且以上呼吸道为主(约占73%),胸腔受累(中央气道)少见(2%)[2,4]。气管RDD主要表现为咳嗽、喘息、声音嘶哑、急性呼吸衰竭以及进行性呼吸困难,常伴颈部淋巴结肿大。本例患者主要表现为呼吸道症状。
黄海建等[5]报道RDD病变在镜下可见细胞疏松区和致密区相间分布。细胞疏松区主要为增生的组织细胞,细胞致密区为淋巴细胞、浆细胞等浸润。与本例患者病理镜下表现基本相同。免疫组化检测对RDD诊断有决定性意义,组织细胞常表达CD68、CD163、S-100蛋白等,不表达CD1a、CD207和CD34,其中S-100蛋白(+)是本病的重要特征。本例S-100、CD68(+),CD1a(-)。
RDD的影像学表现无特异性,影像学检查主要用于病灶定位、疗效监测,并有助于观察病灶对周围组织器官侵犯情况(尤其是气道狭窄程度)以及鉴别诊断等。RDD发生于气管的病变CT扫描多呈等密度、腔内生长,致管腔狭窄,累及腔外者较少,且与周围组织分界清晰;增强扫描病灶强化均匀、明显,动脉期强化为著。MRI扫描RDD病灶信号多不均匀,T1WI以等低信号为主,少数为高信号,T2WI以等高信号为主,增强扫描均匀或边缘强化,扩散加权成像弥散受限,PET/CT葡萄糖摄取明显增高[6]。RDD主要需与气管内肿瘤及肿瘤样病变进行鉴别。气管支气管病变影像学均缺乏特异性,最终确诊需依靠病理组织学检查。
