包载携氧微球的天然多糖自愈合水凝胶制备及性能研究
2022-12-11姚雪亮袁伟忠
*姚雪亮 袁伟忠
(同济大学材料科学与工程学院高分子材料系 上海 201804)
随着组织工程领域载细胞水凝胶的不断应用,研究人员发现水凝胶载体中缺乏氧气的环境,会导致所包载的种子细胞因为局部氧分压的不足,无法支撑其存活,从而影响治疗效果。因此,如何解决载细胞组织工程材料局部缺氧情况成为了目前亟待解决的问题[1]。
如图1所示,本研究中,利用京尼平对明胶的交联作用,通过反相乳液聚合的方法,制备包裹了全氟己烷(PFH)乳液的明胶携氧微球。同时利用OSA与CMCS之间的席夫碱反应,制备封装了携氧微球的自愈合水凝胶载体。对其力学强度、自愈合性能、微观形貌以及携氧释放能力等进行探究,探讨该水凝胶系统作为携氧载体的可靠性和应用前景。
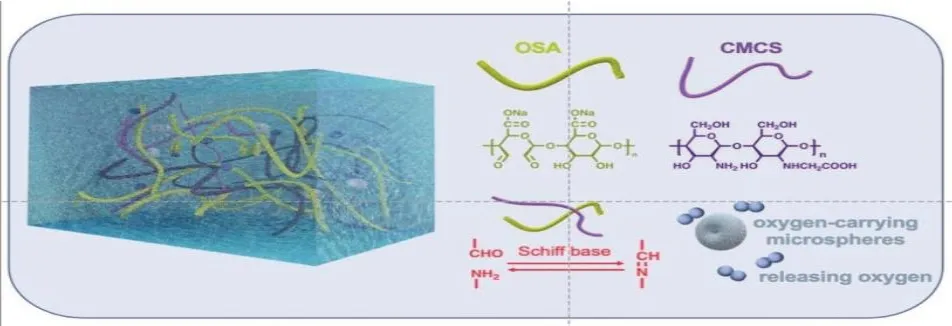
图1 载携氧微球自愈合水凝胶示意图
1.试验部分
(1)试验试剂
全氟己烷(PFH),明胶、液体石蜡、Span 80、京尼平、石油醚、异丙醇、无水乙醇、海藻酸钠、高碘酸钠、乙二醇、羧甲基壳聚糖,分析纯、上海国药集团;蛋黄卵磷脂,分析纯,Adamas公司。氧化海藻酸钠(OSA)根据文献方法[2]制备获得。并根据文献方法[3]用盐酸羟胺氧化滴定的方法对OSA的氧化度进行测定,测得氧化度为24.76%。
(2)试验仪器
分析天平(FA2004),舜宇恒平公司;恒温磁力油浴锅(85-2C,带搅拌),郑州长城实验装备公司;冷冻干燥机(FA-2A),细胞粉碎机(BILON-950E),比朗仪器公司;流变仪(HAAKE MARS 40),德国哈克公司;扫描电子显微镜(Quanta 200 FEG),美国FEI公司;红外光谱仪(Nicolet5700),美国热电公司。
(3)具备携氧能力的明胶微球的制备
在60ml液体石蜡中加入6ml Span 80,搅拌至稳定。在60ml 5%的明胶水溶液中加入1ml 10% PFH乳液,混合均匀后投入到液体石蜡中,80℃下搅拌2h,冷却至室温后加入2ml 10%的京尼平水溶液,搅拌6h,得到明胶微球悬浮液。悬浮液使用离心机在1000rpm离心5min,弃上清液后分别用石油醚、异丙醇和乙醇洗涤3次。得到携氧明胶微球的乙醇分散液。使用前在分散液中持续鼓吹高纯氧气4h后,用细胞滤网将微球滤出,用去离子水洗涤2次。
(4)载携氧微球自愈合水凝胶的制备
以PBS为溶剂,配置质量分数为4%的CMCS溶液,配置质量分数为5%和10%的OSA溶液,分别按体积比1:1混合,加入一定量处理过的携氧微球,室温下缓慢搅拌,静置脱泡,得到载携氧微球的CMCS/OSA水凝胶。
2.结果与讨论
(1)载携氧微球自愈合水凝胶制备结果讨论
如图2所示明胶与明胶微球的红外光谱,可以发现相较于明胶,明胶微球在3434cm-1附近的宽峰向低波数方向发生了位移,属于明胶酰胺基的O-H或N-H的拉伸振动特征吸收峰,这证明由N-H基团参与形成了一定数量的氢键,可见京尼平通过与明胶中的氨基发生席夫碱反应,形成氢键后得到了明胶微球。
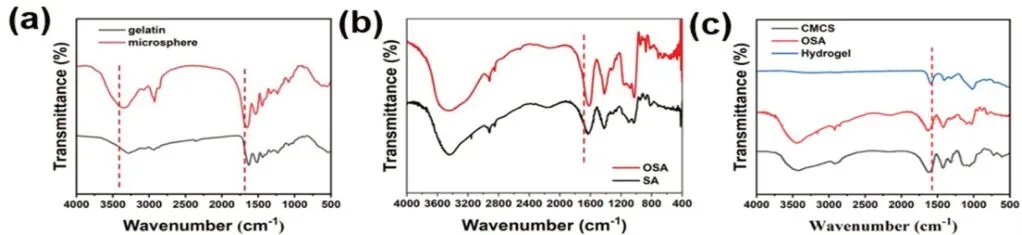
图2 制备所得微球及凝胶的红外谱图
如图2所示SA与OSA的红外光谱,可以发现相较于SA,OSA在1732cm-1处出现了一个新的吸收峰,这里属于醛羰基的对称振动吸收峰,证明SA发生了氧化反应,生成了醛基。
如图2所示,CMCS、OSA、及CMCS/OSA凝胶的红外谱图,相较于CMCS和OSA,CMCS/OSA水凝胶在1640cm-1处产生了一个新的吸收峰,这是CMCS中的氨基与OSA中的醛基之间发生了席夫碱反应,产生-N=C-伸缩振动峰,证明了交联反应的发生。
(2)载携氧微球自愈合水凝胶的流变性能的研究
对不同配比的CMCS/OSA水凝胶进行动态应变扫描,探究OSA浓度对其强度的影响。如图3所示,CMCS/OSA水凝胶在低应变时始终保持了一定强度,当应变达到100%左右后,水凝胶结构被破坏,力学强度迅速下降。而相较于使用5% OSA的水凝胶,使用10% OSA的水凝胶的G’更高,具备了更好的力学强度。
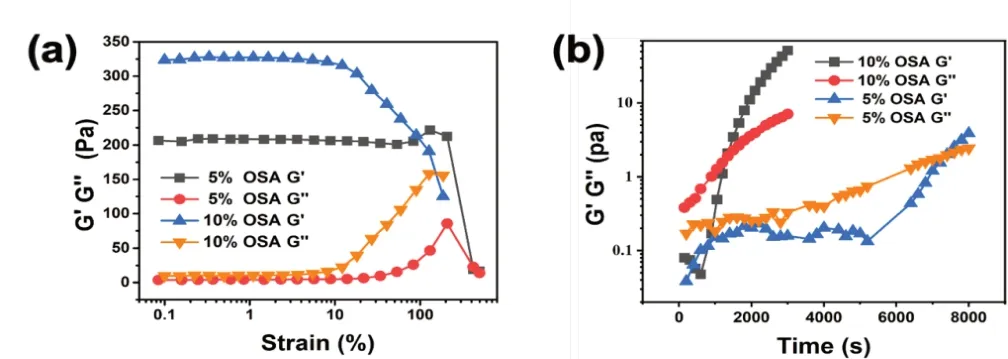
图3 不同配比CMCS/OSA水凝胶动态应变扫描(a)、动态时间扫描(b)
对不同配比的CMCS/OSA水凝胶进行动态时间扫描,以探究OSA浓度对其凝胶速度的影响。如图3所示,CMCS/OSA水凝胶溶液在一定时间内强度逐渐上升,并在一定时间后G’超过G”,完成从溶胶向凝胶的相转变。而随着OSA的浓度增加,其凝胶速度也有所提高。通过图3可知,使用5% OSA的水凝胶需要约7400s完成相转变,而使用10% OSA的水凝胶仅需要约1400s即完成相转变过程,且具备更高的力学强度。
(3)载携氧微球自愈合水凝胶的自愈合性能研究
如图4所示,通过将试样切分后交换拼接,静置一段时间后两组样品之间的边界逐渐模糊,蓝色水凝胶逐渐渗入透明水凝胶,用手提起后两部分未发生分离,基本融为一体。
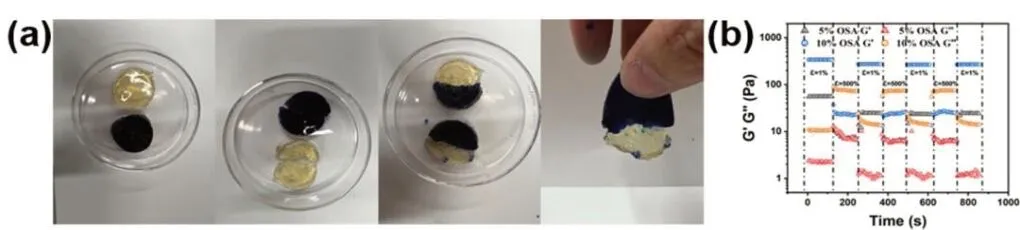
图4 CMCS/OSA水凝胶自愈合性能宏观实验(a)及流变实验(b)
利用流变仪对不同配比的CMCS/OSA水凝胶进行变换应变强度的动态时间扫描,以探究OSA浓度对其自愈合性能的影响。如图4所示不同配比的CMCS/OSA水凝胶均能在1%低应变时保持较好的力学强度,当应变增大至500%时,水凝胶被破坏,强度迅速下降,而当应变恢复至1%后,凝胶能迅速完成自愈合,恢复到一定的力学强度。OSA的浓度对凝胶的自愈合性能没有明显的影响,但凝胶本身的强度会随着OSA浓度的增加而提高。
(4)载携氧微球自愈合水凝胶的可注射性能研究
用安装有22G针头的注射器吸取CMCS/OSA水凝胶,并连续注射挤出,如图5所示,该水凝胶具备良好的可注射性。注射过程中可以保持凝胶态,对内部包载的细胞起到良好的保护作用。

图5 CMCS/OSA水凝胶可注射性宏观实验(a)及流变测试(b)
利用流变仪对CMCS/OSA水凝胶进行稳态剪切扫描,以探究其可注射性。如图5所示,该水凝胶随着剪切速率的增加,粘度迅速下降,具有良好的可注射性。
(5)明胶微球的微观形貌研究
利用SEM观察明胶微球的微观结构。如图6所示,所制备的明胶微球呈较为规整的球形结构,粒径1~10μm不等。较广的粒径分布有助于携氧微球实现较长时间的氧气释放。

图6 冻干明胶微球扫描电镜图
(6)载携氧微球自愈合水凝胶的微观结构研究
如图7所示,CMCS/OSA水凝胶冻干后通过SEM观察,有明显的孔洞结构,且其孔径分布在200μm左右,有足够的空间用于封装细胞以及携氧微球。

图7 冻干CMCS/OSA水凝胶扫描电镜图
如图8所示,载携氧微球自愈合水凝胶冻干后通过SEM观察,其孔洞内壁分布有部分规整的球形结构,可见明胶携氧微球较好的分布在该凝胶内部。
(7)载携氧微球自愈合水凝胶的氧气释放性能研究
对PFH、携氧微球及载携氧微球自愈合水凝胶在一定时间内氧气的释放速率进行探究,如图9所示,PFH乳液在投入无氧水中后,释放速率极快,不足100s时即基本完成了释放;携氧明胶微球则保持了一定的释放速率,约400s后完成释放;载携氧微球自愈合水凝胶则保持了最缓慢的释放速率,约1200s后完成释放。由此可见,明胶微球和载携氧微球自愈合水凝胶均有利于实际应用中氧气的缓释。
(8)载携氧微球自愈合水凝胶的细胞相容性研究
用不同含量、不同浸提时长的水凝胶及其组分的浸提液作为细胞培养基,与NIH 3T3细胞共同培养后,如图10,图11所示,随着浸提液浓度的提高以及共孵育时间的增长,细胞存活率均呈现一定程度的提高,同时对比图10和图11可知,浸提时长对实验结果的影响并不明显。由此可知携氧明胶微球、CMCS/OSA水凝胶以及载携氧微球自愈合水凝胶均无细胞毒性。
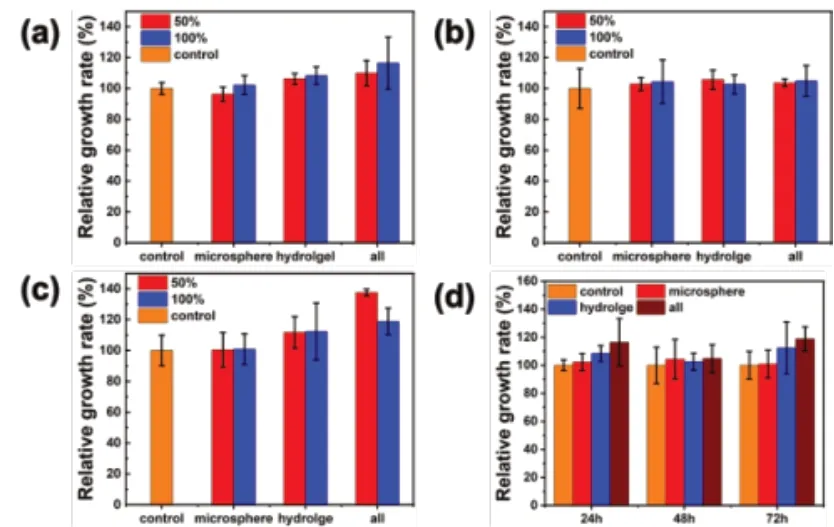
图10 不同浓度的24h浸提液与NIH 3T3细胞共培养(a)24h、(b)48h、(c)72h后细胞相对生长速率;(d)100%浓度24h浸提液与NIH 3T3共培养不同时间的相对生长速率
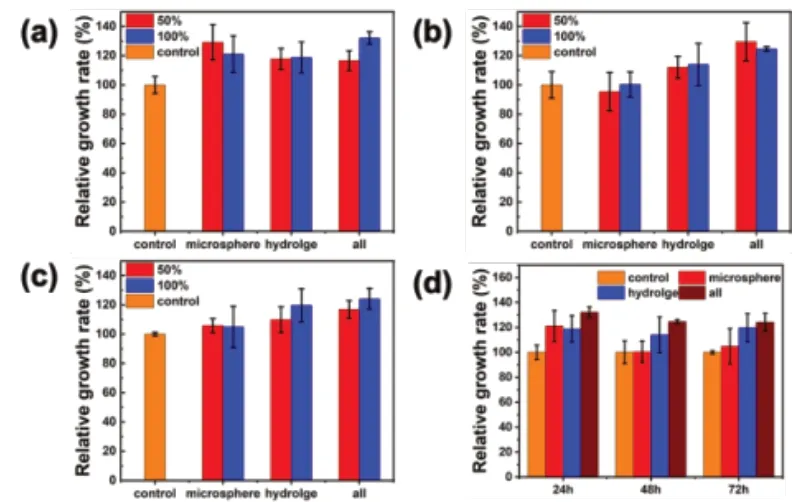
图11 不同浓度的48h浸提液与NIH 3T3细胞共培养(a)24h、(b)48h、(c)72h后细胞相对生长速率;(d)100%浓度48h浸提液与NIH 3T3共培养不同时间的相对生长速率
3.结论
(1)通过反相乳液聚合的方法,利用京尼平对明胶的交联效应制备了包裹PHF乳液的明胶携氧微球。同时利用OSA与CMCS之间的席夫碱反应,得到具有自愈合性的携氧微球水凝胶载体。通过研究发现,所得明胶携氧微球粒径分布合理,适宜作为携氧材料缓释封装的载体使用。所得水凝胶具备良好的力学强度、自愈合性以及可注射性,内部孔径分布合理,适宜用于携氧微球的载体。对载携氧微球自愈合水凝胶的氧气缓释性能进行了测试,相较于PFH的直接使用,携氧微球和载携氧微球自愈合水凝胶都做到了不同程度的缓释功效。
(2)载携氧微球自愈合水凝胶,具备良好的可注射性能,可以实现氧气的缓释功效,实现了携氧材料的合理封装、递送和缓释功能。在生物医学领域具有潜在的研究和应用前景。
