硫化氢对采后粉蕉果实贮藏品质的影响
2022-12-10聂煜冬黎星延刘汉美潘永贵
袁 榕,聂煜冬,黎星延,朱 毅,姜 悦,刘汉美,潘永贵
(海南大学食品科学与工程学院,海南海口 570228)
粉蕉(MusaABB Pisang Awak)属于香蕉的主要种类之一[1-2],是典型的呼吸跃变型果实。由于乙烯作用,粉蕉果实在收获后迅速软化,加速了粉蕉采后品质劣变[3]。而且粉蕉果皮更薄,果肉柔软,采后成熟更快[2]。因此,保持采后粉蕉果实硬度是粉蕉果实贮藏中需要解决的重点问题之一。已有研究发现,可以通过1-MCP处理[4]和薄膜包装[5]等方法来延缓粉蕉果实硬度的下降。
硫化氢(Hydrogen sulfide,H2S)是一种无色易燃的气体,是继一氧化氮(NO)和一氧化碳(CO)之后动植物中的第三大信号分子[6]。近年来,H2S作为一种内源性抗氧化气体信号分子,已被用于改善水果、蔬菜和花卉采后胁迫和延缓衰老[7]。已有研究表明,H2S处理能够延缓桃[8]、鲜切猕猴桃[9]、草莓[10]和番茄[11]等果实的软化衰老,且对香蕉果实细胞内能量[12]、抗氧化系统[13]和抗冷性[14]等方面均有影响。
由此可见,H2S在延长果蔬货架期和延缓贮藏期间的成熟衰老等方面具有很好的作用,在果蔬保鲜方面具有潜在的应用前景。然而,目前关于采后粉蕉果实成熟衰老的研究较少,而H2S处理对采后粉蕉果实成熟软化的影响更是鲜有研究。为此,本研究以海南本地粉蕉果实为试材,研究不同浓度的外源H2S处理对采后粉蕉果实贮藏品质的影响,以期为H2S处理在粉蕉果实贮藏保鲜中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
香蕉 品种为粉蕉,采自海南省海口市澄迈县美丰西香蕉种植园,所有采收的粉蕉表皮呈亮绿色作为采收成熟度,粉蕉果实采收后于2 h内运回实验室,并置于14 ℃条件下预冷;然后选取大小均匀、成熟度一致、无病虫害、无机械伤的果实为试材;硫氢化钠、邻苯二甲酸氢钾 上海麦克林生化科技有限公司;咪鲜胺锰盐 美国富美实公司;氢氧化钠广州化学试剂厂;所有试剂 均为分析纯。
HWS-300智能生化培养箱 浙江托普仪器有限公司;AGILENT 7890A气相色谱仪 美国安捷伦公司;TA.XT plus质构仪 英国Stable公司;CR-400色差仪 日本Konica Minolta公司;PAL-1数显糖度计 日本Atago公司;HH-4数显恒温水浴锅常州奥华仪器有限公司;TGL-16M高速冷冻离心机
上海卢湘仪离心机仪器有限公司;Synergy HT酶标仪 美国BioTek公司。
1.2 实验方法
1.2.1 原材料处理 将粉蕉果实用浓度为1 g/L的咪鲜胺锰盐溶液浸泡2 min进行杀菌,晾干后分成4组,每组120个果实。分别置于含有不同浓度的H2S供体NaHS溶液(0、0.3、0.6和0.9 mmol/L)的保鲜盒内,每个保鲜盒中含有200 mL的NaHS溶液。粉蕉果实和NaHS溶液之间用带孔瓷板隔开,每24 h更换一次溶液,粉蕉果实始终处于H2S熏蒸状态下直至贮藏结束。保鲜盒统一放置在15 ℃,湿度85%~90%下贮藏16 d,每隔三天拍照记录并取样测定相关生理生化指标,所有实验平行3次。
1.2.2 测定指标和方法
1.2.2.1 硬度 粉蕉果皮和果肉硬度均采用质构仪测定。每个处理组取3根粉蕉果实测定其中间部位,采用P/2探头,测试速度为1 mm/s,穿测深度为6 mm。测定时粉蕉果实保留果皮,探头穿刺果皮时和继续穿刺果肉时产生的力,分别为果皮硬度和果肉硬度。每根粉蕉测定3次,最终结果取平均值,单位采用N表示。
1.2.2.2 色泽 粉蕉果皮颜色采用色差仪测定[15]。取3根粉蕉,分别在其中间部位选取三个点,测定其颜色的L*、a*、b*值。
1.2.2.3 失重率 取3根粉蕉,标记后连续称重,计算失重率。
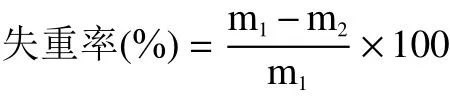
式中:m1表示初始香蕉重量,g;m2表示取样当天测的同一香蕉重量,g。
1.2.2.4 褐变指数 参照吴宁[16]的方法,称取粉蕉果肉匀浆4 g,按1:4的比例(M/V)加入蒸馏水研磨。采用7000 r/min离心12 min。取上清液,用蒸馏水作为空白,在420 nm波长处测定吸光度值,以A420表示褐变指数。
1.2.2.5 可溶性固形物(TSS)含量 采用糖度计进行测定。称取粉蕉果肉匀浆5 g,于7000 r/min离心10 min,取上清液,利用数显糖度计测定,单位采用 %表示。
1.2.2.6 可滴定酸(TA)含量 采用氢氧化钠溶液滴定法测定。称取20 g果肉匀浆用蒸馏水定容,摇匀后过滤,滴加酚酞,用已标定的氢氧化钠溶液进行滴定,最终滴定溶液变成粉红色且30 s不褪色,记录此刻氢氧化钠滴定液体积,每个处理重复3次。测定结果以苹果酸换算,折算系数为0.067。
1.2.2.7 呼吸速率和乙烯释放速率 呼吸速率参照Hu等[17]的方法,随机选取3根粉蕉果实,称重后分别置于2.25 L塑料容器中密封静置30 min,使用红外二氧化碳气体分析仪探针插入容器测定容器内CO2含量,单位采用mg CO2/(kg FW·h)表示;乙烯释放速率参照王甲水等[18]的方法进行测定。随机选取2根粉蕉,称重后放入密闭性良好的容器中,在室温下放置1 h,抽取1 mL的气体试样,用气相色谱仪测定。色谱条件:氢火焰离子化检测器(FID),柱温60 ℃,前检测器温度300 ℃,载气N2,流速25 mL/min。根据标准气体计算果实乙烯生成速率,单位为
μL/(kg FW·h)。
1.3 数据处理
数据统计分析均采用IBM SPSS Statistics 22软件进行数据处理和统计分析。利用Duncan式多重比较对差异显著性进行分析(P<0.05表示差异显著;P<0.01表示差异极显著),用Origin 9.1软件作图。所有试验重复三次,实验结果取平均值。
2 结果与分析
2.1 硫化氢对采后粉蕉果实硬度影响
对于香蕉类果实而言,减缓果实软化是保持果实品质的主要目的。如图1所示,采后粉蕉果实的果皮硬度和果肉硬度在贮藏期间均呈下降趋势。在贮藏期内,未采用H2S处理的果皮和果肉随着贮藏时间延长均呈快速下降趋势。其中,果皮硬度在贮藏末期(第16 d)时,其硬度只有初期的22.19%,而果肉硬度在贮藏到第8 d时其硬度已经只有0.823 N;与此同时,经H2S处理的粉蕉果实果皮和果肉硬度下降速率均明显减缓。其中,对于果皮而言,在贮藏前12 d内,经过H2S处理的粉蕉果皮硬度下降较为缓慢,到第12 d时,0.3、0.6和0.9 mmol/L NaHS处理的粉蕉果皮硬度分别下降了34.62%、23.41%和26.63%,而同期,对照组果皮硬度下降了 48.19%;且在此阶段0.6和0.9 mmol/L处理组之间硬度变化没有显著性差异(P>0.05),但随后均出现快速下降。到贮藏结束时0.3和0.9 mmol/L处理的粉蕉果皮硬度与对照组之间已经没有显著性差异(P>0.05),而0.6 mmol/L组果皮硬度则显著高于其余组别(P<0.05);对于果肉而言,0.3 mmol/L NaHS处理的粉蕉果肉只在前4 d显著地减缓了硬度的下降,但随后开始便快速下降;0.6和0.9 mmol/L组果肉则在前8 d硬度下降均比较平缓,并且在第8 d时,两者硬度之间没有显著性差异(P>0.05),但随后也开始快速下降。到第12 d时,各组别之间果肉硬度均无显著性差异(P>0.05)。以上结果表明,H2S处理在一定程度上减缓了粉蕉果实的软化,其中0.6和0.9 mmol/L处理效果较好。类似的,H2S处理同样延缓了番茄[19]、甜樱桃[20]和草莓[21]果实硬度的下降,维持了果实的质地。表明H2S处理有助于保持果实硬度,减缓果实软化。
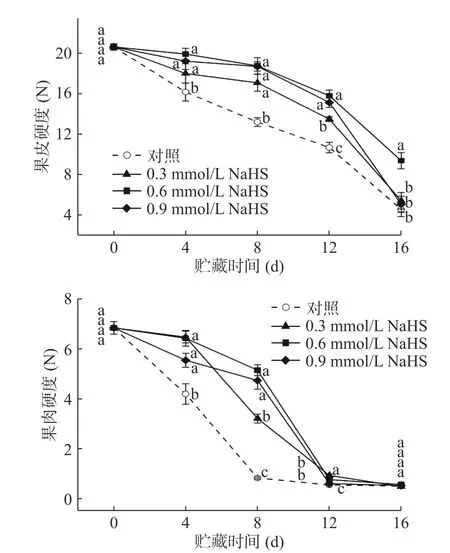
图1 H2S处理对采后粉蕉果实硬度的影响Fig.1 Effects of H2S treatments on firmness in postharvest Pisang Awak bananas
2.2 硫化氢对采后粉蕉果实色泽影响
随着粉蕉果实成熟度增加,果实表皮会迅速褪绿黄化。如图2所示,各组粉蕉果实在贮藏过程中L*、a*和b*值均呈现上升趋势,但H2S处理组上升速率大部分明显低于对照组。从图2B可以看出,经H2S处理后的粉蕉果实褪绿速率明显减缓,各处理组a*值在第8 d和16 d时显著低于对照组(P<0.05);图2C显示,各组果实b*值持续升高,表明果皮颜色不断转黄,其中0.3 mmol/L处理组与对照组之间b*值仅在第12 d时略有差异(P<0.05),0.9 mmol/L处理组与对照组之间b*值始终没有显著差异(P>0.05);而在整个贮藏期间0.6 mmol/L处理组L*、a*和b*值都显著低于对照组(P<0.05),在贮藏末期(第16 d)时,对照组L*、a*、b*值比0.6 mmol/L NaHS处理组分别高出4.17%、125%和7.32%,其原因可能是H2S可以通过改变果实中色素组分及相关酶活性,从而抑制果蔬在贮藏过程中果皮色泽的转变,这与H2S延缓菠菜叶片黄化的结论一致[22]。表明H2S处理有助于延缓果实成熟衰老,其中0.6 mmol/L延缓粉蕉果实黄化最为明显。
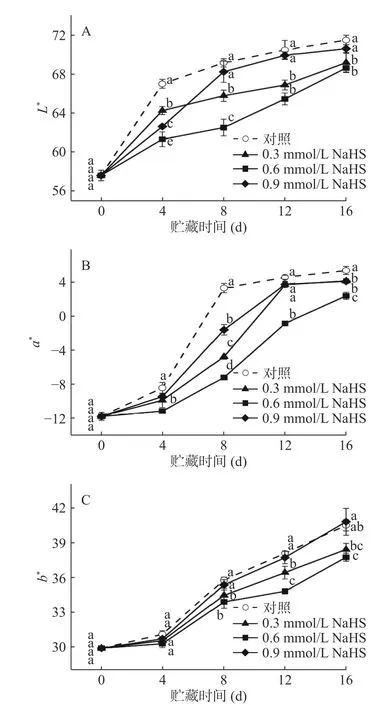
图2 H2S处理对采后粉蕉果实色泽的影响Fig.2 Effects of H2S treatments on color in postharvest Pisang Awak bananas
2.3 硫化氢对采后粉蕉果实失重率影响
如图3所示,随着果实成熟,所有粉蕉果实失重率均呈上升趋势。其中,未经 H2S 处理的粉蕉果实失重率在前4 d缓慢上升,各组之间差异不大,而后快速上升,并在第8 、12 d时显著高于0.6 mmol/L处理组(P<0.05),但与0.3和0.9 mmol/L处理组之间没有显著性差异(P>0.05);而H2S处理的粉蕉果实失重率在整个贮藏期间始终低于对照组,到贮藏末期(第16 d)时,0.3、0.6和0.9 mmol/L处理组分别是对照组的81.61%、59.02%、71.03%;而0.6 mmol/L与0.3和0.9 mmol/L处理组的失重率仅在第8、12 d时略有差异 (P<0.05),0.3和0.9 mmol/L处理组之间在整个贮藏期间始终没有显著性差异(P>0.05),这可能与H2S延缓了果实成熟衰老,从而保持了组织结构完整性有关。以上结果表明,适宜浓度的H2S处理可以维持贮藏期间粉蕉果实的水分含量,减缓采后粉蕉果实失重率的升高,而浓度太高或太低均会减弱其抑制失重率的效果,这与倪志婧[23]研究结果一致。
2.4 硫化氢对采后粉蕉果实果肉褐变指数影响
如图4所示,随着果实成熟,各组粉蕉果实的果肉褐变指数均呈上升趋势。其中,未经H2S处理的粉蕉果实在0.3和0.9 mmol/L处理的粉蕉果实下,贮藏前8 d均呈快速上升趋势,但随后变缓。并且在贮藏前8 d,对照组和0.3 mmol/L组之间褐变指数没有显著性差异(P>0.05),且二者上升速率均较快于0.9 mmol/L的果实。而0.6 mmol/L处理组果实褐变指数在前8 d显著低于另外3组果实(P<0.05)。在第8 d时,0.6 mmol/L组果实褐变指数与贮藏初期相比上升了35.1%,而对照组、0.3和0.9 mmol/L 组分别上升了102%、92.05%和75.94%;但贮藏到第12 d时,各处理组之间果肉褐变指数已经没有显著性差异(P<0.05)。以上结果表明,适宜浓度的H2S处理可以减缓采后粉蕉果实果肉褐变指数的上升,而浓度太高或太低均会减弱其抑制褐变的效果。而Sun等[24]和Zheng等[25]对鲜切苹果的研究也发现,浓度高于0.4 mmol/L NaHS溶液释放的H2S气体熏蒸处理果实同样对褐变有明显的抑制效果。
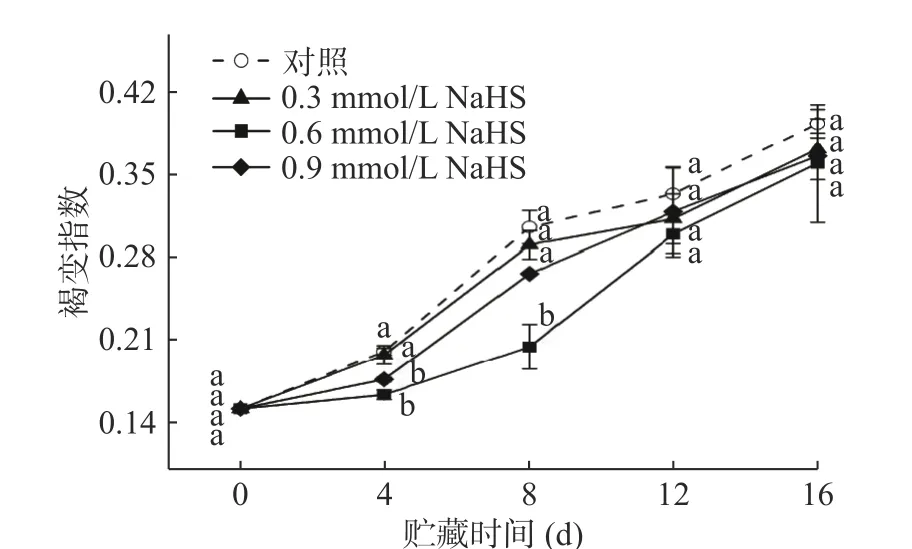
图4 H2S处理对采后粉蕉果实果肉褐变指数的影响Fig.4 Effects of H2S treatments on pulp browning index of postharvest Pisang Awak bananas
2.5 硫化氢对采后粉蕉果实可溶性固形物含量影响
随着果实成熟度的增加,一般果实TSS含量呈上升趋势[26]。如图5所示,在贮藏期间,未经H2S处理的果实TSS在贮藏前8 d呈快速上升趋势,并在第8 d达到高峰,此时其TSS是贮藏初期的5.97倍。随后上升变缓并在第12 d后略有下降;而经H2S处理的各组粉蕉果实TSS则在第8~12 d 之间呈快速上升趋势。同时,统计分析表明,在前12 d,各处理组果实TSS显著低于对照组(P<0.05)。0.3、0.6和0.9 mmol/L NaHS处理组之间在第12 d时有显著性差异 (P<0.05)。表明H2S处理可以延缓粉蕉果实的成熟衰老,延缓TSS的上升。此外,在枣果实中,H2S处理可减少可溶性固形物损失,但低浓度作用效果弱于较高浓度[27]。

图5 H2S处理对采后粉蕉果实可溶性固形物含量的影响Fig.5 Effects of H2S treatments on content of TSS in postharvest Pisang Awak bananas
2.6 硫化氢对采后粉蕉果实可滴定酸含量影响
如图6所示,各组粉蕉果实的TA含量在贮藏期间均呈先升后降的趋势。但对照组果实的TA含量在前8 d迅速上升达到高峰,此时是贮藏初期的3.1倍;而经H2S处理的各组粉蕉果实TA含量则呈缓慢的上升趋势,并在第12 d时才达到高峰。此时0.3、0.6和0.9 mmol/L处理组TA含量分别是贮藏初期的 2.82、2.49 和 2.55 倍。到贮藏末期(第16 d)时,各组均迅速下降,对照组显著低于0.3 mmol/L 并显著高于0.6 mmol/L处理组(P<0.05),0.9 mmol/L处理组与对照组之间无显著差异(P>0.05)。这与张明晶[28]和黄俊豪[2]的研究结果相一致。结果表明,适宜浓度的H2S处理能在一定程度上抑制酸的积累和TA含量的变化,延缓粉蕉果实成熟度增加。
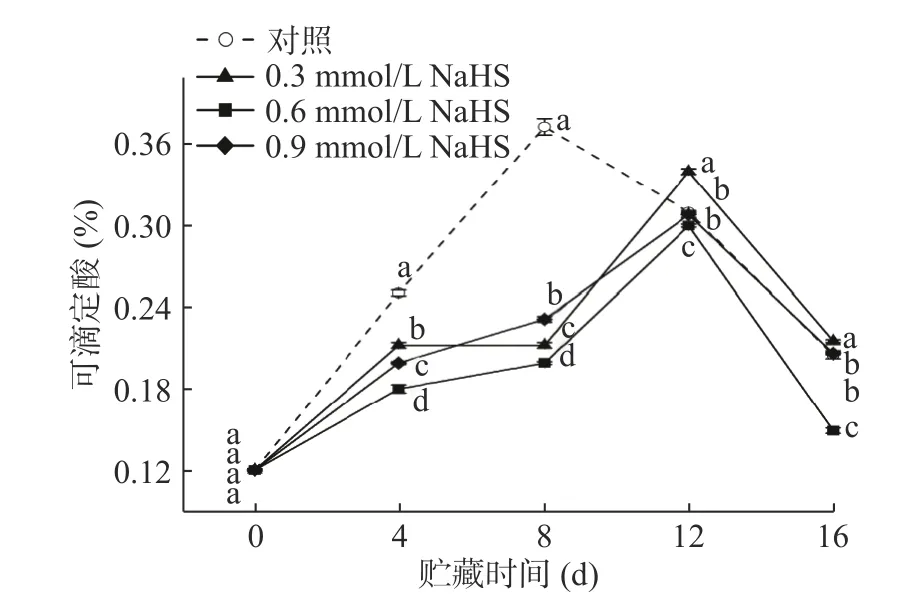
图6 H2S处理对采后粉蕉果实可滴定酸含量的影响Fig.6 Effects of H2S treatments on content of TA in postharvest Pisang Awak bananas
2.7 硫化氢对采后粉蕉果实呼吸速率和乙烯生成速率影响
粉蕉作为香蕉的一个品种,其同样呈现出典型的呼吸跃变型果实的特点。随着果实成熟度的增加,其呼吸强度和乙烯生成均呈现先上升后下降的趋势(图7)。而H2S处理均推迟了粉蕉果实呼吸和乙烯生成高峰4 d,均在第12 d时达到峰值。其中,在前8 d内,H2S处理的果实呼吸强度均显著低于对照组果实。到第12 d 时,对照组呼吸速率迅速下降到比第4 d时略高的水平,随后缓慢下降;而H2S处理组快速上升达到峰值并显著高于对照组(P<0.05);到贮藏结束时,各处理组仍维持较高呼吸速率且与对照组之间差异显著(P<0.05),其中0.3和0.9 mmol/L处理组之间已没有显著性差异(P>0.05),0.6 mmol/L处理组显著高于其余组别(P<0.05)。与此类似,NaHS处理同样显著抑制了桑葚果实的呼吸强度[29]。

图7 H2S处理对采后粉蕉果实呼吸速率和乙烯生成速率影响Fig.7 Effects of H2S treatments on respiration rate and ethylene production rate of postharvest Pisang Awak bananas
而乙烯方面,H2S处理的果实则在第4~12 d之间显著低于对照果实(P<0.05)。并且在整个贮藏期间,不同浓度处理的果实之间乙烯生成速率差异不显著(P>0.05);到贮藏结束时0.3和0.6 mmol/L处理的粉蕉果实乙烯生成速率与对照组之间已经没有显著性差异(P>0.05),而0.9 mmol/L组乙烯生成速率显著高于对照组(P<0.05)。表明适宜浓度的H2S处理在一定的贮藏期内可以有效地抑制粉蕉果实呼吸和乙烯的生成,推迟达到高峰的时间4 d,从而有助于延缓果实成熟衰老。类似的结果也得到了Li等[30]和Luo[31]的证明,但在猕猴桃中发现较高浓度的H2S反而增加了乙烯的生成量[32]。
3 结论
本研究发现,H2S处理可以延缓采后粉蕉果实硬度的下降,且在整个贮藏期间0.6 mmol/L NaHS处理组的果皮和果肉硬度始终显著低于其余各组(P<0.05),在延缓果实软化的效果上0.6 mmol/L NaHS处理最为明显。同时,H2S处理延缓了粉蕉果实的褪绿变黄以及失重率、果肉褐变指数、TSS含量和TA含量的升高,还显著抑制了粉蕉果实呼吸速率和乙烯生成速率(P<0.05),推迟了其达到峰值的时间4 d;且除了TSS含量和乙烯释放速率外,不同浓度NaHS处理组间均显示出显著差异(P<0.05),以0.6 mmol/L NaHS处理保鲜效果最好。表明适宜浓度的H2S处理能够通过延缓粉蕉果实成熟衰老,从而减缓果实品质劣变。此外,研究表明,人体血浆H2S浓度为5.2×10-6mol/L[33],而果蔬中H2S的使用浓度非常低,1.0 mmol/L NaHS释放的H2S气体浓度仅为1.5×10-10mol/L[34],残留水平远低于内源性人体血浆H2S水平,因此用NaHS作为H2S供体处理果蔬可以认为是安全的。然而,未来研究还需要进一步深入了解H2S处理对粉蕉果实细胞代谢影响,及其在果实软化衰老的潜在作用,为未来允许其进入商业用途提供理论依据。
