梅奇酵母氨基甲酸乙酯酶分离纯化与酶学性质分析及其对葡萄酒香气的影响
2022-12-10孟凡徳史学伟
孟凡徳,史学伟
(1.新疆兵团第五师科技局,新疆博乐 833400;2.石河子大学食品学院,新疆石河子 832000)
梅奇酵母(Metschnikowia)是一种广泛存在葡萄 表皮的野生酵母,主要作用于葡萄酒发酵前期[1],可增加葡萄酒香气等风味物质,有效抑制葡萄酒“变质”[2]。氨基甲酸乙酯(Ethyl carbamate,EC)是一种多位点2A级[3]致癌物。早在50多年前,Lofroth等首次在啤酒中检测到氨基甲酸乙酯[4],而后许多研究中,在白兰地、葡萄酒[5]和中国黄酒等酒精饮料[6]均有发现。参与EC合成的前体物质主要是氨甲酰基团,如尿素、瓜氨酸和氨甲酰磷酸[7]等。EC代谢途径一般分为三种,分别是:尿素与乙醇、瓜氨酸及氰化物途径,其中尿素与乙醇的反应是最为常见的氨基甲酸乙酯生成途径[8]。除此以外,酵母菌通过氮代谢分解精氨酸可以间接控制EC形成[9]。
通过添加酸性脲酶来[10-11]控制EC前体物质的形成、调控EC形成条件和水解法降低EC含量可以控制酒类饮料中EC形成。相对于梅奇酵母的研究大都集中于在酿造过程与酿酒酵母(Saccharomyces uvarum)混菌发酵生产低醇葡萄酒[12-13],部分学者筛选一株可以降解EC的酿酒酵母[14],同时对筛选可降解EC的菌株优化了其产酶条件[15-17]。除此以外,对于降低酒精饮料中EC研究报道也层出不穷。程艳等[18]利用高通量诱变降低EC前体物质从而降低其含量,吴殿辉[19]对黄酒专用的酿酒酵母的基因组进行改造降低EC含量。通过微生物酶解降低葡萄酒中EC含量的方法是一种安全、有效、绿色的方法,但是由于不同酒体的环境条件不同,具有降解EC能力的菌株呈现出较低的发酵性能,难以在葡萄酒的酿造中使用,并且分离纯化酿酒酵母后所产的EC降解酶在高乙醇、低酸条件下,酶的活性往往会受到明显地抑制。综上所述,筛选EC降解菌及分离纯化高耐酸性、高乙醇耐受性的EC降解酶在目前来说具有重要的意义。
顶空固相微萃取结合气相色谱-质谱联用技术(Headspace solid phase microextraction gas chromatography-mass spectrometry,HS-SPME-GC-MS)在环境检测[20]、医学检验[21]和农畜产品质量检测[22]、测定葡萄酒中挥发性香气成分含量测定[23]时作为首选检测技术。本研究以前期实验室报道出的一株具有较好的EC降解能力[24]的鲁考弗梅奇酵母菌(Metschnikowia reukaufii)为研究对象,采用硫酸铵盐析、离子交换层析方法对该酵母菌所产的EC酶进行分离纯化,并进一步研究该降解酶的酶学性质,为该菌株产EC的工业化生产及EC酶在后期处理葡萄酒中EC的使用提供理论借鉴。
1 材料和方法
1.1 材料与仪器
供试葡萄酒 新疆张裕巴堡男爵酒庄(MR)和新疆西域明珠酒庄(SR);葡萄糖、蛋白胨、酵母浸粉、牛血清蛋白 天津盛奥化学试剂有限公司;NaCl、KH2SO4、Na2SO4、CH3OH、NaOH、HCl、柠檬酸、柠檬酸钠、(NH4)2SO4、Na2HPO4奥博星生物技术公司;CH3CH2OH(99%)、乙醚(90%)、丙酮
天津市富宇精细化工有限公司;氨基甲酸乙酯、D5-氨基甲酸乙酯(99.9%) Sigma公司;上述试剂除特别标明以外,均为分析纯;3-辛醇(99%) 北京索莱宝科技有限公司;正构烷烃混标(C7~C33) 广州威佳科技有限公司。
722光栅分光光度计 上海精若科学仪器有限公司;VCX500超声细胞破碎仪 Sonics & Materials. Ins;PS2001琼脂糖凝胶电泳仪、Gel DC XR凝胶成像系统 北京六一生物科技有限公司;FRESCO 21低温高速离心机 Thermo Fisher Scientific;Agilent7890B GC与Agilent5977 MS检测器、HP-5 Innowax毛细管柱 安捷伦分析仪器有限公司。
1.2 实验方法
1.2.1 粗酶液制备 参考刘晓慧[25]的方法。吸取1 mLMetschnikowia reukaufii菌种保藏液于50 mL活化培养基(蛋白胨1.0 g/L、葡萄糖2.0 g/L、酵母浸粉2.0 g/L,氨基甲酸乙酯5.0 g/L)中,28 ℃恒温连续培养24 h。以1%的接种量接种到发酵培养基[26](麦芽糖15.0 g/L,NH4Cl 5.0 g/L,酵母浸粉5.0 g/L,氨基甲酸乙酯7.5 g/L)中,以相同条件培养。以2%的接种量将处于对数生长期的种子液接种到新鲜的发酵培养基中,28 ℃、170 r/min连续振荡培养48 h,以制得发酵液。
发酵液在低温条件下,6000 r/min离心10 min弃上清液收集菌体。用0.05 mol/L、pH3.0~7.0柠檬酸缓冲液冲洗菌体,离心收集菌体,重复操作2次后得到菌体,再次以适量体积柠檬酸缓冲液洗涤菌体于冰浴中超声破碎细胞30 min,4 ℃、8000 r/min离心10 min,此时上清液即为粗酶液。
1.2.2 EC酶的分离纯化 采用杨广明[27]和张美珍等[28]的方法并做了部分改进。取50 mL粗酶液,向其中缓慢分别加入60%、65%、70%、75%、80%、85%、90%(NH4)2SO4,充分混匀,4 ℃静置过夜沉淀。4 ℃、8000 r/min离心5 min,得到沉淀后加少量蒸馏水复溶,透析袋透析48 h,每8 h换一次水直至完全去除(NH4)2SO4。使用Hitrap DEAE FF预装柱进行离子交换层析,0.2 mol/L、pH7.9的PBS缓冲液进行平衡,加入1 mol/L NaCl于PBS缓冲液进行梯度洗脱。
洗脱液使用超滤管进行快速浓缩,之后使用凝胶层析法进行最终酶的纯化,该步骤使用Superdex 200凝胶柱。对纯化后的EC酶进行酶活的测定。
1.2.3 粗酶酶活及蛋白含量的测定 对1.2.1中粗酶液中粗酶及分离纯化后EC酶的酶活进行测定。酶活测定参照周雪燕等[16]的方法,采用Berthelot比色法。其中将常温常压下1 min分解相应底物产生1 μmol氨的酶量为1个酶的活力单位称之为酶活[17]。
对粗酶液中粗酶的蛋白质含量测定参照Bradford[29]和丁霞等[30]方法,使用Bradford蛋白浓度测定试剂盒对蛋白含量进行测定。
1.2.4 EC酶酶学性质测定 最适反应温度及热稳定性:将纯化后的降解酶分别在25、30、35、40、45、50、55、60、65、70 ℃的不同温度下进行反应时测定酶活,测定酶的最适反应温度。将降解酶置于上述温度区间下恒温30 min,将其转移到最适温度下进行酶活的测定,确定EC酶的热稳定性。
最适pH及pH稳定性:在最适温度下,将酶置于3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的不同pH条件下进行反应时测定酶活,得到降解酶的最适pH。将降解酶置于上述pH梯度下,以最适温度恒温30 min后测定酶活,研究降解酶的pH稳定性。
乙醇耐受性试验:在最适pH条件下配制1%、3%、5%、7%、9%、12%、15%、18%的不同浓度的乙醇溶液,添加3% EC作为底物和3%的EC酶,测定反应时的酶活。
1.2.5 EC酶对不同底物降解能力研究 参考谷晓蕾等[31]方法,在最适温度和最适pH的条件下,在0.05 mol/L、pH3.0~7.0的柠檬酸缓冲液分别添加3%的氨基甲酸乙酯、尿素、谷氨酸、谷氨酰胺、精氨酸和瓜氨酸为底物,加入3% EC酶。取1 mL于比色管,50 ℃水浴反应30 min, 测定OD625值。
1.2.6 EC酶对挥发性香气物质影响研究 将提取纯化后的EC酶以3%的接种量接种至市售干红葡萄酒中进行反应,24 h后测定相关成分。添加了EC酶的葡萄酒为实验组,未添加的市售干红葡萄酒酒样为对照组。
参考孙娜等[32]作改性方法,采用HS-SPMEGC-MS法测定市售干红葡萄酒中挥发性香气成分,并对其进行定性定量分析。称取1 g NaCl和5 mL加入酒样于10 mL顶空瓶中,同时加入2 μL 1 μg/L 3-辛醇标准溶液。样品在45 ℃平衡20 min,恒温以500 r/min持续60 min,萃取结束解吸5 min。使用Agilent7890B GC与Agilent5977 MS检测器与HP-5 Innowax毛细管柱(30 mm×0.25 mm,0.25 μm)进行检测。进样口温度设定为230 ℃,氦气作为载气,流速设定为1.0 mL/min。将GC炉温度保持在40~180 ℃,3 mL/min,5 min时上升到230 ℃。在离子源温度270 ℃、电子能源70 eV时,获得电子冲击质谱,总离子色谱仪(TICs)扫描范围为35~500 m/z,速率5次/s。
定性分析:根据化合物保留指数RI(Retention Index,RI)(≥800)及NIST14谱库检索处理初步确定挥发性成分名称。其中,通过正构烷烃(C7~C33)混标物的保留时间来计算未知化合物的RI值,保留指数根据改进的Kovats法计算得到[33]。
定量分析:以3-辛醇为内标物,采用内标法进行半定量分析,挥发性成分的质量浓度根据公式(1)计算[34]。

式中:X:香气物质质量浓度,μg/L;A:所测峰面积;A0:内标物峰面积;C:内标物质量浓度,μg/L。
1.3 数据处理
本实验所得数据以平均值±标准偏差显示,采用Smica 14.1和Origin 2018软件进行绘图分析,R语言用做聚类分析。
2 结果与分析
2.1 纯化前后EC酶酶活及蛋白含量变化
采用Berthelot比色法对分离到含有EC酶的粗酶液进行酶活测定,分别比较了纯化前后的酶活及蛋白含量的变化(图1)。纯化前酶活0.16 U/mL,纯化后酶活提高至0.35 U/mL;与之相反,纯化前蛋白含量4.43 mg/L,纯化后蛋白含量降低至2.62 mg/L。结果表明,经过纯化后的EC酶酶活提高了约1.2倍,而蛋白含量大约降低了0.4倍,这主要是因为葡萄酒中的酶大多数属于是蛋白质,在纯化除去其他酶后,酶含量有所降低。
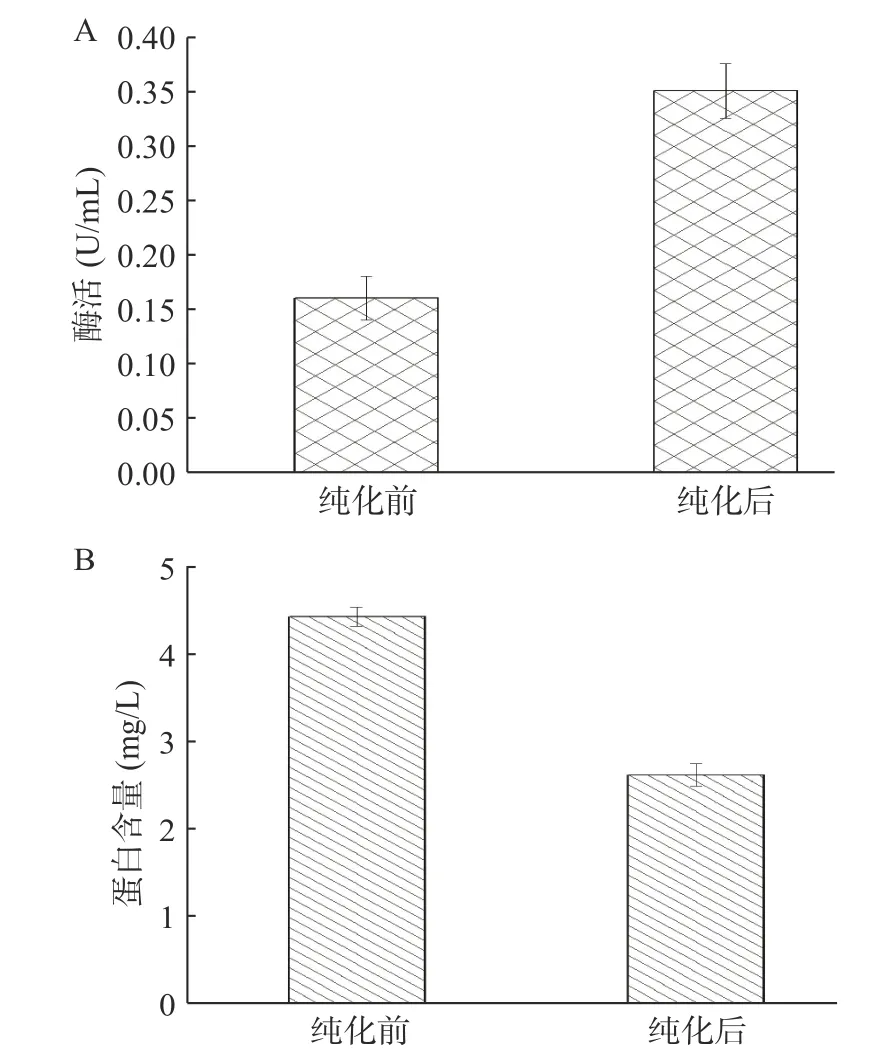
图1 纯化前后EC酶的相对酶活(A)和蛋白含量(B)的变化Fig.1 Changes of the relative enzyme activity (A) and protein content (B) of EC enzymes before and after purification
2.2 EC酶酶学性质分析
2.2.1 EC酶的最适温度及热稳定分析 通过测定EC酶的最适温度及热稳定性,结果表明,EC酶的酶活性和稳定性受不同温度的影响较大(图2)。Metschnikowia reukaufii菌株所产EC酶最适作用温度为35 ℃,在该温度下酶活达到了0.52 U/mL,并且在25~45 ℃范围内,EC酶酶活高于0.28 U/mL,且热稳定性较强,这同之前所报道的结果相一致[35]。当温度持续30 min后在35 ℃时EC酶酶活达到0.51 U/mL,酶活降低速率极低,几乎可以忽略不计。结果表明,EC酶最适作用温度为35 ℃,热稳定性强。在后期使用中可将EC酶加入成品葡萄酒中置于35 ℃时,该酶可发挥的降解作用最大。
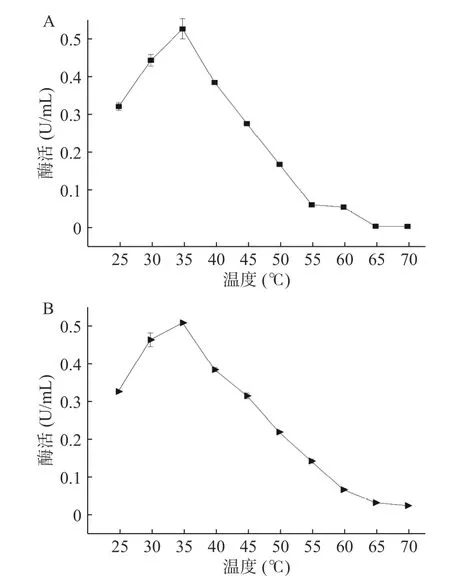
图2 酶作用的最适温度(A)和热稳定性(B)Fig.2 Optimum temperature (A) and thermal stability (B) of enzyme action
2.2.2 EC酶的最适pH及pH稳定性分析 在酿酒过程中控制其初始pH可降低EC含量[36],通过对比EC酶的最适pH及pH稳定性发现(图3):当pH处于5~6之间时,EC酶的酶活能够保持在0.30 U/mL以上。当pH为5.5时酶活最高,高达0.52 U/mL;当pH大于7.0时,酶的活性受抑制作用比较明显,酶活接近于0,失去活性。与此同时,当EC酶在pH5.5条件下维持30 min后酶活虽降低到0.49 U/mL,但酶活降低速率依旧低于其他pH条件;结果表明,EC酶最适pH为5.5,且该酶在pH5~6之间时稳定性较强,这也说明该酶酸稳定性强,碱稳定性较差。因此,该酶在弱酸性酒精饮料中能更好地发挥作用,例如干红葡萄酒。
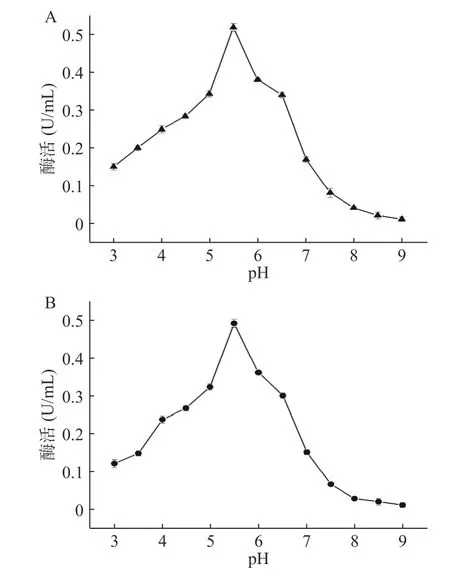
图3 酶作用的最适pH(A)和pH稳定性(B)Fig.3 Optimal pH (A) and pH stability (B) of enzyme action
2.2.3 EC酶的乙醇耐受性分析 随着乙醇体积分数逐渐增加,EC酶的酶活呈现下降趋势。当乙醇体积分数范围为12%~14%,EC酶的酶活降低到0.12 U/mL(图4),这可能是由于高浓度乙醇可能导致酶结构发生变化,进而导致活性的降低。文献表明,当葡萄酒中乙醇分数为12%~14%时,使用EC酶可将EC含量降解至质量浓度≤20 μg/L[37]。结果表明,当乙醇体积分数范围为12%~14%,EC酶具有一定活性。
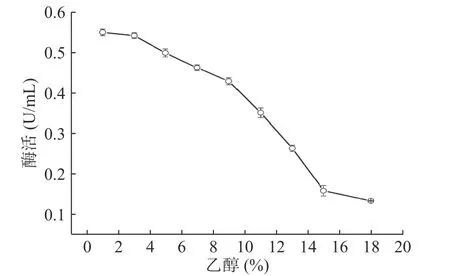
图4 乙醇对酶活的影响Fig.4 Effect of ethanol on enzyme activity
2.3 EC酶的降解底物特异性分析
为了解EC酶对底物的特异性,添加EC、尿素、谷氨酸、谷氨酰胺等不同底物,底物特异性研究结果如图5所示。EC酶对EC、尿素具有较高的降解效率,降解率分别为77.50%、82.40%,并且对合成EC相关的一些其他前体物质(精氨酸和瓜氨酸)具有一定的降解能力,而对谷氨酸和谷氨酰胺却没有降解能力。表明该EC酶具有较强的底物专一性,且具有效清除EC及其前体物质的能力。
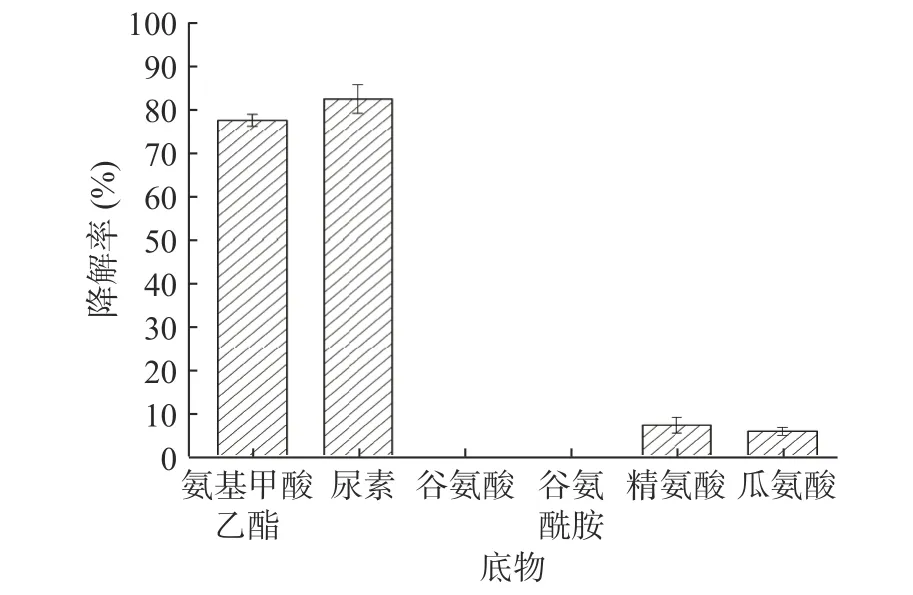
图5 EC酶对不同底物降解率Fig.5 Degradation rates of different substrates by EC enzymes
2.4 不同处理的干红葡萄酒挥发性香气成分比较分析
通过不同处理方法比较EC酶对葡萄酒挥发性性风味物质的影响,结果如图6A所示。通过主成分分析得到该图解释了原变量总方差79.9%,主成分1解释原始变量总方差71.2%,剩余8.7%由主成分2解释。结果表明两款葡萄酒的挥发性化合物具有一定的差异性,但是对同一种葡萄酒进行接种纯化后EC酶处理后,相较于MR酒样SR酒样香气成分更具有一定的相似性。

图6 两款葡萄酒不同处理后挥发性化合物的主成分分析(A)及热图(B)Fig.6 Principal component analysis (A) and heat map (B) of volatile compounds in two wines with different treatments
通过挥发性化合物的聚类热图(图6B)可以看出,两种葡萄酒挥发性化合物的种类差别不大,但是含量差异明显。SR酒样在加入EC酶前后月桂酸乙酯、苯乙醇、乙酸乙酯、乙酸、乳酸乙酯、己酸乙酯、环丁醇、月桂酸含量均较高,无明显变化,且在加入EC酶处理后酒样中己酸乙酯含量增加;MR酒样在加入EC酶纯化后苯甲醇、正己酸、乳酸丙酯、异丁酸、癸酸异戊酯等含量较高,无明显变化,在加入EC酶纯化后十七烷-9-醇和(R)-(+)-β-香茅醇含量增加。结果表明:两款酒经过处理以后,各自的挥发性化合物组成及含量基本没有变化,这说明EC酶对于葡萄酒的挥发性香气物质几乎没有影响。
3 结论
本研究通过对实验室前期分离得到的一株鲁考弗梅奇酵母(Metschnikowia reukaufii)所产的EC酶进行分离纯化后,分析了EC酶的酶学性质,发现分离纯化后的EC酶的酶液蛋白含量虽减少,但其酶活提高了约1.2倍。EC酶酶学性质分析结果表明,EC酶的最适作用温度为35 ℃,最适作用pH为5.5,且该酶在pH为5~6时酶活稳定性强。通过对降解底物的特异性研究发现,该酶对EC和尿素的降解能力较为突出,底物专一性强,具有清除EC及其前体物质的能力。将此EC酶加入葡萄酒前后挥发性风味物质并无明显变化。综上所述,鲁考弗梅奇酵母所产EC酶具有一定活性和耐受性且不改变葡萄酒挥发性香气物质,为该菌株产EC的工业化生产及EC酶在后期处理葡萄酒中EC的使用提供理论借鉴,但对于EC酶降解EC的机理有待于进一步研究。
