谷氨酰胺转氨酶对荞麦分离蛋白凝胶特性的影响
2022-12-10孙乐常刘光明曹敏杰
孙乐常,王 瑜,翁 凌,刘 明,缪 松,3,5,刘光明,曹敏杰,
(1.集美大学海洋食品与生物工程学院,福建厦门 361021;2.海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁大连 116034;3.水产品深加工技术国家地方联合工程研究中心,福建厦门 361021;4.国家粮食和物资储备局科学研究院,北京 100037;5.爱尔兰农业部农业与食品发展局Teagasc食品研究中心,芒斯特科克 999014)
荞麦(Fagopyrum esculentumMoench.)是蓼科荞麦属的一种双子叶植物,多种植于内蒙古、陕西、山西、甘肃、宁夏等一些高寒地带,在我国粮食种植生产中占有重要地位。荞麦中的类黄酮、膳食纤维、肌醇、植物类固醇等生物活性物质,对癌症、高血压、动脉粥样硬化、糖尿病、高脂血症等疾病均有预防与辅助治疗作用[1]。随着社会的发展,人们的饮食结构逐渐倾向于健康、绿色、原生态的保健型食品,荞麦凭其较高的营养价值和保健功效,越发受到人们的青睐。
荞麦主要被加工成荞麦面粉用于生产面类制品,如荞麦面条、荞麦馒头等。荞麦蛋白是主要的加工副产物,占荞麦含量的16%左右[1]。荞麦蛋白中必需氨基酸组成均衡,赖氨酸丰富,含有多种维生素和磷、钙、铁等微量元素,其蛋白生物价为93.1%,远高于大豆蛋白(68.4%)和小麦蛋白(62.5%),极具开发利用价值[1]。在分离制备荞麦蛋白过程中,不同的加工方式对荞麦蛋白特性具有不同影响。米宏伟等[2]研究了加工工艺对荞麦蛋白的影响,发现超声协助提取和脱脂处理分别提高了蛋白的溶解度和乳化性,而冷冻干燥荞麦分离蛋白的持水和持油性能高于喷雾干燥处理。同时,米宏伟等[3]还研究了TGase对荞麦蛋白的影响,发现适当添加的TGase能有效提高荞麦蛋白的持水力、持油力、起泡性与乳化稳定性,但蛋白的乳化活性指数却下降了。Xue等[4]通过结合高强度超声处理与葡聚糖基化修饰对荞麦蛋白进行改性,发现相较于传统加热方式,荞麦蛋白的表面疏水性显著提高且乳化性也得到了改善。
除此之外,植物蛋白自身也具有一定的凝胶性,还能与动物肌原纤维蛋白产生良好的协同作用,提高肉糜凝胶的保水性和热稳定性,广泛应用于肉糜制品等凝胶类食品领域[5]。与动物肌肉肌原纤维蛋白凝胶不同,植物蛋白的凝胶化主要以球蛋白为主体,其凝胶能力与植物自身蛋白的结构相关,且形成的凝胶较弱,通常需要采用一定的改性方法对植物凝胶进行质构改良[6-7]。左锋等[8]研究了乙酰化改性对芸豆分离蛋白凝胶特性的影响,发现乙酰化处理增强了凝胶形成过程中蛋白质分子相互作用,显著提高了凝胶的硬度、弹性和内聚性。相对于化学法改性,通过酶法改性提升蛋白的功能特性不仅条件温和、可控,还具有更高的安全性。TGase是凝胶中常用的食品添加剂,能催化蛋白分子间的谷氨酰胺残基的γ-羧酰胺基和赖氨酸残基的ε-氨基交联形成牢固的共价键,进而提高凝胶特性[9]。Nonaka等[10]研究了TGase对热诱导大豆蛋白凝胶的物理性质的影响,发现1%TGase能够提高凝胶的硬度和凝胶强度,并在一定程度上抵抗高盐对蛋白质凝胶网络的破坏。Zhan等[11]发现TGase处理的豌豆分离蛋白乳状凝胶具有更加致密、保水性更强的内部结构。然而,不同种类的植物虽然均以球蛋白为凝胶主体,但各自的凝胶特性存在明显差异。迄今为止,围绕荞麦蛋白功能特性的研究主要集中乳化性、溶解性以及持水性等方面,而关于加工方式与TGase对荞麦蛋白凝胶特性的影响却未见报道。
本文通过碱溶酸沉的方法制备荞麦分离蛋白,分别利用喷雾干燥与冷冻干燥制备获得荞麦蛋白,并研究TGase对荞麦蛋白理化特性与凝胶特性的影响,旨在阐明荞麦蛋白凝胶化机理,以期为荞麦蛋白的开发与利用提供理论参考。
1 材料与方法
1.1 材料与仪器
荞麦 福建省厦门市集美区新华都购物超市;8-苯胺基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS) 美国Sigma公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)用标准蛋白 美国Thermo Fisher Scientific公司;考马斯亮蓝R-250 福建兴隆达公司;谷氨酰胺转氨酶 中国东恒华道生物科技有限公司;β-巯基乙醇 上海麦克林生化科技有限公司;氯化钠、尿素、磷酸氢二钠及磷酸二氢钠等 均为分析纯级。
HG-200均质机 台湾祥泰公司;pH计 德国Sartorius公司;SW23振荡恒温水浴槽 北京优莱博技术有限公司;Avanti J-26S XP高速冷冻离心机美国Beckman公司;Alpha 1-4 LDplus冷冻干燥机
德国Christ公司;Mini-PROTEAN蛋白质电泳装置 美国Bio-Rad公司;凝胶成像仪 英国Syngen公司;FP-8200荧光分光光度计 日本Jasco公司;DHR-2流变仪 美国TA仪器公司。
1.2 实验方法
1.2.1 干燥方式对荞麦分离蛋白理化特性的影响
1.2.1.1 荞麦分离蛋白制备及干燥 利用破壁机将荞麦制成荞麦粗粉,采用等电点沉淀法[2]制备分离蛋白。称取一定质量荞麦粉,加入15倍体积的蒸馏水后,将溶液的pH缓慢调节至8.0。在室温下用磁力搅拌器提取3 h,使荞麦中的蛋白质充分溶解。将悬浊液于50 ℃恒温水浴锅中加热30 min,8000×g离心20 min收集上清液。用1.0 mol/L盐酸将收集到的上清液pH调至4.5,使其靠近荞麦分离蛋白的等电点。搅拌10 min使蛋白质充分析出。离心收集沉淀,即为荞麦分离蛋白(BPI)。用少量蒸馏水将沉淀溶解,并将pH调至中性,置于4 ℃环境下贮存备用。
荞麦分离蛋白分别采用冷冻干燥及喷雾干燥的方法进行后续处理,分别命名为FBPI和SBPI,收集置于密封保鲜袋中备用。喷雾干燥工艺参数为:进风温度160 ℃,出风温度95 ℃,流速8 r/min;真空冷冻干燥工艺参数为:温度45 ℃,真空度0.63 MPa。
1.2.1.2 SDS-PAGE分析 将不同蛋白样品溶解于离子水中使蛋白终浓度为1 mg/mL。蛋白样品经过SDS化后取10 μL上样于15%的聚丙烯酰胺凝胶进行SDS-PAGE。待电泳结束后,用考马斯亮蓝R-250溶液对胶片进行染色,再用甲醇-冰乙酸溶液脱色。
1.2.1.3 二级结构 使用去离子水将不同BPI溶液稀释成0.1 mg/mL,用Chirascan圆二色谱仪进行静态扫描分析。光谱的扫描范围为200~280 nm,扫描速度为10 nm/min,比色皿光径为1 mm。
1.2.1.4 疏水性 根据许英一等[12]的方法,以ANS为荧光探针,使用荧光光谱仪进行表面疏水性测定。以0.01 mol/L磷酸盐缓冲液(pH7.5)为溶剂,分别将BPI及干燥后的蛋白粉配制成浓度为0.025、0.005、0.1 mg/mL的溶液。取2 mL样品于试管中并加入20 μL ANS溶液(8 mmol/L),混匀后避光静置20 min,测定荧光值。测试所用激发波长为390 nm,发射波长为470 nm,狭缝宽为10 nm。空白对照为磷酸盐缓冲液和ANS的混合溶液。以测得的荧光强度作为因变量,蛋白浓度作为自变量,绘制曲线,分别计算曲线初始阶段的斜率,即为所求的H0。蛋白浓度用Bradford法[13]进行测定。
1.2.1.5 内源性荧光 将样品溶于0.01 mol/L 磷酸盐缓冲液(pH7.5)中并将浓度调整为0.1 mg/mL。利用荧光分光光度计测定样品的FI,并将结果进行平滑处理优化。测试所用激发波长为295 nm,发射波长为300~500 nm,狭缝宽2.5 nm。
1.2.1.6 溶解度 溶解度测定参考Latorres等[14]的方法并做适当修改。配制pH分别为2.0、4.0、7.0与10.0的0.1 mg/mL的蛋白溶液,在低温环境下搅拌30 min使其充分溶解,经7500×g离心15 min后,通过Lowry法测定上清液和全蛋白含量。全蛋白含量用可溶化液(20 mmol/L PBS,2% SDS,8 mol/L Urea,pH8.0)充分溶解后的样品中所含的蛋白含量表示。溶解度计算公式如下:

1.2.1.7 持水力 不同干燥方式的分离蛋白持水力的测定参考李明娟等[15]的方法并作一定的修改。称取0.5 g的分离蛋白置于离心管中,总重为m1。加入5 mL的蒸馏水,混匀后室温静置30 min。静置后的样品经3000×g离心10 min,去除水层,离心管总重记为m2。持水力计算公式如下:
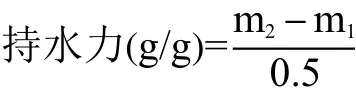
1.2.2 TGase对荞麦分离蛋白凝胶特性的影响
1.2.2.1 蛋白凝胶制备 将冷冻干燥和喷雾干燥制备的荞麦蛋白分别溶于去离子水中配成浓度为20%的溶液,记为F-G和S-G。TG组的样品为含1:100(蛋白粉:酶,w/w)TGase的20%荞麦蛋白溶液,记为F+TG-G和S+TG-G,室温下用磁力搅拌器充分搅拌2 h。从各个样品中取一部分在90 ℃加热25 min,然后立即在冰水混合物中冷却待用。
1.2.2.2 粒径与电位 通过Zetasizer Nano ZS90测量BPI和未加热样品溶液的粒径和电位。样品使用10 mmol/L的磷酸盐缓冲液(pH7.5)稀释为0.5 mol/L,以避免在测量过程中发生多次散射。在25 ℃下对每个样品进行多次重复测量取平均值。
1.2.2.3 动态温度扫描 取适量蛋白溶液于流变仪平板上,所选夹具为40 mm平板,样品与夹具缝隙处滴加一层硅油,防止加热过程中样品水分挥发。25 ℃平衡180 s,温度范围为25~90 ℃,加热速率为2 ℃/min,频率1 Hz,应变振幅为1%,在样品的线性黏弹性区域范围内。记录每个样品的储能模量(G')和耗能模量(G'')。
1.2.2.4 频率扫描 取适量蛋白溶液于流变仪平板上,所选夹具为40 mm平板,样品与夹具缝隙处滴加一层硅油,防止加热过程中样品水分挥发。先在90 ℃加热25 min,随后恢复室温25 ℃。扫描频率范围为0.01~10 Hz,应变振幅为1%,在样品的线性黏弹性区域范围内。记录每个样品的储能模量(G')和耗能模量(G'')。
1.2.2.5 化学键 荞麦凝胶化学键测定参考胡曼子等[16]的方法,采用以下不同的反应溶液对凝胶进行处理:SA,0.05 mol/L NaCl;SB,0.6 mol/L NaCl;SC,0.6 mol/L NaCl+1.5 mol/L尿素;SD,0.6 mol/L NaCl+8 mol/L尿素;SE,0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/Lβ-巯基乙醇。将2 g凝胶加入以上溶液10 mL并在匀浆机均质30 s。均匀分散的混合物在摇床上以220 r/min在室温下振荡2 h,然后在10000×g离心10 min。取20 mL适当稀释的样品加入50 mL Bradford试剂在室温下反应5 min,测定412 nm处的吸光度。SB与SA的差值为离子键;SC与SB的差值为氢键;SD与SC之间的差值为疏水相互作用;SE和SD之间的差值为二硫键。
1.3 数据处理
所有数据重复三次取平均值,并以均数±标准差计算。采用SPSS19.0软件(SPSS,Chicago,IL,USA)进行统计分析,采用Duncan多重比较差异显著性(P<0.05)。
2 结果与分析
2.1 干燥方式对荞麦分离蛋白理化特性的影响
2.1.1 SDS-PAGE分析 图1为荞麦分离蛋白的蛋白质组成,主要由分子量为60 kDa左右的13S球蛋白亚基和17 kDa的2S清蛋白组成[17]。荞麦13S球蛋白分子量由 6 个亚基组成,可以看出13S球蛋白为提取的荞麦分离蛋白的主要组成部分。在还原条件下,荞麦分离蛋白中的13S球蛋白亚基会断裂为分子量为32~36 kDa的酸性多肽和22 kDa的碱性多肽,证明其是通过二硫键连接组成球蛋白大分子[17]。相比于冷冻干燥蛋白,喷雾干燥的荞麦蛋白在非还原条件下13S球蛋白亚基条带发生降解,同时
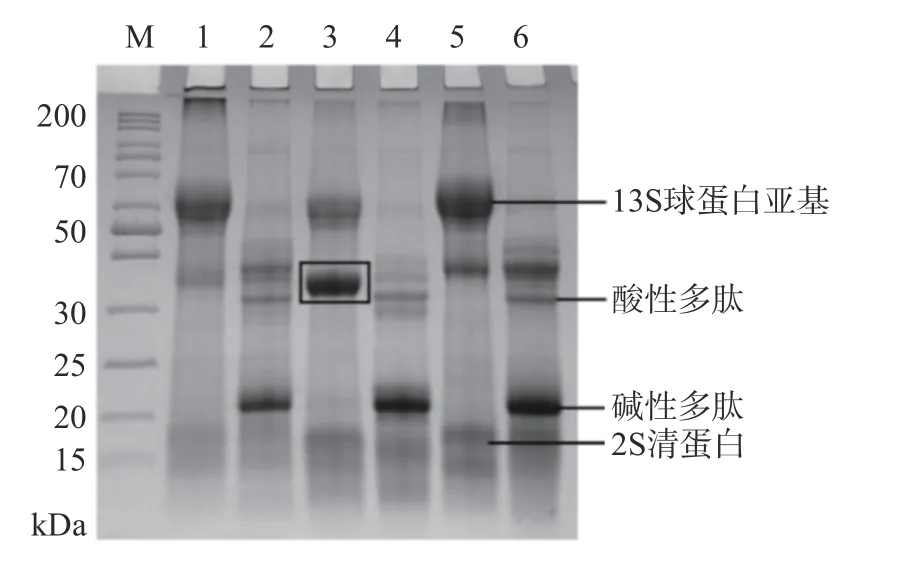
图1 荞麦分离蛋白的蛋白质组成Fig.1 Protein of buckwheat protein isolates
产生了一个分子量大约为35 kDa的新条带,这可能是由于喷雾干燥过程中的热处理使一部分13S球蛋白亚基的二硫键断开,同时受热使得含有巯基的蛋白内部重新组合连接,因而产生了35 kDa的新条带。
2.1.2 二级结构 圆二色光谱可以在较接近蛋白质生理状态的液体环境中测定蛋白质二级结构,已广泛应用于蛋白质的构象研究[18]。圆二色性在远紫外区(185~245 nm)的吸收信号来自于肽键,可以反映主链的构象,表征蛋白质的二级结构[18]。干燥过程中的一些物理条件,如喷雾干燥过程中的雾化和瞬时高温,以及冷冻干燥过程中的冻结和升华,都有可能使蛋白质产生构象变化,改变蛋白质分子的二级结构[19]。如图2所示,两种干燥蛋白在195~220 nm波长处均有负峰,在206 nm处出现正峰,分别代表了蛋白质的α-螺旋与β-转角结构[20]。α-螺旋结构表现蛋白质分子结构的有序性,而其他结构如β-转角、无规卷曲等则反映了蛋白质分子的松散、不规则性[21]。结合表1可知,BPI的α-螺旋、β-转角、无规卷曲含量分别为25.80%、18.50%、36.80%。相比于BPI,FBPI和SBPI的α-螺旋含量减小至22.10%和20.00%,β-转角的含量增至19.40%和19.80%,无规卷曲含量增至40.50%和43.80%,分子结构的有序性降低。FBPI在冷冻干燥过程中由于水分的升华使各溶质组分浓缩,体系中离子浓度的增加,进而可能使蛋白质分子部分变性,其二级结构发生改变[22]。相比之下,SBPI在喷雾干燥中的瞬时高温则会使荞麦蛋白中热敏感蛋白发生变性,使其中的部分α-螺旋与β-折叠结构发生了改变,形成了新的β-转角结构,蛋白从有规则的结构向无规则结构转化。闫洁等[23]在研究大豆蛋白时也发现了类似现象,通过红外光谱研究喷雾干燥和冷冻干燥大豆蛋白的二级结构,发现两种干燥方式均造成了β-折叠和无规卷曲的降低以及β-转角含量的大幅上升,其中冷冻干燥由于对大豆蛋白二级结构的破坏较小,蛋白还具有良好的凝胶能力,而喷雾干燥使大豆蛋白过度变性从而失去凝胶能力。
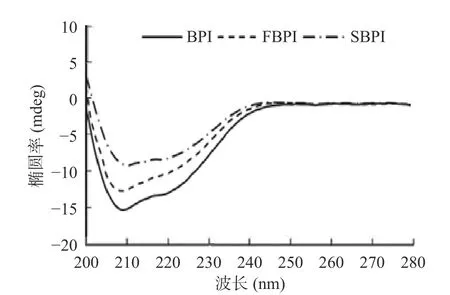
图2 荞麦分离蛋白的圆二色光谱Fig.2 Circular dichroism spectrum of buckwheat protein isolates

表1 荞麦分离蛋白的二级结构含量(%)Table 1 Secondary structure content of buckwheat protein isolates (%)
2.1.3 疏水性与内源荧光性 疏水性探针ANS能够通过静电相互作用与蛋白质暴露的疏水区域结合,使结合区域的荧光强度显著增加,其荧光值可以反映蛋白质分子表面疏水性[24]。如图3所示,BPI的表面疏水性指数为242.94,干燥处理后FBPI和SBPI的疏水性指数分别增至269.02和309.05。冷冻干燥的蛋白样品由于长时间暴露在中等高温下(冷冻干燥过程中的二次干燥)会发生冷变性,导致包埋在内部的疏水性区域暴露,表面疏水性增加[25]。SBPI的表面疏水性较大,这可能是由于在喷雾干燥过程中,瞬时的高温干燥给分离蛋白带来了不可逆的结构破坏,使更多的非极性基团暴露在蛋白质表面,导致疏水性较高。邓芝串等[26]发现喷雾干燥籽瓜种子蛋白的表面疏水性大于冷冻干燥,与本实验的结果一致。
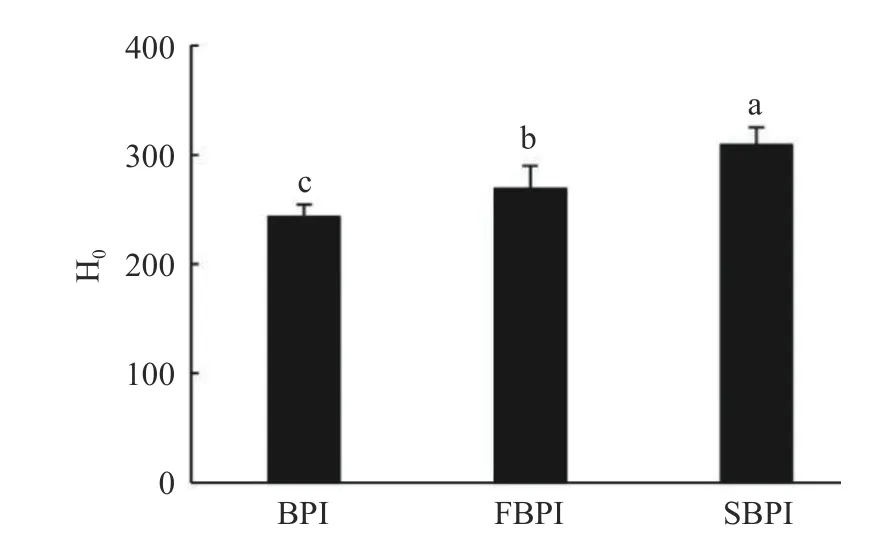
图3 荞麦分离蛋白表面疏水性Fig.3 Surface hydrophobicity of buckwheat protein isolates
如图4所示,FBPI和SBPI的内源性荧光强度大于BPI。冷冻干燥直接将荞麦分离蛋白中的水由固态升华脱出,在此过程中蛋白会因离子强度的改变发生冷变性,导致芳香性氨基酸残基暴露;除此之外,冷冻干燥样品内部结构较为疏松,避免了侧链的芳香族氨基酸残基被掩埋,内源性荧光增加[15]。经过喷雾干燥的分离蛋白由于高温变性的影响,将使埋藏在内部的原有芳香族氨基酸残基暴露,也会使内源性荧光增强。
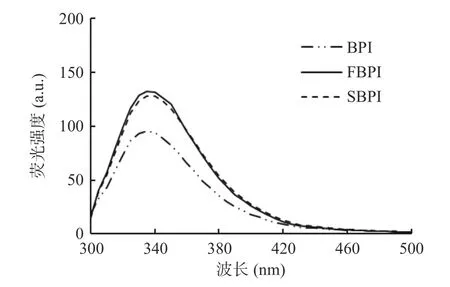
图4 荞麦分离蛋白内源性荧光Fig.4 Endogenous fluorescence of buckwheat protein isolates
2.1.4 溶解性与持水力 如图5所示,FBPI和SBPI的溶解度均在pH4处有最小值,为54.01%和46.90%,在pH10处有最大值,溶解度分别为84.92%和81.96%。pH4接近荞麦分离蛋白等电点,此时蛋白质的净电荷接近零,分子间的静电斥力减小,蛋白质容易产生聚集沉淀,进而溶解度降低;远离等电点时,蛋白中所带的净电荷增加,分子间的静电斥力增加,溶解度升高[27]。与SBPI组相比,FBPI在各pH溶液中溶解性更好,这可能是由于SBPI较高的表面疏水性(图3)导致的。此外,胡方洋等[28]研究了不同干燥方式对苦荞蛋白功能性质的影响,发现冷冻干燥样品蛋白质样品疏松的内部结构,能够更好地与水形成氢键作用,进而使溶解度增大。另一方面,喷雾干燥还会使蛋白表面形成高抗湿薄膜[29],会阻碍水分子进入蛋白分子内部,这可能也是本实验中SBPI溶解性较差的原因。

图5 荞麦分离蛋白的溶解性Fig.5 Solubility of buckwheat protein isolates
蛋白的持水性反映了蛋白质与水的结合能力,能较好地反映蛋白的凝胶性,结果如图6所示。FBPI和SBPI在pH7.0时持水性最强,分别为3.93和3.18 g/g,此时蛋白拥有较好的与水结合的能力。在pH4.0时荞麦蛋白趋于沉淀状态,持水性较低。当pH为10.0时,荞麦蛋白发生部分变性,损害了蛋白本身与水的结合能力,持水性最差,FBPI和SBPI的持水性降至2.77和1.94 g/g。荞麦分离蛋白在不同pH下的持水性为pH7.0>pH2.0>pH>4.0>pH10.0。FBPI的持水性显著(P<0.05)高于SBPI,表明FBPI在凝胶体系中具有更好的锁水作用。蛋白的持水性与其蛋白本身的表面疏水性呈负相关性,本结果也与图3中的结果一致。此外,FBPI疏松多孔的结构也在一定程度上增大了与水接触的有效面积,有利于蛋白与水的相互作用[30]。而相反地,喷雾干燥使蛋白粉表面形成的高抗湿度薄膜却阻碍了水分子与蛋白的接触。邓芝串等[26]在籽瓜种子蛋白中发现了相同的现象,即冷冻干燥处理的蛋白质样品的持水性优于喷雾干燥,推测可能与冷冻干燥后的蛋白质的体积密度小,与水接触时的有效面积增大有关。
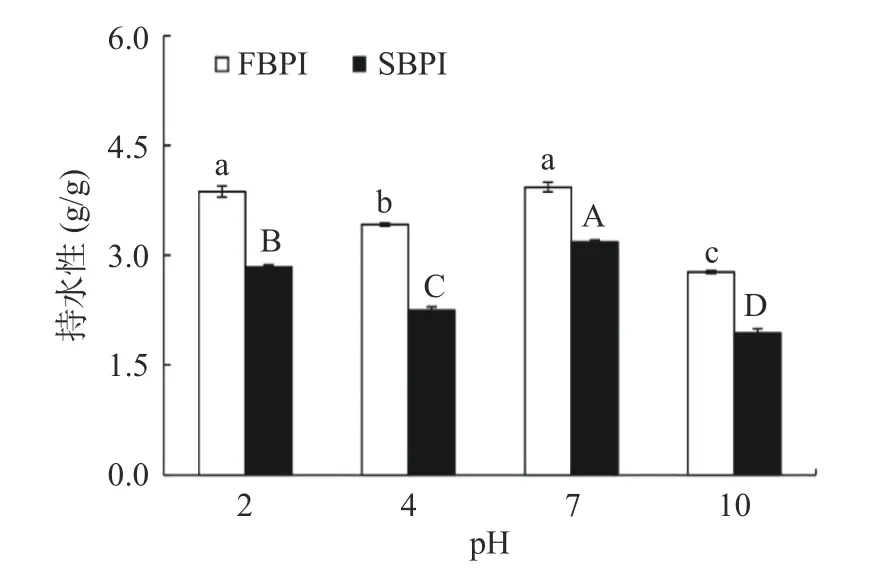
图6 荞麦分离蛋白的持水性Fig.6 Water holding capacity of buckwheat protein isolates
2.2 TGase对荞麦分离蛋白凝胶特性的影响
2.2.1 粒径与电位 如图7与表2所示,SBPI在溶液中颗粒平均直径为192.55 nm,小于BPI(196.35 nm)。FBPI颗粒平均直径为213.01%,略大于BPI且粒径分布与BPI相似。PDI表示粉体粒径大小的均匀程度,PDI越小粉体颗粒分布越均匀[31]。SBPI的PDI(0.26)显著(P<0.05)小于BPI(0.35)与FBPI(0.38),表明SBPI颗粒均匀程度要大于FBPI,这可能是由于荞麦蛋白在冷冻干燥中会冻结形成大小不一的固体骨架,当水分升华后固体骨架基本保持不变,因此颗粒粒径分布相对不均匀。李明娟等[15]对不同干燥技术处理的核桃粕蛋白粉的比表面积和跨度值进行分析,发现喷雾干燥制备的核桃粕蛋白粉体粒径最小且大小分布均匀,与本实验结果类似。添加TGase后,荞麦蛋白在溶液中的平均直径有了大幅度提升,F+TG-G组和S+TG-G组的平均粒径分别增至2289.01与1439.67 nm,说明TGase催化蛋白质交联形成大分子。TGase交联的FBPI的平均直径要远大于S+TG-G组的平均直径,这可能是由FBPI和SBPI自身平均直径决定的,平均直径大的蛋白质在TGase的催化交联下会产生更大直径的聚体。
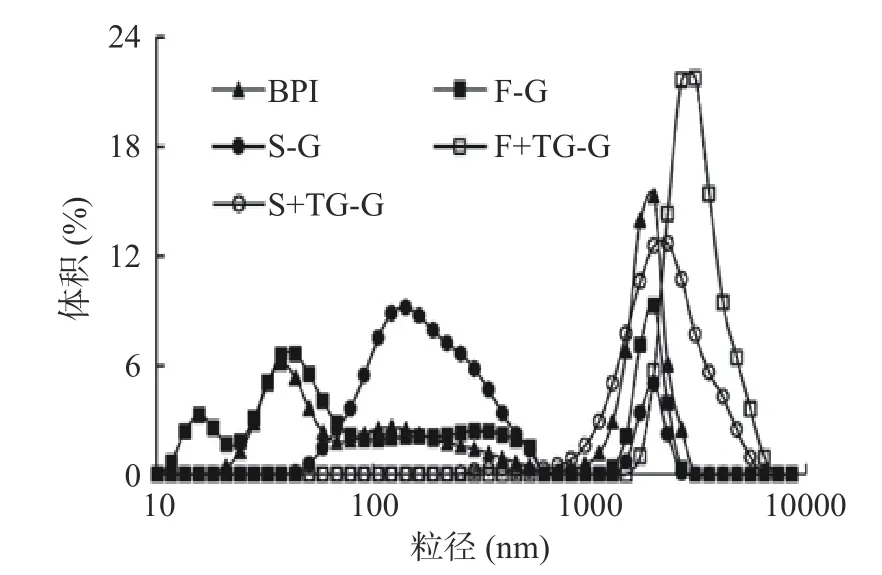
图7 荞麦分离蛋白的粒径Fig.7 Particle size of buckwheat protein isolates
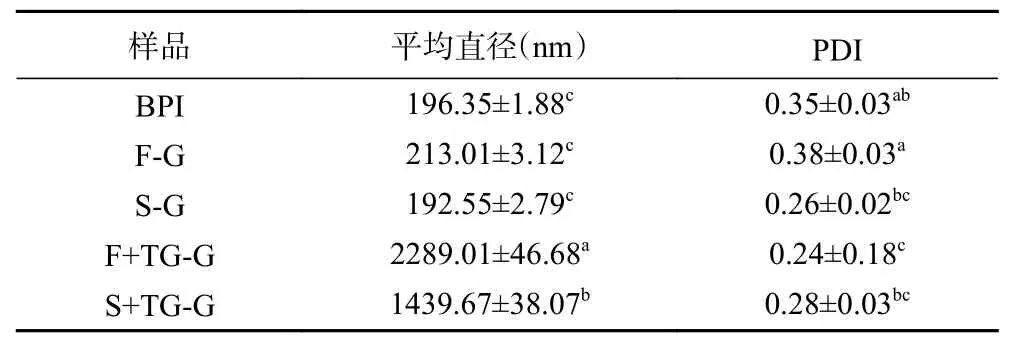
表2 荞麦分离蛋白凝胶溶液中蛋白质的平均直径Table 2 Average diameter of proteins in buckwheat protein isolate gel solution
蛋白质以胶体颗粒形式分散在溶剂中,胶体颗粒之间的静电斥力可以在一定程度上抑制蛋白胶体颗粒的聚集,是维持胶体分散性和稳定性的重要作用力。Zeta电位可以表征胶体颗粒表面的净电荷的符号及数目,Zeta电位愈高,说明蛋白质表面所带的电荷越多,蛋白胶体颗粒之间的静电斥力越大,蛋白在溶剂中的稳定性越强。水相中胶体颗粒分散稳定性的分界线一般认为在+30或-30 mV[32]。如图8所示,BPI的Zeta电位为-15.93 mV,FBPI和SBPI的Zeta电位分别为-29.43和-29.35 mV,表明冷冻干燥和喷雾干燥两种处理均使蛋白胶体颗粒之间的静电斥力增强,荞麦蛋白颗粒分散体系相对稳定性较高。大量同性电荷间的相互排斥会降低蛋白分子间聚集现象发生,从而减少疏水基团被掩埋,使疏水基团更多的暴露在分子表面,导致蛋白质表面疏水性增加[33]。此结果与上文中测得的表面疏水性结果一致。干燥处理使分离蛋白在水相中的分散稳定性和表面疏水性增强,可能会对蛋白凝胶形成产生一定程度上积极的影响。加入1% TGase之后,胶体颗粒溶液的Zeta电位与干燥处理的蛋白质胶体没有显著性差异(P>0.05),F+TG-G组(-28.80 mV)与S+TGG组(-29.17 mV)之间的Zeta电位没有显著性差异(P>0.05),说明TGase的加入不会显著影响溶液体系的稳定性。
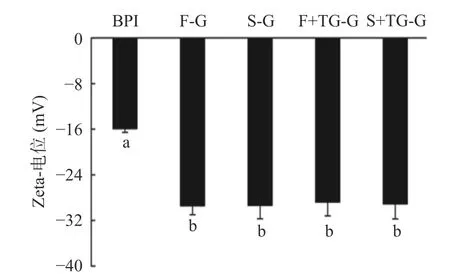
图8 荞麦分离蛋白的Zeta电位Fig.8 Zeta potential of buckwheat protein isolates
2.2.2 动态温度扫描 储能模量(G')表示物质的弹性行为,会影响凝胶的网络结构;损耗模量(G'')表示物质的粘性行为,对凝胶网络结构没有影响;tanδ则代表了蛋白质网络形成的类型,数值越小表示形成的三维凝胶网络越好[34]。如图9所示,荞麦分离蛋白质溶液在25~45 ℃下tanδ<1,体系为溶胶状态;随着温度进一步增高至45~75 ℃,G'急剧下降甚至低于G'',tanδ增加。由此可以推测,当温度加热到45 ℃,原本聚合的荞麦蛋白质分子内部在温度的作用下发生重排,整个体系流动性增加,粘性行为占主导,凝胶结构被破坏。当温度升高到75~95 ℃阶段时,除BPI与F-G之外,其他3组样品的G′均出现上升趋势,且tanδ值逐渐减小,这可能是由于球蛋白受热伸展,内部包埋在卷曲分子链内部的功能基团如疏水基团、巯基等暴露出来,蛋白质-蛋白质相互作用增强,进而形成了更为稳定的三维凝胶网络结构。
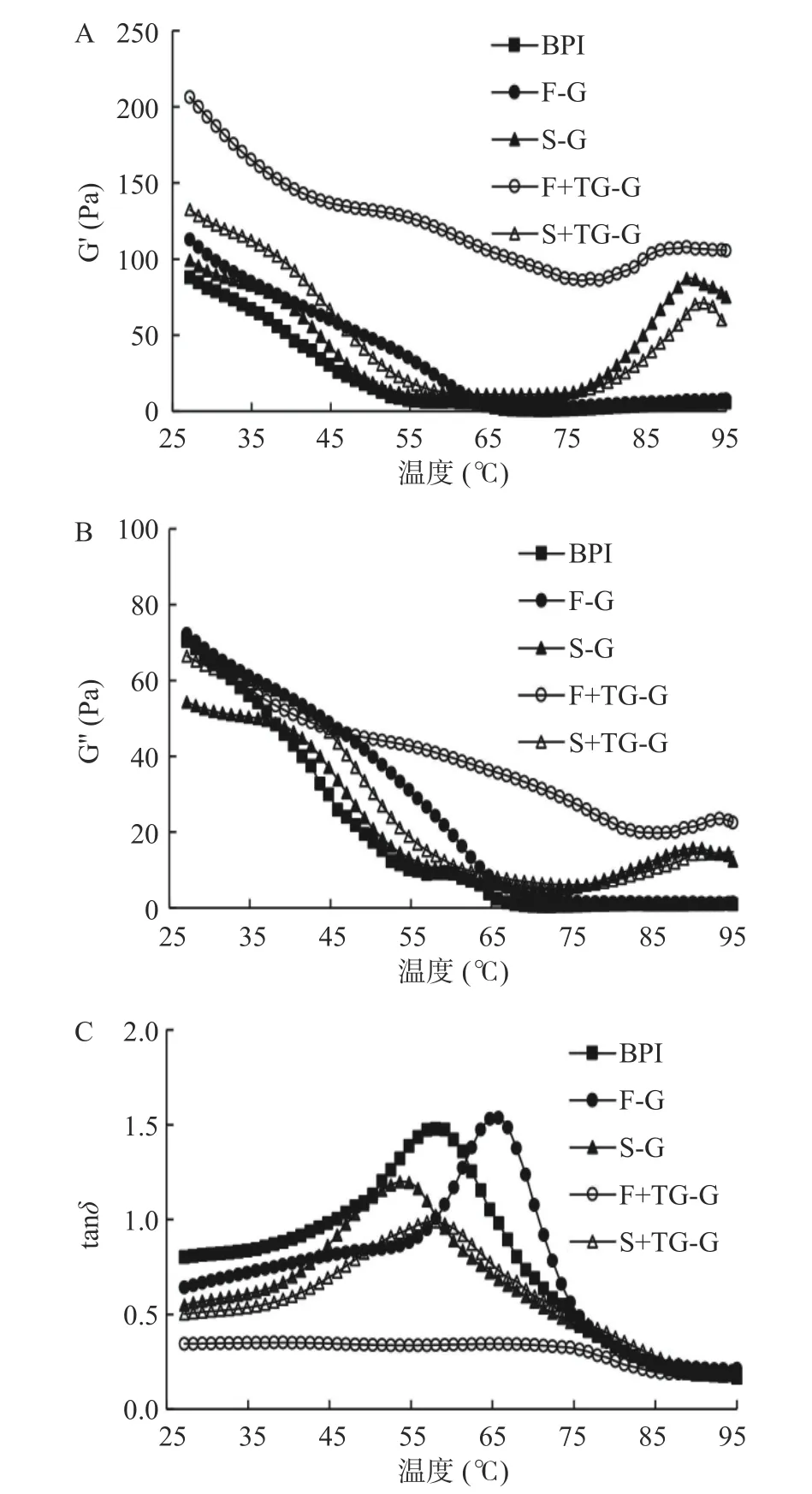
图9 荞麦分离蛋白凝胶的动态温度扫描Fig.9 Dynamic temperature scanning of buckwheat protein isolate gel
BPI和F-G在较高温度(65~95 ℃)时G'最低,弹性行为相对较弱。这是因为一定浓度的植物天然蛋白虽然能在低温条件下通过氢键、范德华力等作用形成弱凝胶,而高温加热会破坏键能较弱的氢键作用,从而破坏了凝胶结构[34-35]。FBPI在冷冻干燥中的低温升华导致变性蛋白的数目较少,其凝胶行为与BPI较为相似。Vliet等[35]发现通过流变学方法研究大豆分离蛋白的热凝胶行为时,也发现在初次加热过程中大豆分离蛋白的储能模量极低,这与本实验的结果一致。Renkema等[7]以大豆分离蛋白纯化得到的11S球蛋白和β-伴球蛋白为对象,研究了不同pH对大豆分离蛋白凝胶的影响,发现11S球蛋白和β-伴球蛋白的凝胶遵循Percolation模型规律,即自然条件下蛋白质在凝胶点的时候并没有连接在一起,蛋白质在加热过程中持续变性导致分子呈分散状态。此外,短时高温加热使BPI和F-G中部分热敏蛋白发生变性凝集,阻碍在蛋白质分子在凝胶网络结构有序排列,也可能导致BPI和F-G的G'值降低。
添加TGase后,F+TG-G的G'呈现出上升的趋势,体系在整个加热过程中表现出明显的弹性行为,而S+TG-G的G'值无显著变化。F+TG-G组的G'较S+TG-G组出现大幅度增强,tanδ的峰值消失,表明TGase促进了冷冻干燥的蛋白质样品内部的交联,进而形成更稳定的三维凝胶网络结构,抵抗了温度对于体系凝胶化的不良影响。Zhang等[9]通过预热-TGase处理大豆蛋白凝胶也发现了TGase添加使G'出现上升的趋势。而S+TG-G组中SBPI蛋白分子内部的β-转角含量较高,其大量的无规则结构影响了TGase催化的大分子之间的交联效果,因此凝胶体系的弹性模量较低。
2.2.3 凝胶频率扫描 分离蛋白在90 ℃加热25 min后冷却至25 ℃制备凝胶,其频率扫描结果如图10所示。在0.01~10 Hz范围内,随着频率的增加,样品的G'和G''都呈现出增加的趋势,五个样品的G'、G''的变化基本趋向一致,样品的G'依次为F+TGG>F-G>S+TG-G>S-G>BPI。所有样品的G'始终大于G'',tanδ<1,形成以弹性行为为主导的凝胶体系,其中除F+TG-G组外的所有样品组tanδ值随着频率增大而逐渐减小并趋向稳定。BPI的G'较低,可能是因为较低的表面疏水性影响了其在冷却过程中凝胶结构的形成。此外,虽然F-G组在图9中G'出现下降的趋势,但在频率扫描的结果中G'较大,表明形成了较稳定的凝胶结构,推测可能是凝胶冷却过程中FBPI重新通过氢键作用形成凝胶。曹连鹏等[36]在研究酸诱导大豆蛋白凝胶形成时,也发现加热后冷却静置有利于氢键和范德华力的形成,进而使凝胶强度进一步增强。此外,FBPI经冷冻干燥的低温处理和瞬时升华作用使疏水基团暴露,较大的蛋白颗粒随着频率的增加更易发生分子重排、缠绕聚集,形成较强的凝胶结构。而喷雾干燥使处理后的分离蛋白受热变性聚集形成较小颗粒,限制了分子链之间的缠绕,对凝胶结构形成产生一定的负面影响。刘丽莉等[37]研究了干燥方式对卵白蛋白和卵黏蛋白互作的影响,发现在高频区冷冻干燥复合蛋白体系的G'大于喷雾干燥,这与本文的结果一致。加入TGase后,两种干燥方式下的荞麦蛋白的G'值均显著提升,F+TG-G组凝胶G'大于S+TG-G。TGase的加入会使体系产生分子内或分子间的酰基共价交联,进一步促进了分离蛋白分子之间纠结缠绕,表现出更强的弹性行为。Nonaka等[10]在研究TGase对大豆蛋白热诱导凝胶改良作用时,发现0.5%及1% TGase能够显著提高蛋白凝胶网络的凝胶强度。F+TG-G组的tanδ值随频率增大变化不明显,且整个过程均在0.3以下,表明该样品体系均是以弹性行为为主导的稳定凝胶网络结构,且凝胶稳定性最强。
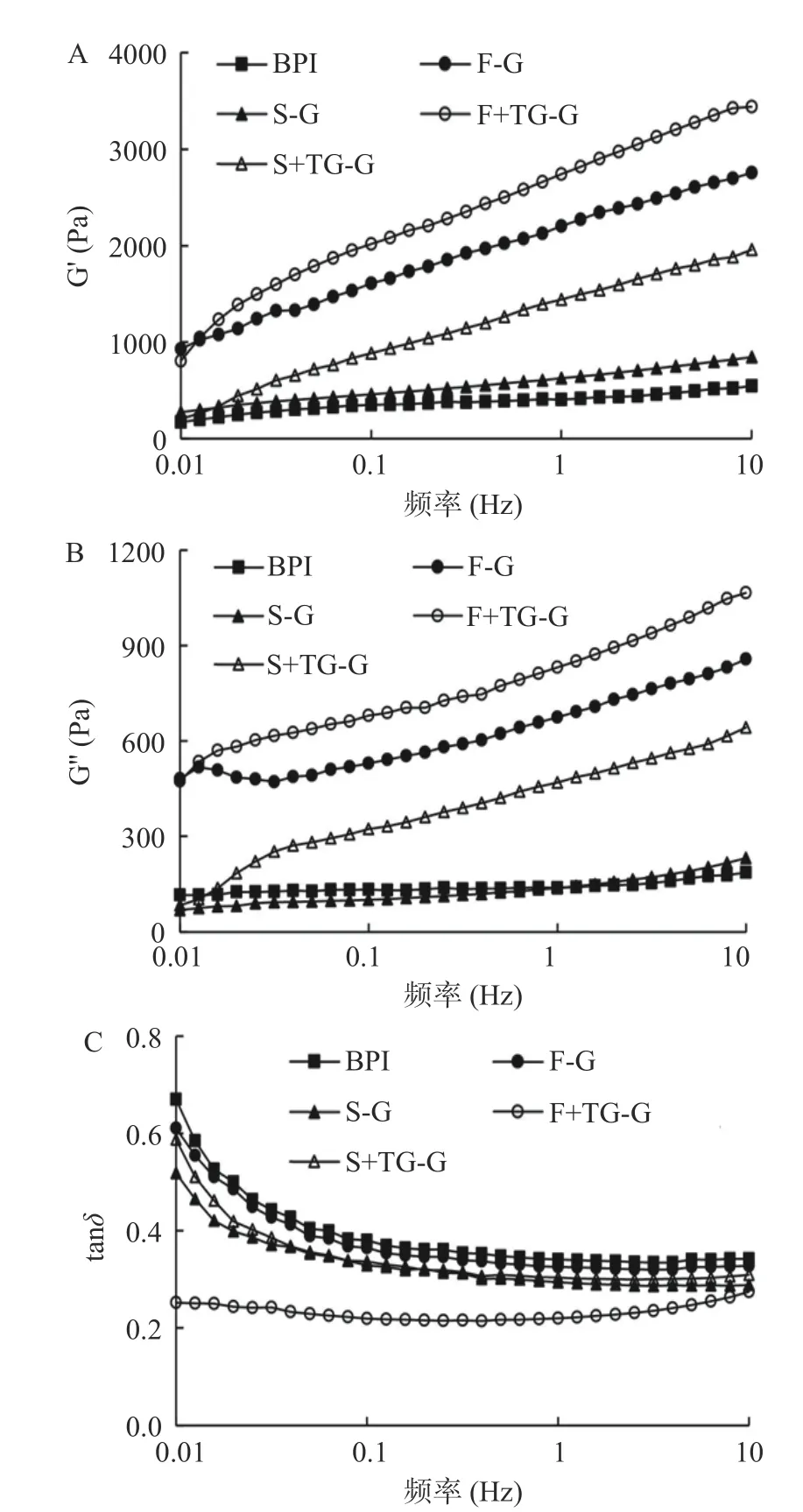
图10 荞麦分离蛋白凝胶的频率扫描Fig.10 Sweep frequency of buckwheat protein isolate gel
2.2.4 凝胶的分子间作用力分析 植物球状蛋白在热凝胶时,首先在常温下充分溶胀形成溶胶,此时蛋白质分子结构呈现紧密的卷曲状态;当温度达到蛋白的变性温度时,蛋白质发生变性使体系的粘度上升,分子结构开始伸展;当温度继续增加时,蛋白质结构充分展开,功能基团暴露,并在随后的冷却过程中蛋白分子间通过二硫键和氢键、静电引力、疏水相互作用及范德华力等非共价键相互作用,形成三维网络结构并将水分包裹在内形成凝胶[6,38]。
如图11所示,荞麦分离蛋白凝胶的重要作用力为疏水相互作用和二硫键。FBPI的氢键和疏水相互作用较大,但分子间离子键和二硫键小于SBPI。蛋白质在喷雾干燥热处理过程中会吸收能量导致氢键断裂,此时三级结构受到破坏形成无序状态,β-转角的含量会相应升高[39]。SBPI的共价二硫键强于FBPI,可能是由于喷雾干燥过程中高温处理促进了二硫键的形成。田少君等[39]研究了不同干燥方式对星油藤分离蛋白结构的影响,发现与冷冻干燥相比,喷雾干燥更大程度地促进了巯基的暴露和二硫键的形成。
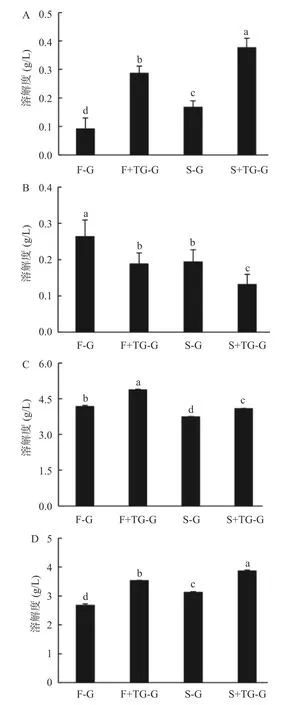
图11 荞麦分离蛋白凝胶的分子间作用力Fig.11 Intermolecular forces of buckwheat protein isolate gels
加入TGase后,分离蛋白凝胶中氢键被破坏,离子键、疏水相互作用及二硫键增强。氢键含量的下降可能与TGase催化了原本可以提供氢键的谷氨酰胺和赖氨酸残基形成了共价交联有关。此外,TGase催化产生分子间共价交联也会造成荞麦蛋白分子的高结合能和空间位阻效应,进而破坏了一部分蛋白质分子间及蛋白质与水分子间的氢键,可能也会导致分离蛋白凝胶分子间氢键含量的下降[40]。凝胶体系的离子键增强是由于一定浓度的TGase还能催化谷氨酰胺残基的γ-羧酰胺基团脱胺转变为谷氨酸残基,进而使体系中的离子强度升高,分子间的离子键作用增强[41]。王莹[42]也发现当TGase的添加量较高时,核桃蛋白凝胶分子间的离子键出现增加的趋势。TGase添加下疏水作用的增强可能是由于TGase催化产生的蛋白质分子内和分子间的共价交联,使蛋白质的空间结构发生改变,原本折叠在内部的疏水位点暴露,进而形成更多的疏水作用,同时蛋白质折叠的效应使部分游离巯基在空间上更接近,也更利于二硫键的形成[43]。
S+TG-G组的二硫键显著(P<0.05)高于F+TGG组(图11),但储能模量更低,表明虽然化学键测定中显示添加TGase的荞麦蛋白凝胶形成的主要作用力是二硫键、疏水作用,但共价二硫键与凝胶的强弱无直接关联。Gosal等[38]研究球状蛋白凝胶结构时发现疏水作用是稳定热诱导凝胶的关键作用力。Koseki等[44]在研究盐对卵清蛋白热变性物化性质影响时,发现二硫键不能当作起始凝胶网络的骨架,但可以在一定程度上维持凝胶网络结构,提高凝胶稳定性。此外,TGase催化荞麦蛋白分子间的共价交联对凝胶网络的形成也起到关键作用。秦新生[43]研究了超高压对TGase促大豆与小麦蛋白凝胶的分子间作用力的影响,发现TGase形成的凝胶三维网络中主要的作用力是ε-(γ-谷氨酰胺)赖氨酸共价键,且疏水相互作用在TGase诱导的混合蛋白凝胶形成中起着重要作用,这与本实验的结果一致。
3 结论
本实验围绕不同干燥方式对荞麦蛋白的理化性质展开研究,同时探讨了TGase对两种荞麦蛋白凝胶特性的影响。对干燥处理及未经干燥处理的荞麦蛋白理化性质进行比较,发现喷雾干燥荞麦分离蛋白的具有更高的表面疏水性和更均匀的粒径;冷冻干燥制备得到的荞麦蛋白相较于喷雾干燥其溶解性和持水性更好,蛋白平均粒径与分布与未经干燥处理荞麦蛋白无显著差异。加入TGase后,冷冻干燥荞麦分离蛋白和喷雾干燥荞麦分离蛋白的平均粒径分别由213.01与192.55 nm增加至2289.01与1439.67 nm,表明发生了蛋白分子间的交联反应。
冷冻干燥分离蛋白凝胶经加热冷却后的储能模量更高,但在加热过程中容易受到温度的影响。TGase的加入能显著(P<0.05)促进冷冻干燥荞麦蛋白分子间疏水作用与二硫键的形成,进而有效增强了凝胶性与凝胶网络的稳定性。相比之下,喷雾干燥荞麦蛋白即使在TGase作用下依旧未能得到较好的凝胶,这与喷雾干燥过程蛋白发生的热变性有关。本研究的结果也表明疏水相互作用、二硫键以及TGase催化的共价交联是荞麦分离蛋白凝胶形成的主要化学作用力,其中二硫键与凝胶的强弱无直接关联,但可以在一定程度上起到稳定凝胶体系的作用。
本研究结果可为荞麦分离蛋白工业制备及其作为蛋白配料在食品(肉糜、饮料、面制品等)中的应用提供一定理论参考。
