2~4 岁孤独症谱系障男童的脑磁共振扩散峰度成像研究
2022-12-10孙永兵赵鑫邢庆娜李双宇张小安
孙永兵,赵鑫,邢庆娜,李双宇,张小安
(郑州大学第三附属医院放射科,河南 郑州 450000)
孤独症谱系障碍(Autism spectrum disorder,ASD)是一种以沟通能力缺陷、社交障碍及重复刻板的行为和兴趣等为主要临床症状的广泛脑发育障碍性疾病[1]。根据美国权威机构最新调查数据显示,估计每54 名8 岁以内儿童中会有1 名儿童患有ASD,且男孩患病率高于女孩[2]。国内尚无大规模全国性流行病学调查数据,我国一项Meta 分析显示,中国大陆儿童ASD 的患病率为11.8/10 000[3],孤独症的发病率呈逐年上升的趋势。全面发育迟缓(Global developmental delay,GDD)儿童与ASD 儿童的临床症状存在多项重合,目前,ASD 的诊断主要依靠临床量表评估,且常在2 岁后可明确诊断[4]。2 岁后确诊的ASD 男童脑部结构的特点如何值得探索。磁共振弥散峰度成像(Diffusional kurtosis imaging,DKI)是在扩散张量成像的基础上发展而来的,旨在通过引入峰度值指标作为反映组织异质性的标志来检测组织非高斯扩散行为[5]。本研究利用DKI 技术评估2~4 岁ASD 男童部分脑区的结构改变,目的是探寻ASD 男童脑结构改变的证据,并将其与患儿的临床神经心理评分进行关联,探索ASD的病理生理机制。
1 资料和方法
1.1 一般资料
回顾性分析2020 年1 月—2021 年6 月在郑州大学第三附属医院儿童保健科首次确诊为ASD 的22 例男童的资料,将20 例年龄、性别、出生体质量、出生孕周和发育商(DQ)相匹配的GDD 男童作为对照组。
ASD 组纳入标准:①符合精神障碍诊断与统计手册第5 版(DSM-5)中ASD 的诊断标准[6];②儿童孤独症评定量表(The childhood autism rating scale,CARS)得分≥30 分;③年龄24~48月,男性;④无惊厥或头部外伤史、无精神疾病史、无精神药物治疗史、无神经系统疾病家族史等;⑤MRI 常规扫描未发现有局灶性或弥漫性脑内疾病。排除标准:明显出生缺陷或有任何磁共振检查禁忌症患儿。
GDD 组纳入标准:①符合DSM-5 中GDD 的诊断标准[6];②≥2 个发育维度的发育商(Developmental quotient,DQ)<70 分;③无法确切评估病情的严重程度,系统性智力测验无法评估[7]。排除标准:除外孤独症、精神发育迟缓、明显出生缺陷或有任何遗传综合征、系统性疾病、颅脑外伤史等患儿。
所有儿童均在接受治疗前完成了磁共振成像采集和一系列其他临床评估。本研究通过本院伦理委员会审核并批准,所有研究对象监护人均同意参与研究并签署知情同意书。
1.2 方法
1.2.1 研究工具
①一般资料:选用自制调查问卷,包括儿童个人基本信息,父母生育年龄、职业、身高、文化程度,母孕史及出生史等。②DSM-5[6]主要包括A、B、C、D、E 5项,其中A 项评估社会沟通及社会交往的缺陷;B项为重复的、局限的刻板行为;C 项强调上述症状在发育早期就存在;D 项强调上述症状对患者的社交、职业等方面产生了显著的障碍;E 项强调此症状无法用智力发育障碍或GDD 来解释。其中A 项符合3个 条目,B项符合2个条目,C、D、E3项回答为“是”,考虑ASD诊断。③CARS 量表[8]具有良好的信度及效度,Cronbach’s 系数为0.781。由15 项内容组成,每项按1~4 级评分,总分<30 分初步判断为无孤独症;30~<37 分诊断为轻到中度孤独症;37~60 分并至少有5 项评分高于3 分诊断为重度孤独症。④Gesell量表[9]包括5 个能区,分别为适应性行为(DQ1)、大运动(DQ2)、精细动作(DQ3)、语言(DQ4)个人社交行为(DQ5),由DQ 表示各能区发育水平。DQ>85 分表示发育正常,>75~85 分表示边缘状态,>55~75 分表示轻度迟缓,>40~55 分表示中度迟缓,>25~40 分表示中度迟缓,≤25 分表示极重度迟缓。
1.2.2 设备和方法
采用美国GE 公司3.0T MRI 扫描仪(Pioneer,GE Health care Milwaukee,WI,USA)16 通道线圈进行扫查。为减少运动伪影,获得高质量图像,所有患儿均在MRI 检查前30 min 用5%水合氯醛(0.5 mL/kg体质量)灌肠麻醉。外耳道插入棉球保护听力,头部两侧放置隔音海绵固定。入睡后行颅脑MR 扫查,包括常规序列T1WI、T2WI 及DKI。DKI 序列扫描参数:TR 8 200 ms,TE 2.32 ms,矩阵256×256,激励次数1,视野200 mm×200 mm,层厚4 mm,层间距0 mm,b值为0、1 000 s/mm2和2 000 s/mm2,扫描时间443 s,层数为29 层。
将采集的DKI 图像导入iQuant 后处理工作站完成数据的处理,一次性得到各向异性分数(Fractional anisotropy,FA)、平均弥散系数(Mean diffusivity,MD)、轴向弥散系数(Axial diffusivity,DA)、径向弥散系数(Radial diffusivity,DR)、平均弥散峰度(Mean kurtosis,MK)、轴向弥散峰度(Axial kurtosis,Ka)、径向弥散峰度(Radial kurtosis,Kr)7 幅伪彩图,并将FA、MD、MK、Ka 和Kr 伪彩图依次导入ITK-SNAP(Version 3.8.0 Jun 12,2019)软件,参照FA图,在清晰显示各感兴趣区位置时,使用圆形测量工具,每次测量置于感兴趣区的正中部位,尽量避免周围组织的污染,平均测量3 次后取平均值,测得7 个感兴趣区左右双侧的MD、MK、Ka、Kr值,包括双侧额叶白质、双侧顶叶白质、胼胝体膝部和压部、双侧内囊前肢、双侧内囊后肢、双侧丘脑、双侧尾状核头(图1~12)。
1.3 统计学方法
运用SPSS 25.0 版统计软件包进行数据分析。两组间比较符合正态分布的采用独立样本t 检验,并以均数±标准差()表示,感兴趣区的DKI 参数与CARS 总分之间的关系应用Pearson 相关性分析。所有的统计检验均为双尾,显著性水平为0.05。
2 结果
2.1 ASD 组与GDD 组一般情况
两组儿童的年龄(P=0.073)、出生体质量(P=0.082)、检查时体质量(P=0.29)、出生孕周(P=0.938)以及Gesell 量表5 个能区(P=0.570、0.644、0.956、0.088、0.247)评分间差异均无统计学意义(P>0.05)(表1)。
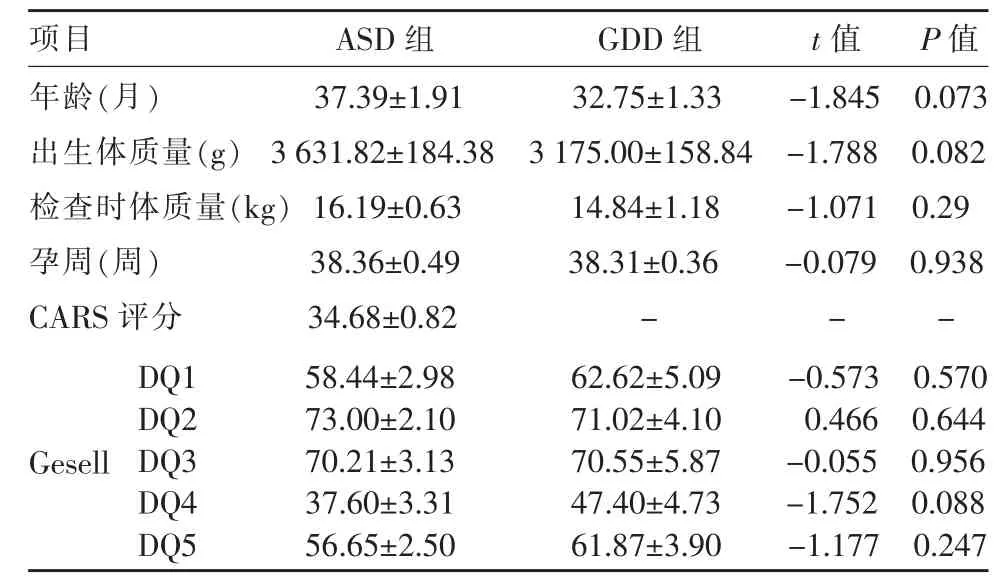
表1 ASD 组与GDD 组儿童的一般情况及神经心理学评分比较
2.2 ASD 组与GDD 组不同脑区感兴趣区DKI 参数值比较
两组间比较,ASD 组的左侧丘脑和左侧尾状核头Kr值大于对照组(P<0.05),差异具有统计学意义,余感兴趣参数值间差异无统计学意义(P>0.05)(表2,3)。
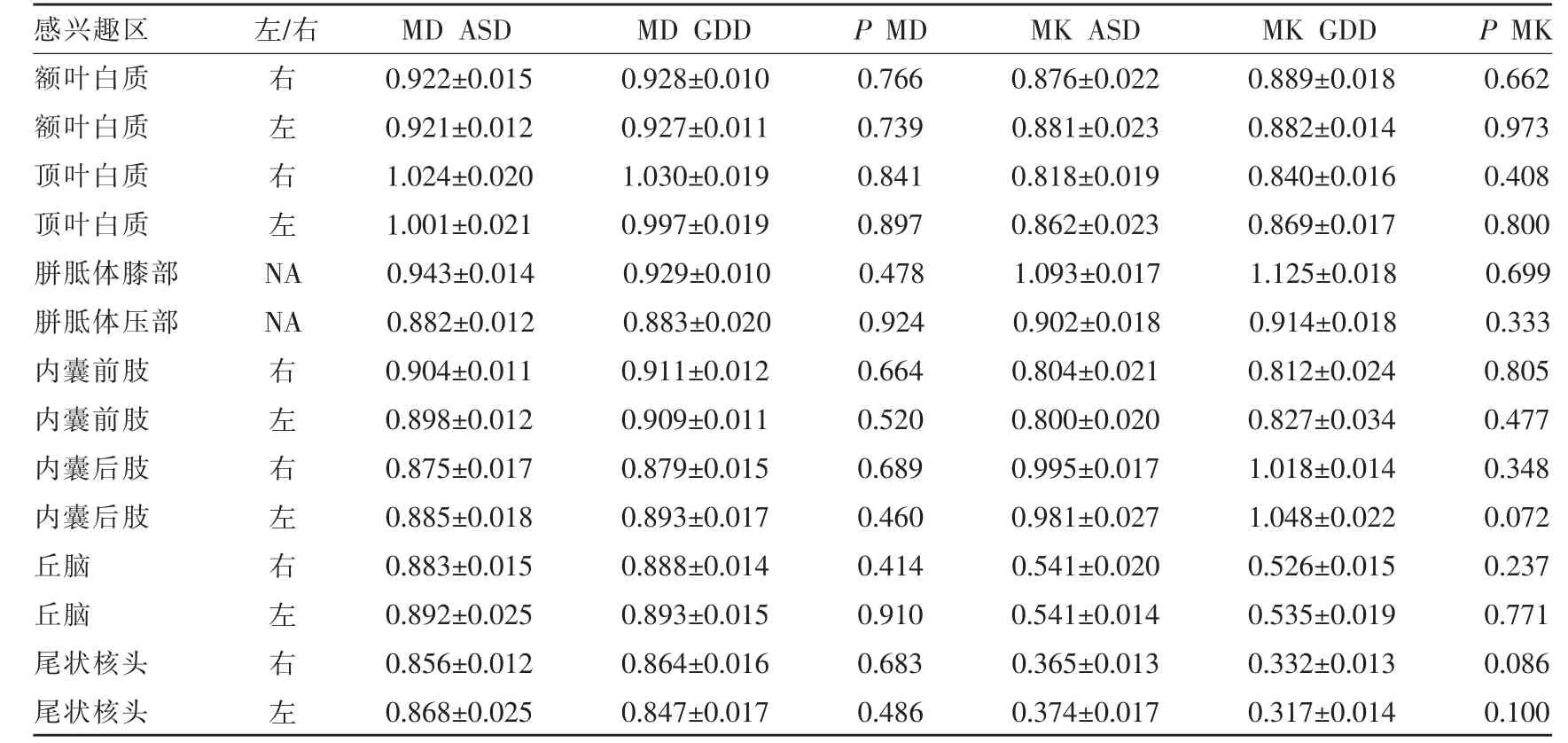
表2 ASD 与GDD 组不同脑区感兴趣区MD值和MK值比较
2.3 ASD 组各脑区DKI 参数与心理学评分的相关性分析
CARS 总分与右侧丘脑Kr值呈正相关(r=0.442,P=0.040),DQ1 与胼胝体膝部Kr值呈负相关(r=-0.445,P=0.038),DQ3 与右侧额叶白质和左侧顶叶白质Kr值呈负相关(r=-0.455,P=0.033)、(r=-0.448,P=0.036),DQ5 与右侧额叶白质和左侧顶叶白质Kr值呈负相关(r=-0.519,P=0.013)、(r=-0.439,P=0.041)(表4)。
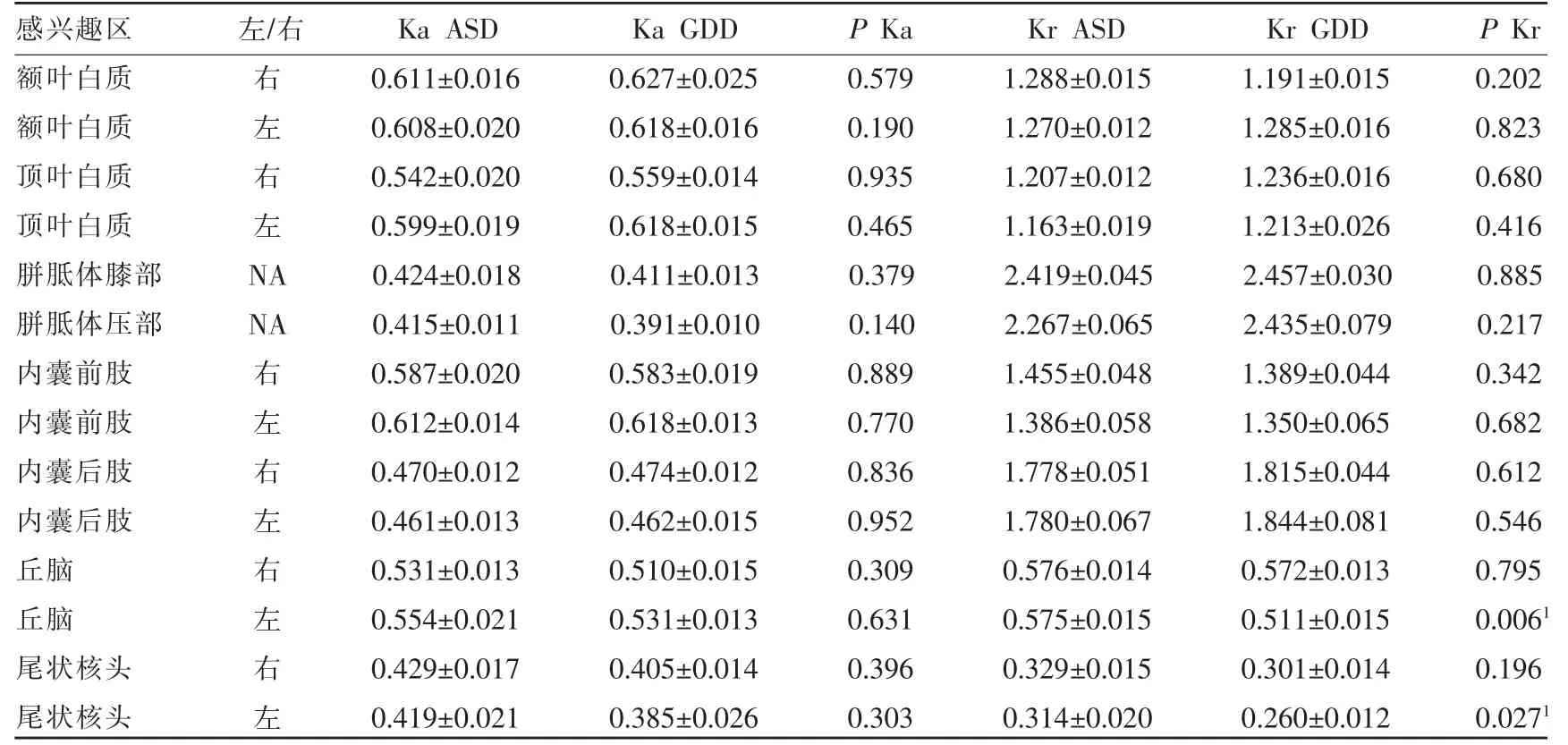
表3 ASD 与GDD 组不同脑区感兴趣区Ka值和Kr值比较
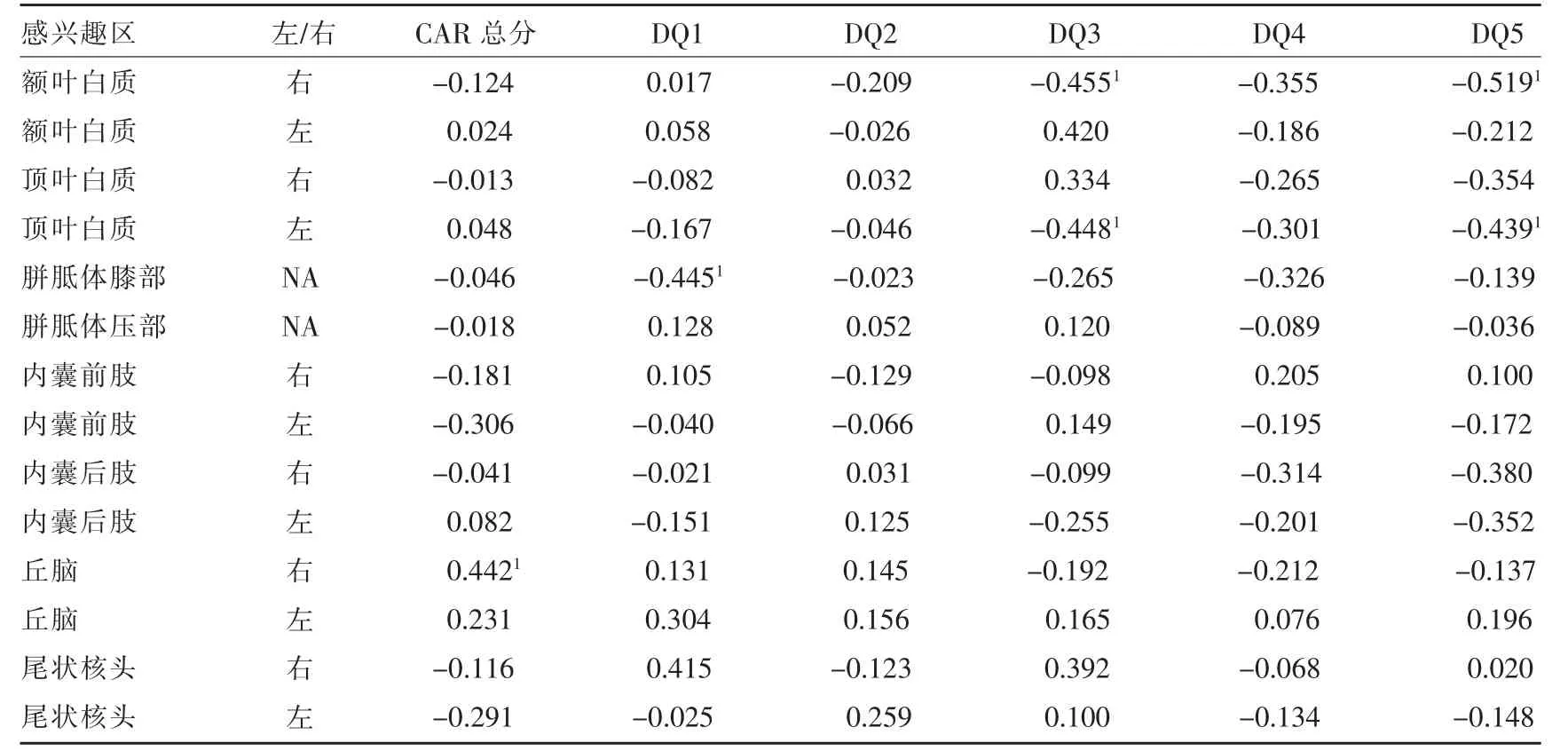
表4 ASD 组感兴趣区Kr值与CARS 总分、Gesell 各能区评分之间的相关性分析(r)
3 讨论
ASD 病因不明,与遗传、感染、免疫及孕期理化因子刺激等有关。目前,ASD 最有效的治疗方法是尽早干预和康复训练。干预的年龄越早,治疗疗效越好。早期积极的康复训练能明显改善症状,提高ASD 患儿的生活质量。当前ASD 面临的首要挑战是早期检测识别并有效干预治疗。常规磁共振扫描很少能发现特异性病灶,且大多数ASD 患儿磁共振检查并未发现异常。此外,已证实人类智力与脑白质束的完整性和脑容量有关,典型发育儿童的智商得分通常远高于ASD 儿童[10-11]。为了控制智商差异以更好地揭示ASD 的核心特征,我们选择了GDD 男性患儿作为对照组,以匹配两组间的智商得分。为避免忽略大脑偏侧化的影响,本研究未将感兴趣区左右两侧的特征值进行平均。结合之前的研究,选取与ASD 临床症状较相关的脑区作为本研究的感兴趣区,并同时纳入了灰质和白质核团。MK、Kr、Ka 和MD值分别测量水分子扩散的不同特征,并且对大脑灰质核团微结构改变异常敏感[12],在本研究的数据中,Kr值作为一个垂直于主要扩散方向的扩散峰度的DKI 特异性参数,是量化组间差异的最敏感指标,因此本研究中只分析了Kr值与ASD 组神经心理学评分的相关性。
以往的磁共振弥散张量成像(DTI)多集中于大脑白质的研究,对大脑灰质的改变关注较少,DKI 技术不仅能更敏感的检测到灰质核团的微结构改变,而且完善了DTI 检查中FA值在神经纤维交叉处检测的不敏感性[13],可同时更完整地识别脑微结构的组织学变化。DKI 已被证明对脑白质改变[14]以及包括帕金森病[15]、多发性硬化[16]、创伤性脑损伤[17]、精神分裂症[18]、阿尔茨海默病[19]和注意力缺陷/多动障碍[20]在内的几种疾病的微结构变化敏感。MK值是指水分子沿空间各方向弥散峰度的平均值[21],可反映大脑灰质核团扩散受限情况及其微观结构的变化,水分子扩散受限程度越严重,组织微观结构的复杂程度就越高,即MK值越大。本研究中ASD 组两侧丘脑和尾状核头的MK值与GDD 组比较,差异没有统计学意义,但ASD 组的MK值均大于GDD 组。其可能的原因为丘脑和尾状核头内神经元破坏、丢失或胶质增生严重,导致其内部结构变化更复杂,从而使水分子的扩散受限。在本研究中,右侧丘脑Kr值与CARS 总分呈正相关,也验证了这一点,CARS 总分越高,表明ASD 组分级越严重,该结果与国内的研究不符[22]。
Kr 和Ka值弥补了MD值在反映水分子扩散运动方向性上存在的不足,它们分别反映了水分子在垂直及平行于纤维束方向的扩散信息[23]。本研究中发现ASD 组左侧丘脑和左侧尾状核头Kr值均高于GDD组,差异具有统计学意义。原因可能是尾状核头和丘脑内细胞膜、神经元髓鞘的破坏或神经元的胶质增生增加了水分子在垂直于纤维束方向的扩散阻力,且ASD 组的左侧丘脑和尾状核头较GDD 组破坏更严重。ASD 组Gesell 发育量表5 个能区相关性分析结果显示,DQ1 与胼胝体膝部Kr值呈负相关,即Kr值越高,适应性能力越差,这与Sui 等[24]的研究结果基本一致。DQ3 和DQ5 分别与右侧额叶白质和左侧顶叶白质Kr值呈负相关。额叶主要参与执行功能、心理理论调控,顶叶主要与身体协调性和感觉有关。细胞正常结构破坏越严重,组织微结构顺序杂乱越明显,反映为组织弥散峰度系数改变,同时会影响神经元之间的信息传递。本研究中两组的Ka值和MD值比较都未发现统计学意义,可能的原因是两组脑组织细微结构破坏的差异较小,且在水平方向的弥散受限不明显。比较意外的发现是,本研究中并未发现DQ4 与DKI 参数之间的关系。根据以往的研究,语言沟通障碍是ASD 最早的征兆之一,也是导致其就诊的主要原因[25],可能的解释是语言功能高度依赖复杂的联想加工,还受皮层区域的影响[26],因此ASD 男童语言发育落后并不能通过单一参数进行量化。
目前,儿童ASD 的DKI 研究较少,国外的研究较多集中在青少年这一年龄段[24,27-28]。DKI 技术在学龄前儿童ASD 中的应用前景非常广泛。由于ASD的诊断主要依靠临床量表评估,缺乏一定的客观性证据,因此开发磁共振诊断标志物对ASD 的早期发现非常有必要。本研究结果表明,ASD 男童大脑存在广泛的微结构改变,其中以右侧丘脑改变最为显著,右侧丘脑Kr值或许会对ASD 的诊断有一定帮助。将来的研究重点可以纳入更多更精细的感兴趣区,将年龄跨度进一步缩小,尽可能避免髓鞘化发育的影响。同时联合3D 磁共振序列,提取感兴趣区的体积和面积,对大脑微结构的改变进行更全面的评估。接下来本课题组将会纳入更多的ASD 样本,并招募志愿者进行多时段的纵向研究以验证结论,并进行长期的随访。
本研究也存在一些不足:①样本量较小,未对孤独症的严重程度进行分级比较,病情的严重程度不同,脑结构的变化可能也不同;②所有样本纳入的均为男童,结论可能不一定适合该年龄段的所有儿童;③感兴趣区基于手动分割,不适于大样本量分析。
