TaJAZ7D蛋白在冬小麦JA抗寒途径中的作用
2022-12-09梁佳文魏铁锁樊晓培
梁佳文,魏铁锁,樊晓培,苍 晶,张 达
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
小麦是全世界种植面积最大的粮食作物之一,低温作为主要的非生物胁迫因子,限制小麦的种植范围和产量。植物对低温的应答是一个涉及多基因、多信号途径的复杂过程[1]。茉莉酸(Jasmonate,JA)是植物体内普遍存在的一类氧化脂类化合物,可调节植物发育和生物与非生物胁迫响应过程[2],诱导植物抗寒基因的表达,进而增强植物的抗寒性[3]。JA信号转导的核心模块是COI1/JAZ/MYC2复合体[4],转录抑制因子JAZ蛋白、MYC2转录因子和E3泛素连接酶SCFCOI1等相互作用,共同参与JA信号转导过程[5]。
JAZ是一类阻遏蛋白,参与多个信号通路的调控,调节JA应答,在植物防御、生长发育、叶片衰老等方面发挥重要作用[6]。在JA浓度较低时,JAZ蛋白与转录激活因子MYC2结合,通过抑制MYC2的活性来抑制JA早期应答基因的表达,诱导植物内源JA的合成与积累;高浓度的JA促使JAZ蛋白与SCFCOI1受体复合物结合,导致JAZ蛋白被泛素化,进而被26S蛋白酶体降解,从而解除JAZ蛋白对MYC2的转录抑制,激活JA早期应答基因的表达[6]。
ICE-CBF-COR途径是高等植物体内主要的抗寒途径。ICE1是ICE-CBF-COR通路的关键调控因子,ICE1结合CBF3基因启动子的MYC结合位点(CANNTG),并在冷处理下激活CBF3基因的表达[7]。在拟南芥中,AtJAZ1、AtJAZ4与AtICE1蛋白互作,抑制AtICE1基因的转录;且过表达AtJAZ1或AtJAZ4基因的拟南芥抗冻性均降低,说明AtJAZ1、AtJAZ4蛋白负调控拟南芥的抗冻性[4]。然而JAZ蛋白是否参与调控小麦的抗寒性尚未见报道。小麦中已经分离鉴定出14个JAZ基因,其中,TaJAZ7与AtJAZ1、TaJAZ12与AtJAZ4有较高的同源性[8]。小麦TaICE41是拟南芥AtICE1基因的同源基因[9]。赵 虎等[10]研究发现,茉莉酸甲酯(MeJA)提高了东农冬麦1号(Dn1)的抗寒性,TaMYC2基因正调控Dn1的抗寒性;樊晓培等[11]研究发现,MeJA处理提高了低温胁迫下Dn1中冷响应基因TaWcor14、TaWcor15、TaWcor18、TaWcor413和TaICE41的表达量。为进一步探究JAZ蛋白在冬小麦抗寒中的作用,本研究检测低温胁迫下外源MeJA对TaJAZ7和TaJAZ12基因在Dn1中表达模式的影响,并对低温胁迫下响应程度较为明显的TaJAZ7(以TaJAZ7D为例)蛋白进行亚细胞定位,同时采用酵母双杂技术对TaJAZ7D蛋白与TaMYC2、TaICE41蛋白之间的互作进行初步分析,以期为解析JA在调控冬小麦抗寒性的作用机制提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为强抗寒冬小麦品种东农冬麦1号(Dn1,可耐-30~-35 ℃),返青率大于85%,由东北农业大学农学院小麦室提供。于2018年9月8日将材料种植于东北农业大学校内试验地,完全区组设计,共10行区,小区行长约2 m,行距 0.2 m。每行播种150粒,播深5 cm,田间常规管理。于小麦三叶期(2018年9月24日),用1 mmol·L-1的MeJA喷施小麦叶片,以喷施等量蒸馏水为对照。待大田自然降温、连续10 d平均最低温度分别为5 ℃(2018年10月15日)、0 ℃(2018年11月2日)、-10 ℃(2018年11月24日)和-25 ℃(2019年1月14日)时,取长势一致的麦苗,蒸馏水洗净,将分蘖节和叶片剪成0.5 cm小段,锡箔纸分别包装,液氮速冻后,置于 -80 ℃冰箱保存,备用。
1.2 试验方法
1.2.1 RNA的提取和实时荧光定量PCR分析
用Trizol法提取冬小麦分蘖节和叶片总RNA;用反转录试剂盒(全式金,北京)合成cDNA第一条链。用Primer Premier 6.0软件设计TaJAZ7(TraesCS4D02G295900.1)和TaJAZ12(TraesCS6D02G274700.1)基因的qRT-PCR特异引物,以小麦TaActin为内参基因,引物序列见表1。按照TransStart TOP Green qPCR SuperMix试剂盒说明书(全式金,北京)的反应体系进行qRT-PCR反应,操作系统为Mx3000p Real-Time PCR Systerm(Stratagene,美国)。反应程序:94 ℃预变性30 s;94 ℃变性 5 s,60 ℃退火 30 s,40个循环;94 ℃变性15 s, 60 ℃退火60 s, 94 ℃变性15 s。反应结束后,观察曲线峰值是否单一以验证试验的准确性。采取2-△△Ct法计算基因的相对表达量,3次生物学重复,采用SPSS 22软件进行数据统计与显著性分析。
1.2.2 TaJAZ7D蛋白的生物信息学分析
用在线软件ExPASy-ProtParam(http://web.expasy.org/protparam/)分析TaJAZ7D蛋白的理化性质;用在线工具NCBI-CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测TaJAZ7D蛋白的保守结构域[12];用在线程序ProtScale(https://web.expasy.org/protscale/)预测TaJAZ7D蛋白的疏水区和亲水区;用MEGA 7.0的邻接法(neighbor-Joining)对TaJAZ7A、TaJAZ7B和TaJAZ7D蛋白序列进行系统进化分析;用在线工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)[13]和SWISS-MODEL(https://swissmodel.expasy.org/)[14]预测TaJAZ7D蛋白质的二级和三级结构。
1.2.3 TaJAZ7D蛋白的亚细胞定位
采用Primer Premier 6.0软件设计pCAMBIA2300-TaJAZ7D-EGFP-F/R引物(表1),以TaJAZ7D基因的cDNA为模板进行PCR扩增。使用限制性内切酶BamHⅠ对pCAMBIA2300-EGFP载体进行酶切,PCR扩增产物和酶切产物回收纯化后,用一步克隆试剂盒(诺唯赞,南京)进行同源重组并转化将期至大肠杆菌感受态细胞DH5α中,挑取单菌落进行PCR检测,然后送库美生物科技有限公司进行测序验证。将构建成功的重组载体pCAMBIA2300-TaJAZ7D-EGFP、空载体pCAMBIA2300-EGFP(对照)分别转化至农杆菌感受态细胞GV3101中,挑取阳性单克隆, 28 ℃震荡培养(220 r·min-1)12 h后离心收集菌体,用适量缓冲液(100μmol·L-1乙酰丁香酮、10 mmol·L-12-吗啉乙磺酸和10 mmol·L-1氯化镁的悬浮液)重悬菌体,调整菌液浓度使其OD600=0.6~0.8,黑暗静置4~6 h,然后将菌液注射至4周苗龄且长势一致的本氏烟草叶片中,将注射过的烟草黑暗放置24 h后,弱光下培养 24 h,然后正常光照培养24 h。取干净的载玻片,在载玻片上滴加几滴4′6-二脒基-2-苯基吲哚(DAPI)染液,用镊子撕取注射过的烟草表皮叶片,放在DAPI染液中展平,盖好盖玻片,避光染色10 min。然后用蒸馏水冲去染液,滤纸吸除多余水分,利用正置荧光显微镜(OLYMPUS BX53)观察细胞荧光定位情况。
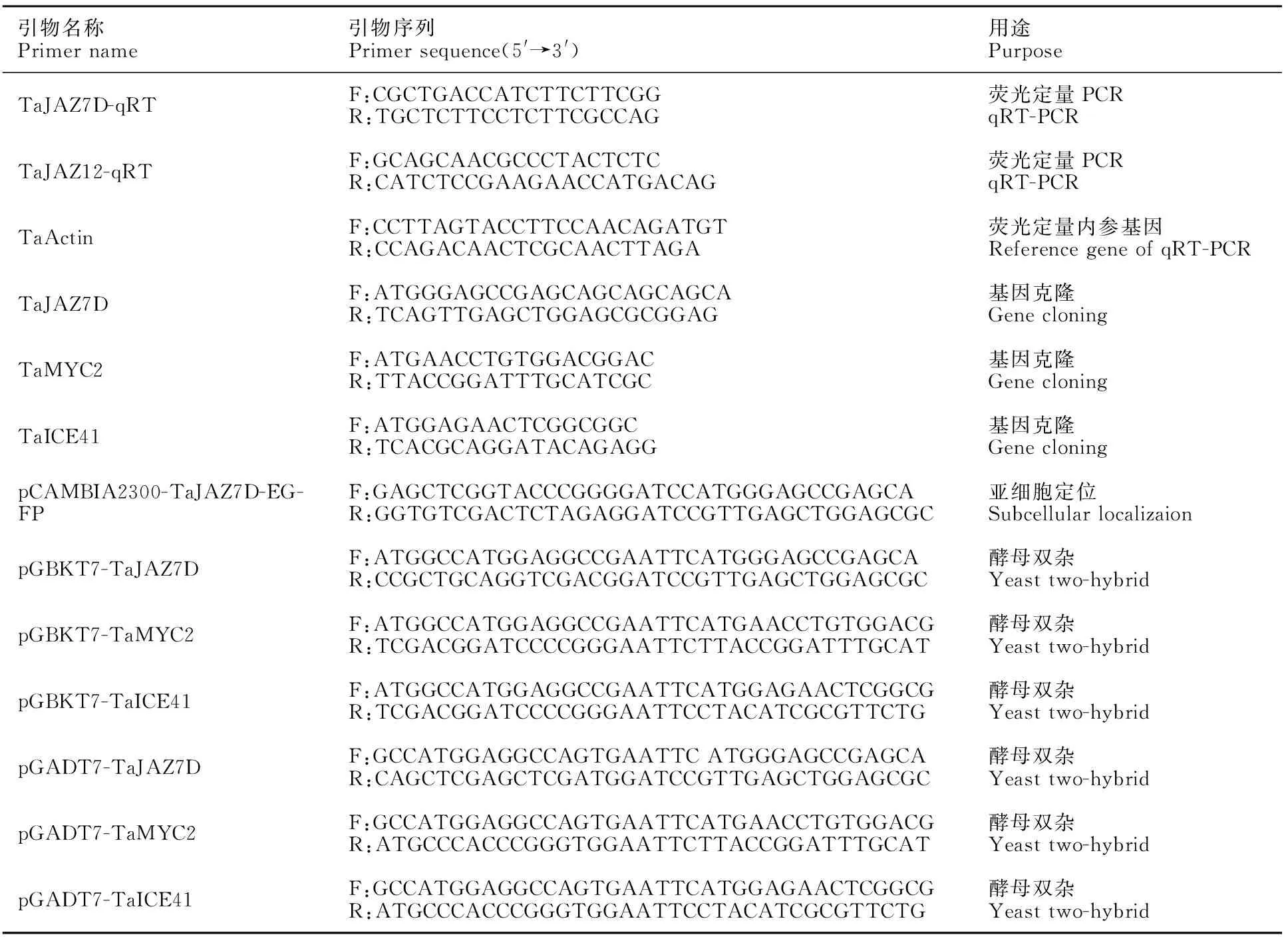
表1 本研究所用的引物Table 1 Primers used in this study
1.2.4 酵母双杂交试验(验证蛋白互作)
在Ensemble Plant在线网站获得TaJAZ7D(Traes CS4D02G295900.1)、TaMYC2(Traes CS1D02G 196900)和TaICE41(Traes CS3A02G442200)基因的编码区序列,用Primer premier 6.0设计引物(表1)。分别以提取的 -10 ℃和-25 ℃时的分蘖节cDNA为模板进行PCR扩增。PCR扩增产物经琼脂糖凝胶电泳检测后,用凝胶回收试剂盒(全式金,北京)进行目的条带回收,并连接至pClone007 载体,将得到的重组载体pClone007-TaJAZ7D、pClone007-TaMYC2、pClone007-TaICE41转化至大肠杆菌感受态细胞DH5α中。经菌落PCR验证后,挑取阳性单菌落接种到LB液体培养基中,摇菌送测序。使用DNAMAN 6.0软件比对测序结果,若序列一致,表明这三个基因已成功被克隆,可用于后续试验。
挑取酵母菌株AH109划线于YPDA平板上,在30 ℃恒温培养箱中倒置培养3 d左右,挑取单克隆酵母制备酵母AH109感受态细胞。用EcoRⅠ分别酶切载体pGBKT7和pGADT7,按照Clon ExpressII One Step Cloning Kit试剂盒(诺唯赞,南京)说明书将TaJAZ7D、TaMYC2、TaICE41基因分别与pGBKT7和pGADT7载体连接,然后转化至酵母感受态细胞AH109中,点涂于二缺培养基SD/-Trp-Leu上,倒置于30 ℃恒温培养箱中培养1~2 d。待二缺培养基上长出适当大小的菌落后,将其扩大培养,然后点涂在三缺培养基SD/-Trp-His-Leu和四缺培养基SD/-Trp-His-Leu-Ade上,30 ℃培养3~5 d。同时设pGBKT7-53+pGADT7为阳性对照,根据菌斑生长情况检测转录自激活活性及其互作关系。
2 结果与分析
2.1 外源MeJA对低温胁迫下冬小麦 TaJAZ7、 TaJAZ12基因表达模式的影响
对小麦TaJAZ7、TaJAZ12蛋白与拟南芥AtJAZ1、AtJAZ4蛋白进行进化分析,发现 TaJAZ7蛋白与AtJAZ1蛋白聚为一个分支,同源性为100%; TaJAZ12蛋白与AtJAZ4蛋白也高度同源。因此,对低温胁迫下冬小麦TaJAZ7、TaJAZ12基因的表达模式进行检测,结果(表2)表明,Dn1分蘖节中,TaJAZ7基因的相对表达量随着温度的降低表现为“升-降-升”的变化趋势,最大值出现在-25 ℃,最小值出现在-10 ℃;TaJAZ12基因的相对表达量表现为先升后降的变化趋势,最大值出现在0 ℃,最小值出现在 -25 ℃。外源MeJA处理降低了Dn1分蘖节中TaJAZ7和TaJAZ12基因的相对表达量(5 ℃时TaJAZ12基因的表达量除外),TaJAZ7基因的相对表达量随着温度的降低而降低,最大值出现在5 ℃,最小值出现在 -25 ℃;TaJAZ12基因的相对表达量随着温度的降低表现为先降后升的变化趋势,最大值出现在 5 ℃,最小值出现在0 ℃。
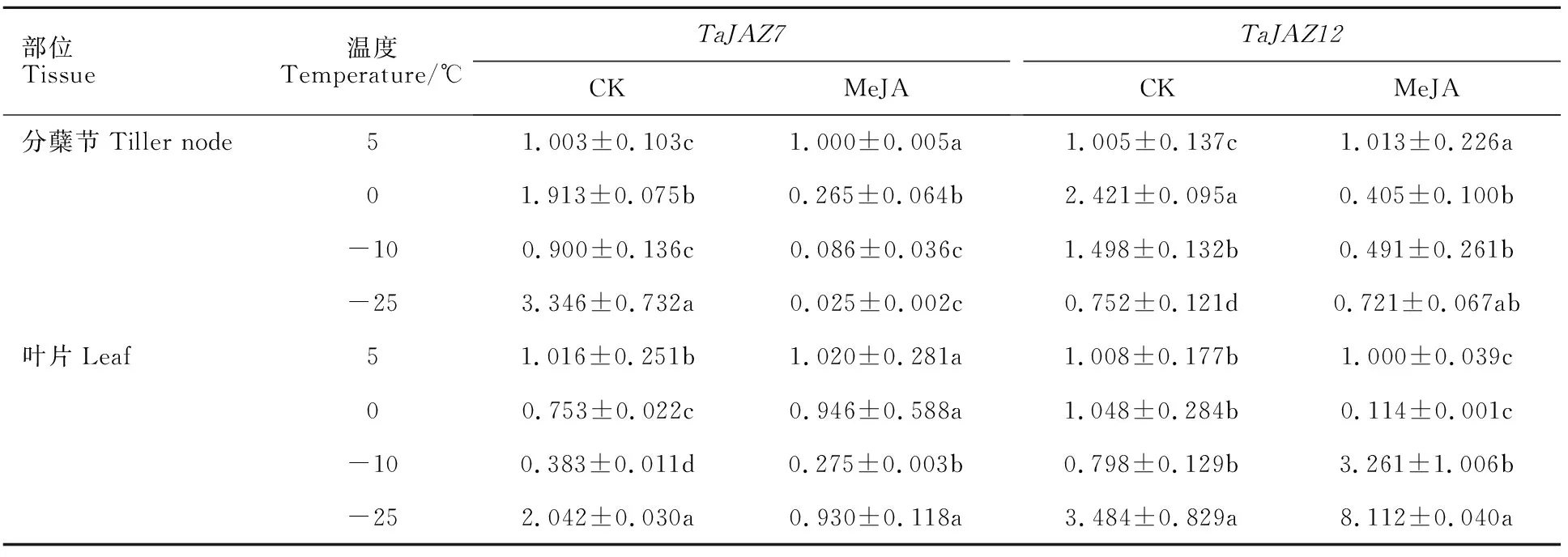
表2 外源MeJA对低温胁迫下Dn1分蘖节及叶片中 TaJAZ7、 TaJAZ12基因相对表达量的影响Table 2 Effect of MeJA on the relative expression level of TaJAZ7 and TaJAZ12 genes in Dn1 tillers and leaves under low temperature
Dn1叶片中,TaJAZ7基因的相对表达量随着温度的降低表现为先降后升的变化趋势,TaJAZ12基因的相对表达量表现为“升-降-升”的变化趋势,最大值均出现在-25 ℃,最小值均出现在-10 ℃。外源MeJA处理降低了TaJAZ7基因在-10 ℃和-25 ℃时的相对表达量以及TaJAZ12基因在0 ℃时的相对表达量。定量分析发现,外源MeJA处理下Dn1叶片中TaJAZ7基因的表达量随温度降低呈明显负相关。因此,本研究选取TaJAZ7蛋白做后续分子机制研究。
2.2 TaJAZ7D蛋白的生物信息学
2.2.1 TaJAZ7蛋白的结构域
蛋白序列进化树分析表明,TaJAZ7A蛋白与TaJAZ7D蛋白的同源性为100%, TaJAZ7A、TaJAZ7B和TaJAZ7D蛋白均具有JAZ家族典型的TIFY和CCT_2结构域,但所处的位置均不同,属于TIFY转录因子超家族(图1)。本研究以TaJAZ7D蛋白为研究对象进行后续分析。
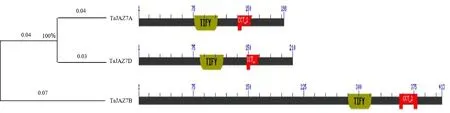
图1 TaJAZ7蛋白的结构域分析
2.2.2 TaJAZ7D蛋白的理化性质
序列分析结果表明,TaJAZ7D基因编码区全长为633 bp,可编码210个氨基酸。TaJAZ7D蛋白的相对分子量为21635.51Da,等电点(pI)为7.73,分子式为C946H1493N281O284S9,为弱碱性蛋白,属于不稳定、亲水性蛋白。
2.2.3 TaJAZ7D蛋白的二、三级结构
用SOPMA对TaJAZ7D蛋白进行二级结构预测,结果(图2)显示,TaJAZ7D蛋白的二级结构主要由α-螺旋、延伸链、β转角和无规则卷曲4种成分组成,分别占总蛋白的27.62%、14.29%、 6.67%和51.43%。预测结果表明,TaJAZ7D蛋白的二级结构为混合型。用SWISS-MODEL同源建模在线预测分析TaJAZ7D蛋白的三维模型,结果(图2)表明,构建模板蛋白为7cvo.1[15], TaJAZ7D与模板蛋白的氨基酸序列同源性为66.67%,无配体,低聚糖状态为异源二聚体,属于TIFY家族。
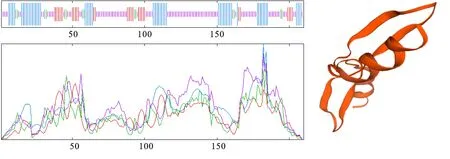
图2 TaJAZ7D蛋白的二级(左)、三级(右)结构预测
2.3 TaJAZ7D蛋白的亚细胞定位
从图3可见,在绿色荧光通道下,pCAMBIA2300-TaJAZ7D-EGFP融合蛋白在细胞核内有绿色荧光信号,表明TaJAZ7D蛋白位于细胞核内。
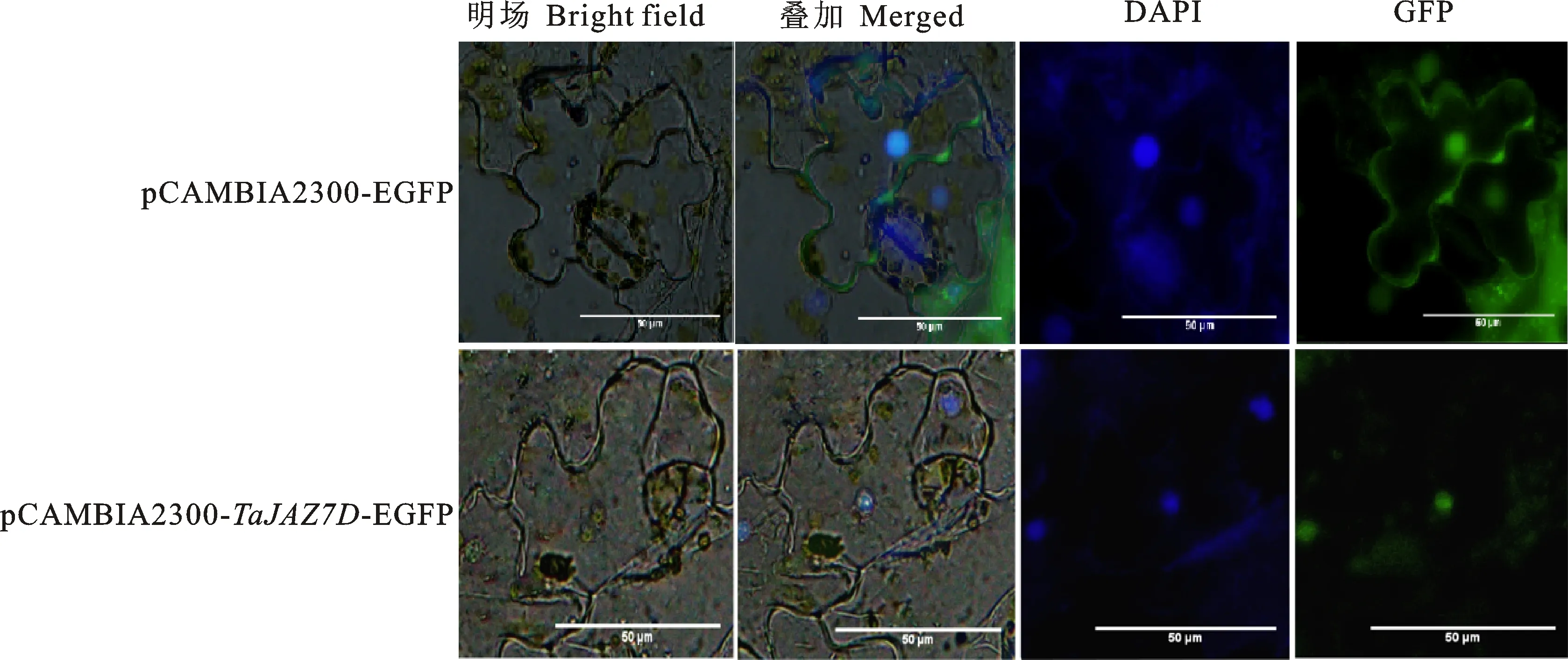
图3 烟草表皮细胞中TaJAZ7D蛋白的亚细胞定位
2.4 目的基因克隆及重组载体构建结果
用 TaJAZ7D-F/R、TaMYC2-F/R和TaICE- 41-F/R引物对目的基因TaJAZ7D、TaMYC2和TaICE41进行扩增,如图4所示,PCR扩增条带大小分别为633、2 088和1 152 bp。将目的基因分别连接至pClone007载体,并转化大肠杆菌感受态细胞DH5α,挑取阳性单菌落接种到LB液体培养基中摇培并测序,若测序成功,表明目的基因已成功克隆。然后将目的基因分别连接至pGADT7和pGBKT7载体上,用 TaJAZ7D-F/R、TaMYC2-F/R和TaICE41-F/R引物对目的基因TaJA27D、TaMYC2和TaICE41进行验证,如图5所示,pGBKT7-TaICE41和pGADT7-TaICE41能扩增出1 152 bp的条带,pGBKT7-TaJAZ7D和pGADT7-TaJAZ7D能扩增出633 bp的条带,pGBKT7-TaMYC2和pGADT7-TaMYC2能扩增出2 088 bp的条带,与目的基因条带大小均一致,表明连接成功,可用于后续试验。
2.5 TaJAZ7D、TaMYC2和TaICE41蛋白的体外自激活验证结果
从图6可以看出,pGBKT7-53与pGADT7(阳性对照)共转的酵母菌在SD/-Trp-Leu、SD/-Trp-His-Leu和SD/-Trp-His-Leu-Ade营养缺陷培养基上均生长良好。pGBKT7-TaJAZ7D与pGADT7、pGBKT7-TaMYC2与pGADT7、pGBKT7-TaICE41与pGADT7共转的酵母菌在SD/-Trp-Leu培养基上均生长良好,表明外源载体成功转入酵母菌。在SD/-Trp-His-Leu培养基上,pGBKT7-TaJAZ7D能正常生长,而pGBKT7-TaICE41不能生长,pGBKT7-TaMYC2的生长也受到抑制。在SD/-Trp-His-Leu-Ade培养基上,pGBKT7-TaJAZ7D、pGBKT7-TaMYC2和pGBKT7-TaICE41均不能正常生长,表明TaJAZ7D、TaMYC2和TaICE41蛋白在酵母细胞中无自激活活性。
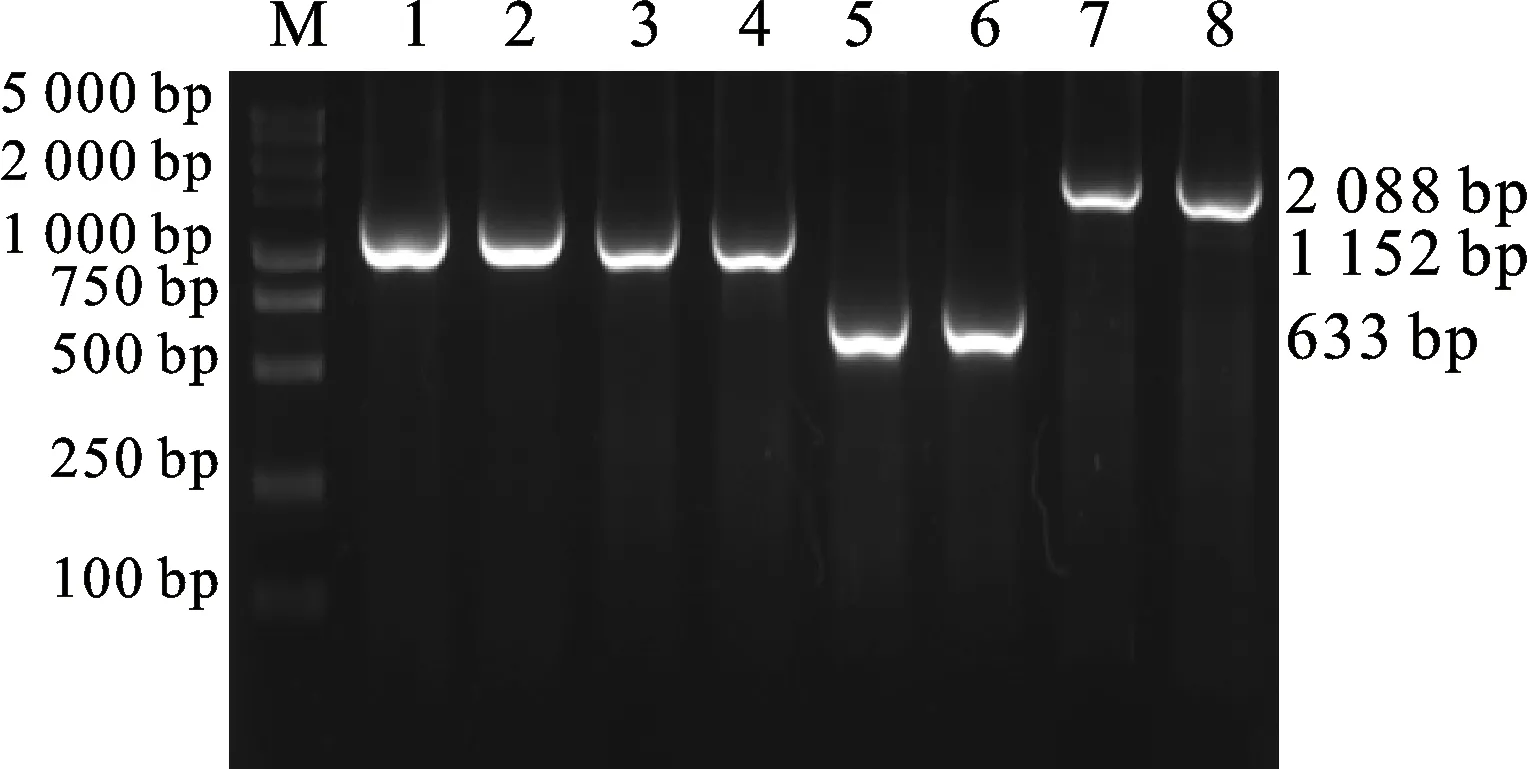
M:DL5000; 1 and 2:pGBKT7- TaICE41(1 152 bp); 3 and 4:pGADT7- TaICE41(1 152 bp); 5:pGBKT7- TaJAZ7D(633 bp); 6:pGADT7- TaJAZ7D(633 bp);7:pGBKT7-TaMYC2 (2 088 bp); 8:pGADT7- TaMYC2(2 088 bp).

100、10-1、10-2和10-3为4种不同稀释液浓度的酵母菌液。图7同。pGBKT7-53+pGADT7为阳性对照组,pGBKT7-TaJAZ7D+pGADT7、pGBKT7-TaMYC2+pGADT7和pGBKT7-TaICE41+pGADT7为试验组。
2.6 TaJAZ7D蛋白与TaMYC2和TaICE41蛋白互作的酵母双杂交鉴定结果
从图7可以看出,pGBKT7-TaJAZ7D与pGADT7-TaMYC2、pGBKT7-TaMYC2与pGADT7-TaJAZ7D、pGBKT7-TaJAZ7D与pGADT7-TaICE41、pGBKT7-TaICE41与pGADT7-TaJAZ7D共转的酵母菌在SD/-Trp-Leu、SD/-Trp-His-Leu和SD/-Trp-His-Leu-Ade培养基上均能正常生长,说明TaJAZ7D蛋白与TaMYC2和TaICE41蛋白均存在相互作用。
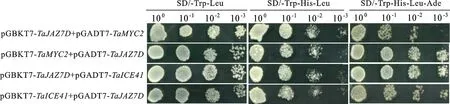
图7 TaJAZ7D蛋白与TaMYC2和TaICE41蛋白的互作验证
3 讨 论
研究表明,低温提高了水稻[16]和拟南芥[4]内源JA的水平。JA参与植物CBF抗寒途径,JA信号和CBF抗寒途径元件间存在复杂的互作关系[17]。JAZ蛋白通过Jas结构域与ICE1和ICE2蛋白的C端结构域相互作用。如在拟南芥中,AtJAZ1和AtJAZ4蛋白通过抑制AtICE1基因的转录功能进而抑制下游AtCBF3基因的表达[4],MeJA处理显著提高了ICE-CBF/DREB1信号因子下游AtCOR基因的表达量,增强了拟南芥的抗冻性;而阻断内源JA的合成及信号转导,则导致植物存活率降低、电导率升高以及对冻害敏感[4]。在香蕉中,MaMYC2s蛋白可通过与MaICE1蛋白互作,激活CBF途径相关基因的表达,而JA作为ICE-CBF/DREB1途径上游的关键信号因子,可正调控植物的抗寒性[18]。本课题组前期研究发现,JA提高了Dn1中冷响应基因和JA合成基因的表达量[10-11],增强了Dn1的抗寒性[9]。进一步研究发现,这主要与降低Dn1分蘖节和叶片中TaJAZ7基因的相对表达量相关,且在-10 ℃时作用最明显。因为-10 ℃是Dn1抗寒的重要温度节点,分蘖节是其顺利越冬的主要部位[10],推测JAZ基因表达量的降低及JAZ蛋白的降解有利于解除对MYC2转录活性的阻遏,从而激活JA响应基因及下游靶基因的表达。
JAZ蛋白是JA信号从SCFCOI1受体复合物向下游JA应答基因转导的纽带[19]。本研究生物信学分析表明,Dn1中TaJAZ7D蛋白具有典型的TIFY和Jas结构域,这与前人的报道结果一致[17,20];亚细胞定位表明, TaJAZ7D蛋白位于细胞核中,这为与其他蛋白的互作提供了条件。TIFY结构域可介导JAZ蛋白与其共抑制因子NINJA(NOVEL INTERACTOR OF JAZ,JAZ接头蛋白)相互作用或与其他JAZ接头蛋白形成二聚体,共同抑制JA信号转导[21];而Jas结构域则介导JAZ蛋白直接与JA信号通路上转录激活因子MYC2结合并抑制其转录活性,进而抑制JA应答基因的表达[22]。拟南芥中已分离鉴定出12个JAZ基因[20],小麦中已分离鉴定出14个JAZ基因[8],本研究进化分析表明,小麦TaJAZ7、TaJAZ12基因分别与拟南芥AtJAZ1、AtJAZ4基因高度同源。基于拟南芥AtJAZ1、AtJAZ4蛋白分别与AtICE1、AtICE2蛋白互作可调控拟南芥的抗寒性[4],我们推测TaJAZ蛋白可能有类似的功能,而TaJAZ7蛋白与TaMYC2和TaICE41蛋白的互作验证是首先需要解决的问题。
蛋白与蛋白互作在许多生物进程中起着至关重要的作用,酵母双杂交试验广泛应用于互作蛋白的研究中。前人研究发现,JAZ蛋白与转录因子MYB21和MYB24互作,可特异调控雄蕊发育[23];JAZ1蛋白可与bHLH类转录因子TT8、GL3和EGL3以及MYB类转录因子MYB75和GL1互作,抑制其转录活性,进而抑制毛状体的发生和花青素的积累[24];JAZ1和JAZ4蛋白分别与ICE1和ICE2蛋白互作,可调节拟南芥的耐冻性[4];JAZ4和JAZ8蛋白与WRKY57蛋白互作,可调节JA诱导的叶片衰老[25];JAZ1蛋白与TOE1和TOE2蛋白互作,可调节开花时间[26];JAZ1、JAZ3和JAZ9蛋白与EIN3/EIL1蛋白互作,可介导JA和乙烯之间的激素串扰[27];赤霉素也可通过JAZ蛋白与DELLAs蛋白的互作来调节JA信号途径[28]。小麦TaJAZ1蛋白(AtJAZ3的同源类似物)与TaABI5蛋白互作,通过ABA信号转导途径正调控小麦种子萌发和ABA响应基因的表达[29]。本研究发现,Dn1 中 TaJAZ7D蛋白与TaMYC2、TaICE41蛋白存在互作关系,推测这3个蛋白相互作用可调节Dn1的抗寒性。后续还需要结合双分子荧光互补(BiFC)、GST pull down等技术对蛋白互作进行进一步验证。
