叶酸-磁双靶向多功能纳米分子探针用于视网膜母细胞瘤体外多模态成像的研究
2022-12-09郑文笛邹宏密武明星
李 醒,郑文笛,邹宏密,武明星
0引言
视网膜母细胞瘤[1-2](retinoblastoma,RB)是婴幼儿常见的眼内恶性肿瘤,其中多数患者(85%)来自于低收入和中等收入国家。在这些地区,患者最常见的临床表现包括白瞳症、斜视和眼球突出,发现时已有近半数患者有眼外肿瘤,甚至发生远处转移[3],发展到晚期患者不得不面临眼球摘除的风险,这为患者及其家庭的心理健康和生活质量带来了严重负担[4-5]。因此,早期诊断和治疗是控制RB的关键。分子影像技术的发展为早期诊断RB提供了新的方向,为了更好地满足医学多样化和个性化需求,靶向多模态显像的分子探针成为了研究热点[6-7]。
以Fe3O4为核心的超顺磁性氧化铁纳米粒子(SPION),能够在外加磁场下向靶组织聚集[8],结合配体修饰型主动靶向探针,有望进一步提升探针的靶向性能[9]。研究发现,SPION能够吸收近红外光进行光成像,并且能够作为磁共振成像(MRI)的阴性对比剂使用[10-11]。将SPION与液态氟碳(perfluorohexane,PFH)共同组装成相变型纳米分子探针,在激光作用下会发生液气相变,从而增强超声显像[12]。叶酸是一种水溶性维生素,将其修饰纳米粒上,可以和RB细胞上的受体通过受体-配体介导作用特异性结合。阿霉素[13](adriamycin,ADM)作为广谱化疗药物,通过药物递送系统,在光触发下治疗眼内疾病很有潜力。本研究拟制备一种新型的、高靶向性的纳米级多模态造影剂,以叶酸(folic acid,FA)、Fe3O4为双重靶向,载PFH、ADM的相变型多功能脂质体纳米粒(FA-PFH-Fe3O4@ADM),研究其靶向视网膜母细胞瘤Y79细胞及体外超声/光声/MRI三模态成像能力,通过分子影像技术,为早期、高效、精准诊断RB提供新的思路。
1材料和方法
1.1材料
1.1.1主要材料二棕榈酰磷脂酰胆碱(DPPC,瑞禧生物、LP-R4-057),叶酸修饰磷脂酰乙醇胺(DSPE-PEG2000-FA,瑞禧生物、R-0043),胆固醇(瑞禧生物、117298),全氟己烷(PFH,STREM、09-6072),叶酸(Sigma、R010338),盐酸阿霉素(ADM,阿拉丁、D107159),超顺磁性氧化铁(SPION,瑞禧生物、R-C1002),三氯甲烷(上海生化),DAPI染色液(碧云天、AR1176),CCK-8试剂盒(同仁化学、CK04),人视网膜母细胞瘤细胞(Y79,上海斯信生物科技有限公司),RPMI1640培养基(Gibco、C11875500BT)。
1.1.2主要仪器旋转蒸发仪(亚荣),超声波声振仪(Sonics),低温离心机(Eppendorf),马尔文粒径分析仪(Malvern),紫外分光光度计(岛津UV2600),电感耦合等离子体发射光谱仪(ICP-OES)(Agilent 720ES);红外成像仪(Fotric 226),808nm激光仪(FC808-2W-MM,西安中川光电科技有限公司),振动样品磁强计(VSM)(LakeShore 7404型),多功能酶标仪(BioTek),Vevo Laser光声成像系统(Visual Sonics),磁共振成像系统(SIEMENS),激光共聚焦显微镜(Andor2000)。
1.2方法
1.2.1FA-PFH-Fe3O4@ADM纳米粒的制备纳米粒采用双乳化法制备,按照5∶2∶2比例称取DPPC、DSPE-PEG2000-FA、胆固醇共5mg,溶于6mL三氯甲烷中。旋转蒸发2h,得到白色薄膜,使用2mL PBS充分水化脂膜备用。称取ADM 1mg于100μL PBS中溶解,加入200μL SPION,100μL PFH,冰浴下进行第1次超声乳化(功率:35%;时间:1min,5s,5s),再加入水化液进行第2次超声乳化(功率:40%;时间:3min,5s,5s)。低温离心3次(8000r/min,5min),即可得到FA-PFH-Fe3O4@ADM纳米粒乳液。制备过程中,使用DSPE-PEG2000替代DSPE-PEG2000-FA即可得到PFH-Fe3O4@ADM纳米粒,不加入SPION即可得到FA-PFH@ADM纳米粒。
1.2.2FA-PFH-Fe3O4@ADM纳米粒的基本特征检测观察纳米粒乳液的性状,稀释后分别于光镜、透射电镜下观察纳米粒的形态,使用马尔文粒径分析仪分析其粒径、电位分布情况。分别使用紫外分光光度计及ICP-OES检测纳米粒,根据以下公式:包封率(%)=[(m加入试剂-m上清液中试剂)/m加入试剂] ×100%;载药量(%)=[(m加入试剂-m上清液中试剂)/m纳米粒] ×100%,计算纳米粒中ADM及Fe的包封率和载药量。VSM检测纳米粒的磁性能,并给纳米粒施加磁场,观察其顺磁性能。
1.2.3细胞培养及细胞毒性检测使用含20%胎牛血清、1%青/链霉素双抗的RPMI1640培养基,在5%CO2,37℃的恒温孵箱中培养Y79细胞。传代4次后,取对数生长期细胞接种于96孔板(1×104细胞/孔),加入不同浓度的FA-PFH-Fe3O4@ADM纳米粒共同孵育24h。离心除去培养基,每孔加入10% CCK-8试剂100μL,继续孵育1h,用酶标仪检测各孔在450nm处的吸光度,各组细胞存活率根据以下公式计算:细胞存活率(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.4FA-PFH-Fe3O4@ADM纳米粒的光热效应及光致相变能力检测将纳米粒分为PBS组、FA-PFH@ADM组、不同浓度(0.156、0.313、0.625、1.25mg/mL)FA-PFH-Fe3O4@ADM组,置于96孔板中,使用808nm激光(2W/cm2)辐照5min,并记录其升温情况。取0.625mg/mL的纳米粒于96孔板中,使用不同功率(1.0、1.5、2.0、2.5W/cm2)808nm激光辐照5min,并记录其升温情况。在升温过程中,使用光学显微镜观察纳米粒微气泡产生情况,探索纳米粒发生相变条件。
1.2.5FA-PFH-Fe3O4@ADM纳米粒体外靶向性取对数生长期的Y79细胞接种于6孔板,分为对照组、非靶向组、单叶酸靶组、单磁靶组、叶酸-磁双靶组。对照组不加入纳米粒,非靶向组及单磁靶组加入PFH-Fe3O4@ADM纳米粒(0.625mg/mL),单叶酸靶组及叶酸-磁双靶组加入FA-PFH-Fe3O4@ADM纳米粒(0.625mg/mL),并于单磁靶组和叶酸-磁双靶组的孔板侧放约4T磁铁1枚,靠近磁铁侧的细胞视为磁靶区域内的细胞。细胞与纳米粒共同孵育1h,离心除去未吞噬的纳米粒,使用4%多聚甲醛固定细胞,DAPI染色液染色细胞核,通过激光共聚焦显微镜观察各组细胞吞噬情况,并进行流式细胞学检测进行定量分析。
1.2.6FA-PFH-Fe3O4@ADM纳米粒体外超声/光声/MRI三模态成像将1.25mg/mL FA-PFH-Fe3O4@ADM纳米粒置于4%的凝胶孔洞模型中,使用808nm激光仪(2W/cm2)分别作用0、1、2、3、5min,再使用光声成像仪的B模式和造影模式分别记录其超声图像并读取相应声强值。将FA-PFH-Fe3O4@ADM纳米粒配制为0.2、0.4、0.6、0.8、1.0mg/mL五个不同浓度,取200μL于3%的凝胶孔洞模型中,于光声成像仪上检测各浓度的光声图像并读取相应光声信号值。将H2O和不同浓度(0.025、0.05、0.1、0.2、0.4mg/mL)FA-PFH-Fe3O4@ADM纳米粒置于2mL圆底离心管中,使用磁共振成像系统检测其T2像的磁共振图像,并读取计算相应T2信号值。

2结果
2.1FA-PFH-Fe3O4@ADM纳米粒的基本特征FA-PFH-Fe3O4@ADM纳米粒制备成功,呈棕红色乳液,镜下可见其为大小均匀、分散性好的球形结构(图1A),马尔文粒径分析仪检测其分布为单峰,粒径为338.6±2.20nm(图1B),电位为-26.6±0.62mV。紫外分光光度法检测ADM的回归方程为:y=0.01474x+0.04893(x表示ADM溶液浓度,y表示吸光度),R2=0.9975(图1C),ADM的包封率为(41.76±4.12)%,载药量为(6.96±0.69)%。ICP-OES检测Fe的回归方程为:y=17183.6480x-46.8579(x表示标准Fe溶液浓度,y表示响应强度),R2=1.0000(图1C),Fe的包封率为(59.06±13.63)%,载药量为(7.13±1.65)%。VSM检测纳米粒具有超顺磁性,并观察到纳米粒能够在磁场下定向聚集(图1D)。
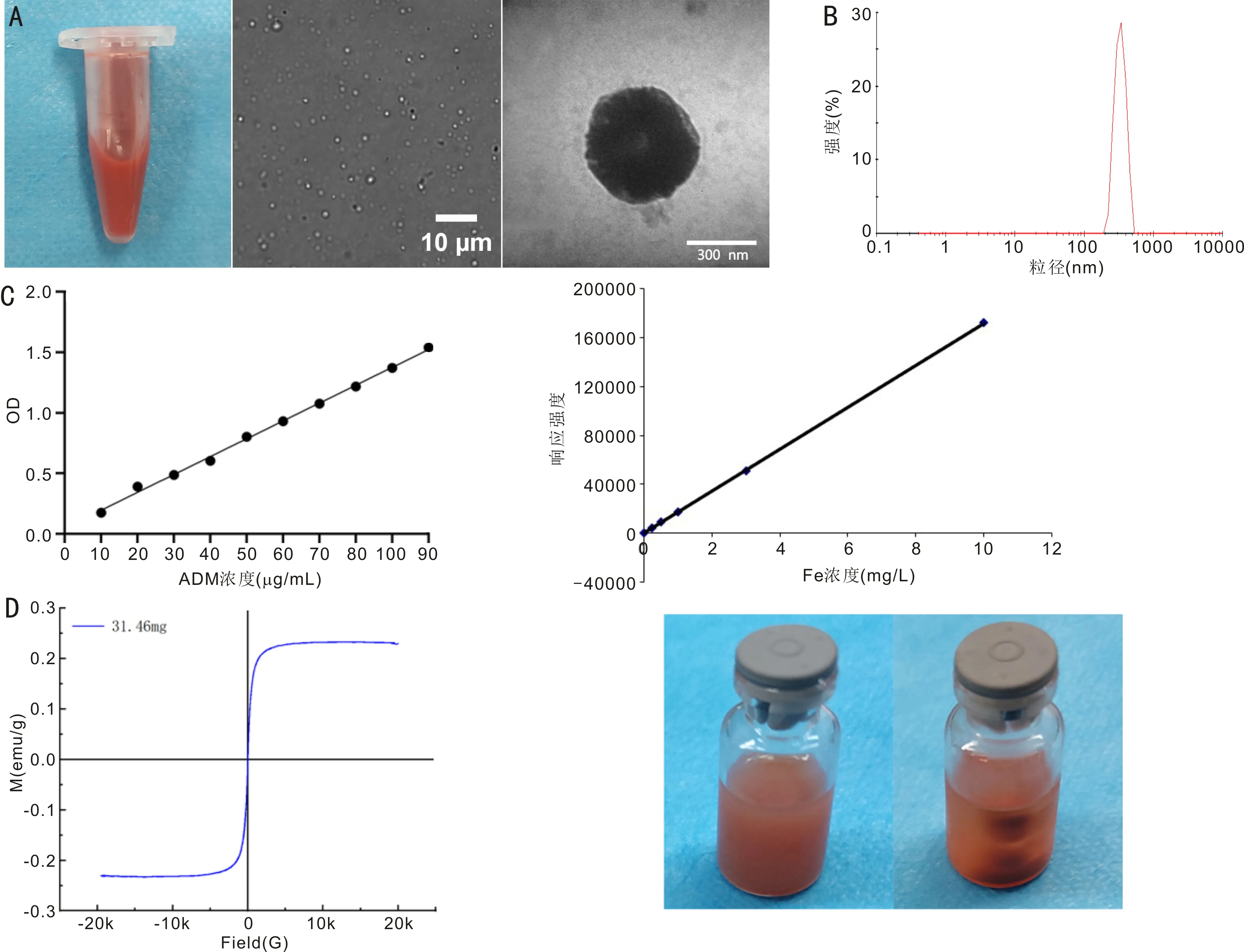
图1 FA-PFH-Fe3O4@ADM纳米粒的基本特征 A:纳米粒乳液及光镜和透射电镜下观察情况;B:纳米粒粒径分布图;C:ADM及Fe检测的标准曲线;D:纳米粒的磁滞曲线及磁性能观察图。
2.2FA-PFH-Fe3O4@ADM纳米粒的细胞毒性CCK-8实验结果显示,不同浓度(0、0.2、0.4、0.8、1.2、1.6mg/mL FA-PFH-Fe3O4@ADM)组细胞存活率分别为(1.00±0.00)%、(0.96±0.12)%、(0.94±0.06)%、(0.95±0.16)%、(0.88±0.06)%、(0.87±0.11)%,各组细胞存活率均较高,即使在高浓度下,细胞存活率也能达到85%以上,且各组细胞存活率差异无统计学意义(F=0.80,P>0.05),证明纳米粒的生物安全性良好。
2.3FA-PFH-Fe3O4@ADM纳米粒的光热效应及光致相变能力体外光热实验显示,FA-PFH-Fe3O4@ADM纳米粒可以在808nm激光辐照下产生光热效应,且升温速度和最高温度与纳米粒的浓度及激光功率呈正相关(图2A~D)。激光辐照后,显微镜下观察纳米粒可以发生液气相变,生成微气泡(图2E)。

图2 FA-PFH-Fe3O4@ADM纳米粒的光热效应及光致相变能力 A:不同浓度纳米粒在808nm激光辐照(2W/cm2)下的升温曲线;B:不同浓度纳米粒在808nm激光辐照(2W/cm2)下的升温图;C:纳米粒(0.625mg/mL)在不同功率808nm激光辐照下的升温曲线;D:纳米粒(0.625mg/mL)在不同功率808nm激光辐照下的升温图;E:相变前后纳米粒光镜下观察结果。
2.4FA-PFH-Fe3O4@ADM纳米粒体外靶向性激光共聚焦显微镜下,ADM呈红色荧光,Y79细胞核DAPI染色呈蓝色荧光。对照组和非靶向组细胞中几乎不可见纳米粒,单叶酸靶组和单磁靶组细胞中可见部分纳米粒,叶酸-磁双靶组细胞中可见大量纳米粒(图3A)。流式细胞学检测结果显示,非靶向组、单叶酸靶组、单磁靶组、叶酸-磁双靶组吞噬率分别为(6.99±0.16)%、(43.36±5.91)%、(28.58±3.23)%、(86.19±0.55)%,差异有统计学意义(F=196.3,P<0.05,图3B),与激光共聚焦显微镜所示结果一致。
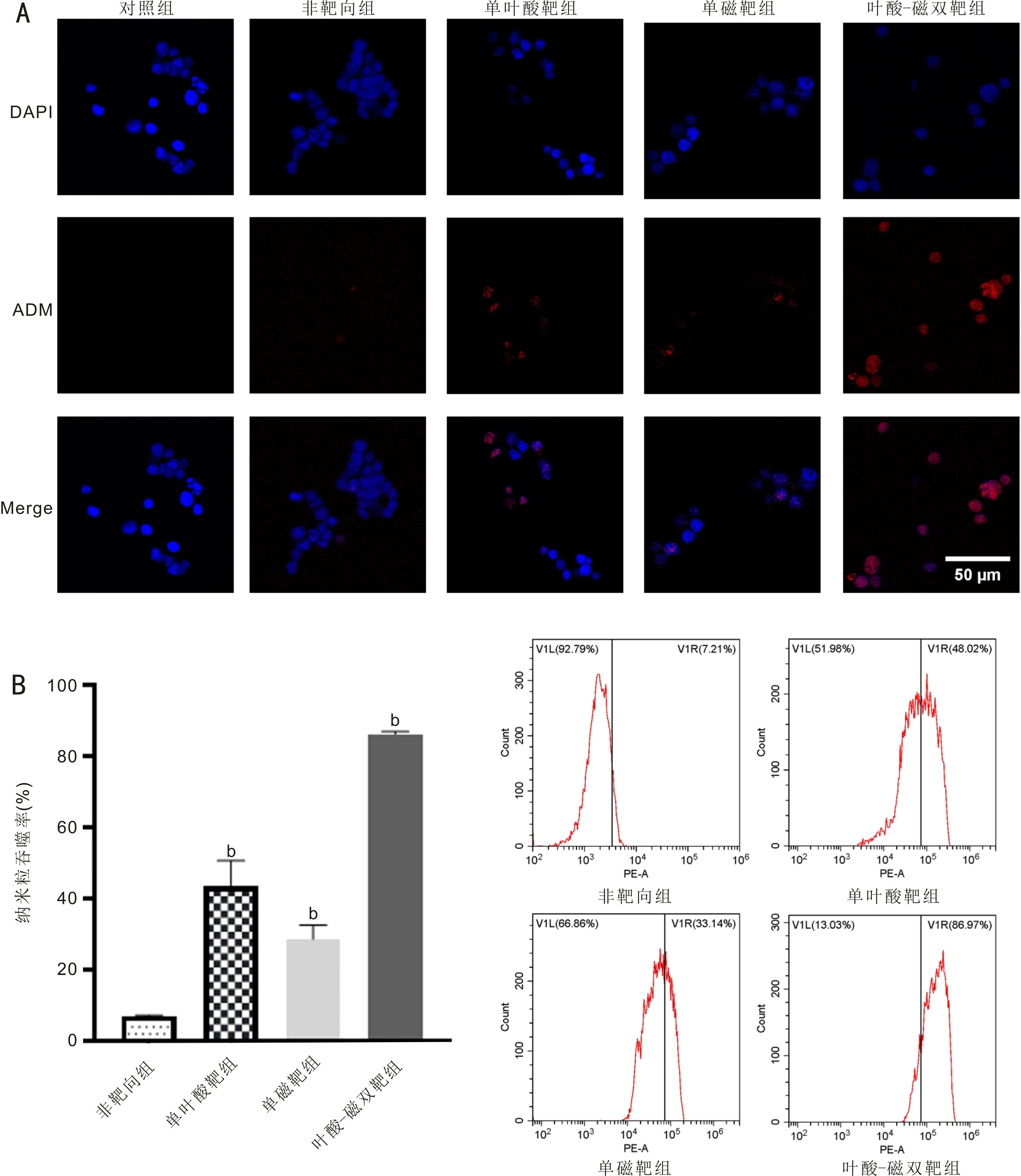
图3 FA-PFH-Fe3O4@ADM纳米粒体外靶向性 A:激光共聚焦显微镜观察各组细胞吞噬纳米粒情况;B:流式细胞学检测各组细胞吞噬纳米粒情况,bP<0.01 vs 非靶向组。
2.5FA-PFH-Fe3O4@ADM纳米粒体外超声/光声/MRI三模态成像体外超声成像结果显示,FA-PFH-Fe3O4@ADM纳米粒在808nm激光辐射后,超声信号明显增强,且在B模式和造影模式下,平均声强值与激光辐照时间均呈明显正相关(R2=0.9812、0.9426,图4A)。体外光声成像结果显示,FA-PFH-Fe3O4@ADM纳米粒有明显的光声成像能力,其平均光声信号值与纳米粒浓度呈明显正相关(R2=0.9721,图4B)。体外MRI结果显示,随着纳米粒浓度的增加,其平均信号值逐渐降低,呈明显负相关(R2=0.9905,图4C),FA-PFH-Fe3O4@ADM纳米粒r2值为43.73mM-1S-1。
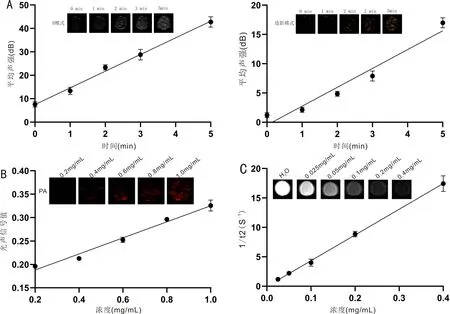
图4 FA-PFH-Fe3O4@ADM纳米粒体外超声/光声/MRI三模态成像 A:纳米粒在B模式和造影模式下经808nm激光激发不同时间后体外超声成像图及声强分析;B:不同浓度纳米粒体外光声成像图及光声信号分析;C:不同浓度纳米粒体外MRI图及信号分析。
3讨论
临床上通常使用眼底检查、眼部B超、MRI检查、荧光素眼底血管造影等手段确诊RB,但这些检查往往难以查明早期病变,从而延误治疗[14]。因此,目前仍然急需能够在出现明显可见的形态学改变之前,及早发现RB的诊断方法。近年来,分子成像技术逐渐被运用到各类恶性肿瘤的研究中[15-16],其可视化、靶向、无创等优点在RB的早期诊疗上很有发展前景。基于临床上的迫切需求,本研究结合分子影像学技术构建了一种新型多功能纳米分子探针FA-PFH-Fe3O4@ADM,其作为载体可以将药物递送至靶部位,进行无创、实时、精细显像。本研究成功使用双乳化法,以生物相容性好、易载药、易修饰的脂质体[17]作为载体,制备了双靶向多模态成像分子探针。
高效的靶向性是分子探针发挥效用的基础,本研究制备的FA-PFH-Fe3O4@ADM纳米粒平均粒径仅338.6±2.20nm,可以穿过血管内皮细胞到达肿瘤部位,通过实体瘤的高通透性和滞留效应被动聚集于肿瘤组织,但其作用能力有限。主动靶向作用能使纳米粒更高效地聚集于目标组织,其中配体-受体介导的主动靶向及磁靶向是近年研究的热点。叶酸受体在多种恶性肿瘤高表达[18],具有叶酸靶向功能的纳米粒已成功应用于多种恶性肿瘤的诊疗,Wu等[19]制备的叶酸靶向纳米分子探针可通过与RB细胞表面的叶酸受体结合,特异性地聚集于RB细胞周围。但由于特异性受体具有饱和效应及肿瘤微环境的阻碍,导致配体修饰型主动靶向探针的靶向能力受到一定限制。磁靶向是一种新型主动靶向模式,Suciu等[20]发现SPION作为磁靶,在外加磁场的作用下会聚集在作用部位,并且具有稳定、高效、低毒的特点。基于以上研究,结合本课题组前期对叶酸-磁双靶向纳米粒的探索[21],本研究将配体-受体介导的分子靶向的特异性与磁靶向的高效性相结合,构建了双靶向分子探针。寻靶实验验证了FA-PFH-Fe3O4@ADM纳米粒的双重靶向性能,叶酸-磁双靶组视网膜母细胞瘤Y79细胞吞噬纳米粒的数量约为单叶酸靶组和单磁靶组的2~3倍,实现了探针在Y79细胞内的高效聚集。
目前,分子成像技术包括超声、电子计算机断层扫描(CT)、荧光、MRI、单光子发射计算机断层扫描仪/正电子发射计算机断层扫描(SPECT/PET)等,单一成像技术难以满足临床多样化的需求,集其中多种成像优势于一体的多模态造影剂是研究的热点。Xiao等[22]制备的以PFH为内核的相变型纳米超声分子,能够通过近红外激光的激发,发生光致相变,将PFH由液态转变成气态,即液气相变,从而增强超声显影,实现了肿瘤的早期诊断。光声成像是一种新型的成像方式,通过物质吸收光产生超声信号,具有高对比度和分辨率。MRI是临床常用的RB诊断方式,SPION作为美国食品药品监督管理局(FDA)认证用于肿瘤的磁共振显像剂,可以准确提供肿瘤及其周边组织信息。Sivakumar等[23]设计的靶向纳米复合材料中,SPION既可以通过吸收近红外光进行光声成像,也可以通过对T2像的负性增强来进行磁共振成像。结合以上研究,本研究制备的FA-PFH-Fe3O4@ADM纳米粒在体外通过激光激发可增强超声/光声成像,且以SPION作为T2对比剂增强了磁共振成像,实现了实时全面精准的成像。
此外,Dolatkhah等[24]制备了GO-SPION-MTX纳米复合材料,其中SPION在近红外光的作用下具有光热转换能力,可以对乳腺癌进行光热治疗。本研究探究了在808nm激光作用下FA-PFH-Fe3O4@ADM的光热性能,证明纳米粒有进行光热治疗的潜力。与此同时,随着纳米粒温度升高,PFH发生液气相变,有利于化疗药物的释放。由此可见,FA-PFH-Fe3O4@ADM纳米粒具有激光作用下治疗RB的潜力,但其治疗效果和作用机制还有待进一步研究。
综上所述,本研究成功制备了叶酸靶向联合磁靶向、包裹ADM的相变型纳米粒(FA-PFH-Fe3O4@ADM),在优化的叶酸-磁双靶作用下,纳米粒在视网膜母细胞瘤Y79细胞内大量聚集,并进行了体外超声/光声/MRI三模态显像,实现了体外精准靶向及显像,为RB的早期诊断带来了新的希望。与此同时,FA-PFH-Fe3O4@ADM纳米粒具有光热效应并能在激光下发生光致相变,为进一步的光热联合化疗奠定了基础。
