甘草附子汤对膝关节骨关节炎大鼠NF-κB信号通路的影响
2022-12-08赵杰苏启表李之琛邹瑜聪刘晓钦邱学军
赵杰,苏启表,李之琛,邹瑜聪,刘晓钦,邱学军,3
(1.广东药科大学健康学院,广东 广州 510000;2.广州医科大学附属第一医院关节外科,广东 广州 510000;3.广东省光与健康工程技术研究中心,广东 广州 510000)
膝关节骨关节炎(knee osteoarthritis,KOA)是一种以关节软骨的磨损退变并伴随膝关节周围骨赘增生的关节退行性疾病。随着KOA的病理进展,患者膝关节将有不同程度的关节畸形、活动障碍、关节疼痛、肌肉萎缩等临床表现,终末期KOA 严重影响患者的生活质量。临床报道甘草附子汤(GCFZ)对KOA 具有一定疗效,但其作用机制尚不明确[1-2]。本实验探讨GCFZ 对KOA 大鼠的作用及相关分子机制,为其应用于KOA的治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级SD 雄性大鼠,体质量200~220 g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2019-0035;动物饲养于SPF 实验室,正式实验前适应性饲养1周。
1.1.2 药物、试剂和仪器 中药饮片炙甘草、淡附片、白术、桂枝均购自广东康美药业有限公司(批号分别为200108、200203、191020、191221)。木瓜蛋白酶、L-半胱氨酸购自美国Sigma-Aldric 公司(批号分别为:19812TE、158K1284);BCA 蛋白定量分析试剂盒购自上海碧云天生物技术有限公司(货号:P001S);大鼠IL-6、TNF-α和IL-1βElisa 试剂盒购自深圳达科为生物技术有限公司(批号分别为:
372019121、392020019、152019113 );P65、IκBα、p-IκBα及β-actin 抗体购自美国CST 公司(货号:9936);IKKα/β和p-IKKα/β抗体购自英国ABCam公司(批号分别为:ab235402、ab244563);逆转录试剂盒购自大连Takara 公司(批号:RR047A);双氯芬酸钠购自广东台城制药股份有限公司(批号:201908015);引物由上海生工生物工程公司合成。Multiskan Sky 全波长酶标仪购自美国Thermo Fisher 公司;37450 电子触觉测试仪购自意大利Ugo Basile 公司;SDS 电泳系统、湿转膜系统购自美国Bio-Rad 公司;FluorChem R 多功能成像分析系统购自美国Proteinsimple 公司;ABI7500 基因扩增仪购自美国Applied Biosystems 公司;600R 双足平衡测痛仪购自美国IITC公司。
1.2 方法
1.2.1 药物制备 GCFZ 制备方法如下:称取炙甘草15 g、淡附片15 g、白术15 g、桂枝30 g,全方用10 倍量水浸泡30 min后煎煮30 min,反复煎煮2次,合并煎液,过滤减压浓缩至含生药质量浓度为1 g/mL 的溶液,置4 ℃冰箱保存,临用前用生理盐水稀释至所需浓度。木瓜蛋白酶混合液制备:在无菌条件下用生理盐水将木瓜蛋白酶、L-半胱氨酸分别配制成质量浓度为0.04 g/mL、0.03 mol/L 的溶液,置4 ℃冰箱保存,于实验前将木瓜蛋白酶溶液与L-半胱氨酸溶液按体积比2∶1混匀,静置10 min备用。阳性药物双氯芬酸钠临用前用生理盐水稀释至浓度为0.25 mg/mL的溶液备用。
1.2.2 动物分组、模型建立及给药[3]采用随机数字表法将大鼠分为空白组、模型组、阳性药物组、GCFZ高剂量组和低剂量组,每组8只。模型建立方法:以造模当天计为第1 天,于第1、4、7 天,麻醉大鼠后将其仰卧位固定,空白组每只大鼠右侧膝关节腔注射生理盐水0.2 mL,其余4 组注射木瓜蛋白酶混合液0.2 mL。第2 天,空白组和模型组均给予生理盐水;阳性药物组给予双氯芬酸钠溶液,剂量为0.002 5 g/kg;GCFZ 高剂量组和低剂量组分别给予GCFZ 9.0 g/kg、4.5 g/kg,各组动物每天灌胃1 次,给药容积均为10 mL/kg,连续灌胃至第28天。
1.2.3 大鼠膝关节宽度测定[4]在第1天造模前和第14、28 天采用电子游标卡尺测定大鼠膝关节宽度,观察膝关节肿胀情况。
1.2.4 机械性痛阈测定[5]按照文献采用电子触觉测试仪测定大鼠机械刺激缩爪阈值(paw with‐drawal threshold,PWT),测定时间与“1.2.3”项相同。方法如下:将刺激针对准大鼠后爪足底并逐渐增加刺激压力,大鼠感觉到痛觉瞬间出现缩足、舔脚等阳性反应时移开刺激针,记录此时所给予刺激压力的数值,每只大鼠重复测定3次,每次测定间隔时间为5 min,取其平均值为PWT。
1.2.5 双足平衡法测痛实验[6]将大鼠放入测痛仪测定通道中,使其前足立于通道隔板,两侧后足分别放置于两侧称量踏板,待仪器检测数值稳定后,按下开始键记录此时双侧下肢的负重值,连续测量3 次,每次测定间隔时间为3 min,计算其平均值,按公式计算右下肢负重百分比。右下肢负重百分比=100×右下肢负重值/(右下肢负重值+左下肢负重值),测定时间与“1.2.3”项相同。
1.2.6 Elisa法检测大鼠膝关节腔关节液TNF-α、IL-6和IL-1β水平[7]第28天灌胃4 h后,麻醉大鼠于右侧膝关节腔穿刺取关节液,并用100 μL PBS 灌洗关节腔,收集灌洗液,3 500 r/min离心10 min,取上清液按ELISA试剂盒说明书检测TNF-α、IL-6和IL-1β水平。
1.2.7 RT-PCR方法检测膝关节滑膜组织TNF-α、IL-6和IL-1βmRNA表达情况[8]第28天处死动物后分离收集大鼠右侧膝关节滑膜组织,称取30 mg剪碎加入1 mL Trizol试剂,冰浴中迅速匀浆,按文献[8]提取总RNA,用核酸蛋白仪检测RNA浓度,取1 μg总RNA使用cDNA 第一链合成试剂盒对样本逆转录合成cDNA,用Sybr Green RT-PCR Master Mix配置20 μL反应体系,置PCR仪进行PCR扩增,记录PCR反应过程中的Ct值,以GAPDH为内参,采用2-△△Ct计算TNFα、IL-6和IL-1βmRNA相对表达量。引物序列见表1。

表1 RT-PCR引物序列Table 1 Primer sequences for RT-PCR
1.2.8 Western blot 方法检测滑膜组织p65、IκBα、p-IκBα、IKKα/β、p-IKKα/β蛋白表达情况[8]第28天,处死动物后称取30 mg 大鼠右侧膝关节滑膜组织,提取组织总蛋白,采用BCA 法测蛋白浓度。取适量体积的蛋白样品20µg 与去离子水和2×SDS 加样染料混合均匀后,置蛋白变性仪97 ℃加热5 min,使蛋白质变性,然后进行SDS-PAGE 电泳分离目标蛋白,电泳条件:80 V,30 min;120 V,70 min,随后采用250 mA 恒流条件下转膜90 min 将电泳分离后的蛋白转移至PVDF 膜,用5%脱脂奶粉封闭1 h,TBST 洗涤5次,5 min/次,放入含相应一抗的稀释液(一抗用5% BSA 溶液按1∶1 000 稀释),4 ℃孵育过夜,TBST 洗涤3 次,10 min/次,然后加入HRP 标记的二抗室温孵育1 h,TBST 洗涤3 次,10 min/次,采用ECL化学发光法显影检测蛋白表达情况。
1.2.9 统计分析 采用软件SPSS 25.0进行统计学处理,计量数据以表示,组间多重比较采用One-way ANOVA 分析,方差齐时采用LSD 法,方差不齐时采用Dunnett'sT3法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠膝关节宽度比较
第1天造模前,比较各组大鼠膝关节宽度,差异无统计学意义(P>0.05),组间具有可比性。第14、28 天,与空白组比较,模型组膝关节宽度显著增加,肿胀明显(P<0.01);与模型组比较,3 个给药组(阳性药物组、GCFZ 高、低剂量组)膝关节宽度均显著下降(P<0.01),抑制关节肿胀效果明显。见图1。

图1 各组大鼠膝关节宽度比较Figure 1 Comparison of knee joint width of rats in each group
2.2 各组大鼠机械性痛阈比较
造模前,比较各组大鼠PWT,差异无统计学意义(P>0.05)。第14、28 天,与空白组比较,模型组PWT 显著下降(P<0.01);与模型组比较,3 个给药组PWT均显著提高(P<0.05,P<0.01)。见图2。

图2 各组大鼠机械性痛阈比较Figure 2 Comparison of mechanical pain threshold of rats in each group
2.3 各组大鼠右下肢负重能力比较
下肢负重力量分布的变化与疼痛行为相关。第1天,各组大鼠右下肢负重百分比约为50,组间差异无统计学意义(P>0.05)。第14,28 天,与空白组比较,模型组右下肢负重百分比显著下降(P<0.01),表明注射木瓜蛋白酶混合液能诱导KOA 大鼠膝关节疼痛,导致双下肢不对称负重明显;与模型组相比,3个给药组均能提高右下肢负重能力(P<0.05,P<0.01)。见图3。
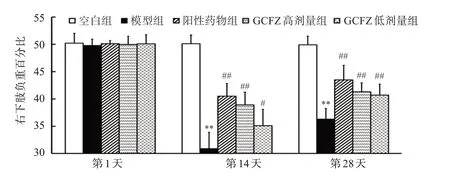
图3 各组大鼠右下肢负重能力比较Figure 3 Comparison of weight-bearing capacity of right lower limb of rats in each group
2.4 各组大鼠膝关节腔关节液炎性细胞因子水平比较
与空白组比较,模型组关节液TNF-α、IL-6和IL-1β浓度均显著增加(P<0.01)。与模型组比较,阳性药物组和GCFZ 高剂量组能明显降低TNF-α水平(P<0.05,P<0.01),GCFZ低剂量组有降低TNF-α水平的趋势,但差异无统计学意义(P>0.05);各给药组均能降低IL-6和IL-1β水平(P<0.05)。见表2。
表2 各组大鼠膝关节腔关节液中炎性细胞因子水平比较Table 2 Comparison of the levels of inflammatory factors in the synovial fluid of knee joint of rats in each group(±s,n=8)ρ/(pg·mL-1)
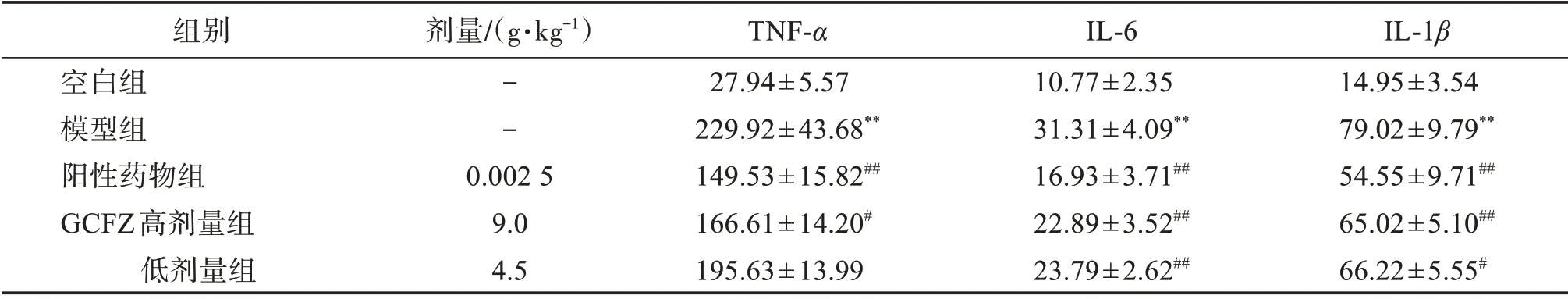
表2 各组大鼠膝关节腔关节液中炎性细胞因子水平比较Table 2 Comparison of the levels of inflammatory factors in the synovial fluid of knee joint of rats in each group(±s,n=8)ρ/(pg·mL-1)
与空白组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01。
IL-1β 14.95±3.54 79.02±9.79**54.55±9.71##65.02±5.10##66.22±5.55#组别空白组模型组阳性药物组GCFZ高剂量组低剂量组剂量/(g·kg-1)--0.002 5 9.0 4.5 TNF-α 27.94±5.57 229.92±43.68**149.53±15.82##166.61±14.20#195.63±13.99 IL-6 10.77±2.35 31.31±4.09**16.93±3.71##22.89±3.52##23.79±2.62##
2.5 各组大鼠膝关节滑膜组织TNF-α、IL-6 和IL-1β mRNA表达的比较
与空白组比较,模型组大鼠滑膜组织TNF-α、IL-6 和IL-1βmRNA 表达均显著上调(P<0.01);与模型组相比,3个给药组能下调TNF-α、IL-6和IL-1βmRNA表达(P<0.01)。见图4。
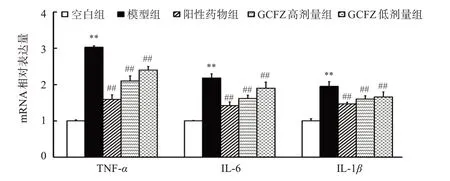
图4 各组大鼠膝关节滑膜组织TNF-α、IL-6和IL-1β mRNA表达的比较Figure 4 Comparison of the expression of TNF-α,IL-6 and IL-1β mRNA in knee joint synovial tissue of rats in each group
2.6 各组大鼠膝关节滑膜组织NF-κB 信号通路相关蛋白表达的比较
如图5A、5B 所示,与空白组比较,模型组大鼠膝关节滑膜组织NF-κB p65 蛋白表达升高,IκBα蛋白表达下降、蛋白降解明显,磷酸化蛋白p-IκBα、p-IKKα/β表达增加。与模型组相比,3 个给药组能明显抑制p65 蛋白表达、抑制IκBα蛋白的降解和磷酸化,并能下调p-IKKα/β蛋白表达。各组对IKKα/β蛋白的表达没有明显差异。
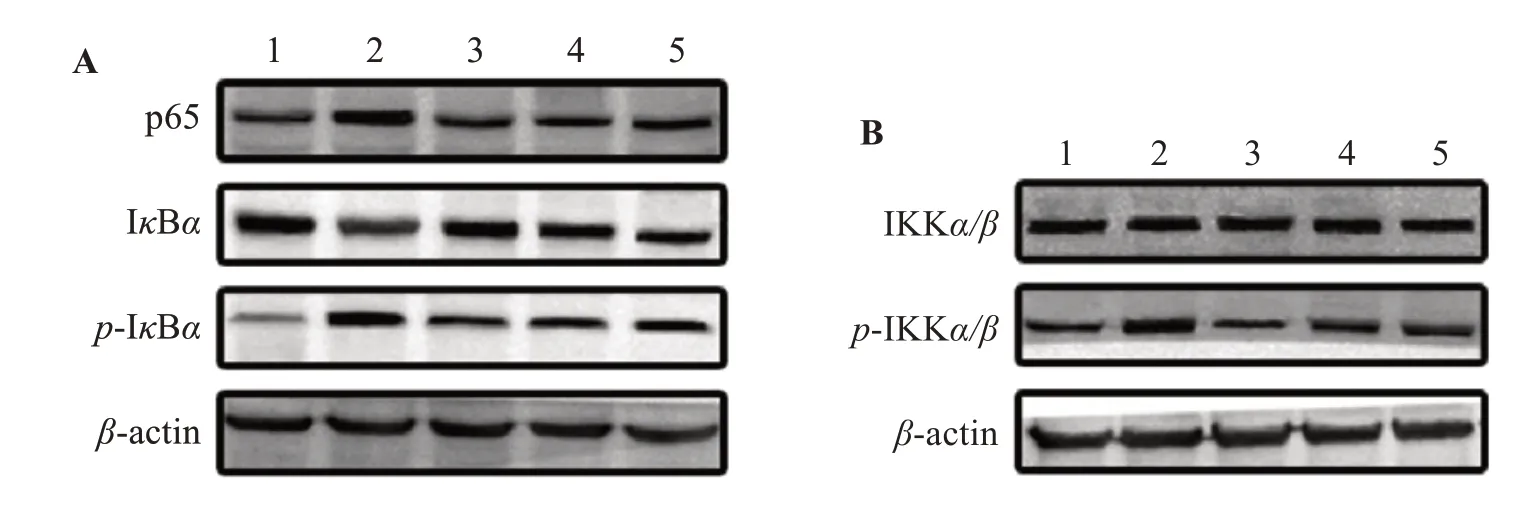
图5 各组大鼠膝关节滑膜组织NF-κB信号通路相关蛋白表达的比较Figure 5 Comparison of the expression of NF-κB signaling-related proteins in knee joint synovial tissue of rats in each group
3 讨论
GCFZ 始载于张仲景的《伤寒论》,临床报道有不少医者应用此方或加味方治疗KOA,可以有效缓解患者症状、改善膝关节功能,但其机制有待研究[1]。
本实验首先采用木瓜蛋白酶和L-半胱氨酸复制KOA大鼠模型,该模型操作简便、动物生存率高,造模型4 周符合早期KOA 的症状表现,是一种较为成熟的造模方法[9-10]。如图1-图3所示,GCFZ能抑制KOA大鼠膝关节宽度增加、提高机械疼痛阈和右下肢负重能力,表明GCFZ 能够缓解早期KOA 大鼠的膝关节肿胀、减轻疼痛,对KOA具有一定疗效。
有研究表明KOA 是一种涉及持续性低度炎症和炎症通路激活的疾病,其发生和加重与炎性细胞因子有着密切联系,关节囊滑膜组织和关节腔内TNF-α、白介素等细胞因子的过度分泌能促进软骨降解、滑膜炎症和软骨下骨的吸收,加快关节软骨退变的速度和炎症的生成,使膝关节的功能活动发生障碍[11-13]。本实验结果显示,GCFZ 能降低KOA大鼠膝关节腔关节液TNF-α、IL-6 和IL-1β的浓度、下调膝关节滑膜组织3 种细胞因子mRNA 的表达,表明GCFZ能够抑制膝关节TNF-α等炎性细胞因子的分泌。
NF-κB 在炎症反应、免疫反应以及正常细胞和恶性细胞的存活中起着重要作用,关节炎、自身免疫性疾病等多种病变均存在NF-κB 通路功能失调的现象[14-15]。有研究表明KOA 患者滑膜组织中存在大量的NF-κB,NF-κB 的激活先于关节炎的临床表现[16-17]。在哺乳动物中,NF-κB 是由多肽链p50 与p65 形成的同源/异源二聚体,该二聚体与IκB 蛋白结合形成三聚体复合物使其处于失活状态。当受创伤、炎性因子的刺激时,细胞膜受体激活导致IκB 激酶(IκBkinases,IKKs)的磷酸化,进一步激活IκB发生磷酸化和泛素化,导致IκB 构象改变并被降解、三聚体复合物的p65和p50从而被释放,NF-κB进入细胞核启动和调控TNF-α、IL-1β等靶基因的表达[18-19]。已有研究表明,治疗KOA 的部分药物如阿司匹林、布洛芬等可以抑制IKKα/β活性,进而抑制IκB 磷酸化阻止NF-κB 通路的激活[21]。如图5结果所示,GCFZ可以明显抑制滑膜组织p65的表达,减少IκBα的降解、磷酸化以及IKKα/β的磷酸化,由此推断GCFZ可能是通过介导NF-κB信号通路抑制KOA大鼠膝关节炎性细胞因子的分泌,改善膝关节症状。
综上所述,GCFZ 能缓解KOA 大鼠的膝关节肿胀、减轻疼痛、抑制膝关节炎性细胞因子的分泌,其机制可能与调控NF-κB信号通路的激活有关。
