右美托咪定对急性肺损伤小鼠NLRP3炎性小体介导炎症反应的作用研究
2022-12-08何达张莉
何达,张莉
(榆林市第一医院呼吸内科,陕西 榆林 719000)
急性肺损伤(acute lung injury,ALI)是一种严重的临床并发症,其病死率为30%~40%。ALI 通常以炎症细胞聚集、血管和上皮通透性增加、间质水肿、气体交换异常和肺泡间隔损伤为特征,但治疗ALI 的有效药物很少[1]。脂多糖(LPS)是革兰阴性菌的一种成分,通常会导致炎症反应和肺损伤[2]。LPS诱导的急性肺损伤是一种广泛应用于ALI病理和药物干预研究的动物模型,体内实验表明鼻内注射LPS 可显著增加炎症细胞浸润、氧化应激和细胞凋亡[3]。
右美托咪定(dexmedetomidine,DEX)是一种高度选择性的α2-肾上腺素能受体激动剂,临床上用于患者的镇静[4]。DEX 具有镇静和镇痛作用,可通过抗炎和免疫调节作用预防LPS 诱导的急性肺损伤[5]。DEX 预处理可通过抑制受Toll 样受体4(TLR-4)/核因子-κB(NF-κB)信号通路,调节细胞因子的产生来减轻败血症引起的急性肺损伤[6]。DEX通过下调高迁移率族box-1 蛋白(HMGB1)和晚期糖基化终末产物(RAGE)通路受体来减轻脓毒症刺激的急性肺损伤。另外,在IL-17 诱导的急性肺损伤小鼠模型中,DEX 以剂量依赖性方式降低了IL-17 的炎症作用,并通过降低连接蛋白-43 蛋白水平抑制间隙连接功能,显着减少LPS 诱导的人肺成纤维细胞系凋亡。近期,有研究发现DEX 通过靶向miR‐381抑制NLRP3炎性小体活化[7]。但DEX是否以剂量依赖性抑制NLRP3 炎性小体活化介导的急性肺损伤尚不清楚,因此,本研究的主要目的是评价不同剂量的DEX 对LPS 诱导的急性肺损伤的保护作用,并探究是否与NLRP3炎性小体介导的炎症反应有关。
1 材料与方法
1.1 主要试剂
右美托咪定注射液购自江苏恒瑞医药(国药准字H20090248);TNF-α(430907)、IL-1β(740865)、IL-6(431307)和MCP-1(446207)小鼠ELISA试剂盒购自BioLegend 生物公司(美国);一抗NLRP3(15101)、ASC(67824)、Caspase-1 p20(24232)、IL-1βp17(12703)和β-Actin(4970)均购自CST 生物公司(美国)。
1.2 实验动物
C57BL/6 小鼠(6~8 周)25 只,雄性,体质量20~25 g,由西安交通大学实验动物中心提供,生产许可证号:SCXK(陕)2020-001。
1.3 分组与给药
将25只小鼠按照随机数表法分为对照组、模型组、DEX 12.5 μg/kg(低剂量)组、DEX 25 μg/kg(中剂量)组和DEX 50 μg/kg(高剂量)组,每组5只。根据文献[6],鼻腔给予10 μg LPS[溶解于50 μL磷酸盐缓冲液(PBS)]诱发急性肺损伤。对照组和模型组均预先30 min腹腔注射生理盐水,DEX 各组按照剂量预先30 min腹腔注射相应剂量的DEX。然后,除对照组外,各组均鼻腔给予LPS,对照组给予PBS。LPS 处理6 h 后,小鼠腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉,然后插入气管插管,用0.4 mL预冷PBS冲洗肺部3次,收集肺泡灌洗液(bronchoalveolar lavage fluid,BALF)以及肺组织。
1.4 BALF炎症因子含量评价
以3 000g离心10 min,收集上清液于EP 管,并储存于-80 ℃或直接检测。使用ELISA试剂盒检测小鼠BALF 中TNF-α、IL-1β、IL-6 和MCP-1 的含量,于450 nm处测量吸光度(A),计算含量。
1.5 肺组织湿质量/干质量(wet-dry weight,W/D)值评价
用滤纸擦拭右肺中叶,并称质量,即湿质量(W)。随后,将肺组织放入烘箱中,在60 ℃下干燥48 h,然后再次称重,即干质量。计算湿质量与干质量比值,即W/D值。
1.6 小鼠BALF总蛋白评价
采用BCA 法测定BALF 蛋白浓度,用于评价肺血管通透性。
1.7 BALF细胞计数
收集BALF,于4 ℃下以400g离心10 min,弃上清,1.0 mL PBS 重悬细胞。固定细胞并离心,加入瑞氏-吉姆萨(Wright-Giemsa)复合染色液评估细胞形态,对于每种细胞类型,采用光学显微镜检查并计算数量。
1.8 病理评价
取右肺上叶组织,放入4%(φ)多聚甲醛中过夜固定,用自来水冲洗5 min,石蜡包埋,切片(5 μm),然后用苏木精和伊红(HE)染色。光学显微镜分析组织病理学。根据出血、肺泡充血、中性粒细胞浸润和肺泡扩张对肺损伤的严重程度进行评分,5分评分系统:0:无;1:轻微;2:适中;3:严重;4:非常严重[8]。
1.9 蛋白印迹
称量约50 mg 肺组织样品,加入含有蛋白酶和磷酸酶抑制剂的蛋白裂解液中裂解30 min。用BCA 蛋白质测定试剂盒测量蛋白质浓度,在10%SDS-聚丙烯酰胺凝胶上分离后,将40 mg 蛋白质电泳转移到PVDF 膜上。将膜用封闭液(5%脱脂奶粉)封闭1 h,然后与特定的一抗(NLRP3、ASC、Caspase-1 p20、IL-1βp17和β-Actin,按1∶1 000稀释)在4 ℃下孵育过夜。第2 天,在用PBST 洗涤3 次后,将膜与HRP 耦联的二抗(1∶10 000 稀释)在室温下再孵育1 h。最后,用增强型化学发光试剂盒显影,并采用Image软件灰度扫描。
1.10 统计学分析
所有计量数据均以表示,使用GraphPad Prism 7.0 软件进行统计分析,采用单向方差分析(ANOVA)进行多组间统计学分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠BALF中炎症因子含量比较
与对照组比较,模型组小鼠BALF 中TNF-α、IL-6、IL-1β和MCP-1含量显著升高;相较于模型组,DEX 低、中、高剂量组小鼠BALF 中TNF-α、IL-6、IL-1β和MCP-1 含量显著降低,差异有统计学意义(P<0.05或P<0.01),见图1。

图1 各组小鼠BALF中炎症因子含量比较Figure 1 Comparison of inflammatory factors in BALF of mice in each group
2.2 各组小鼠肺W/D值和BALF蛋白含量比较
与对照组比较,模型组小鼠肺W/D 值和BALF蛋白含量明显升高;相较于模型组,DEX 低、中、高剂量组小鼠肺W/D 值和BALF 蛋白含量明显下降,差异有统计学意义(P<0.01),见图2。

图2 各组小鼠肺W/D值和BALF蛋白含量比较Figure 2 Comparison of lung W/D value and BALF protein content of mice in each group
2.3 各组小鼠BALF 中总细胞数、中性粒细胞和巨噬细胞数比较
与对照组比较,模型组小鼠BALF总细胞、中性粒细胞和巨噬细胞数显著升高;相较于模型组,DEX 低、中、高剂量组小鼠BALF 总细胞、中性粒细胞和巨噬细胞数显著降低,差异有统计学意义(P<0.05或P<0.01),见图3。
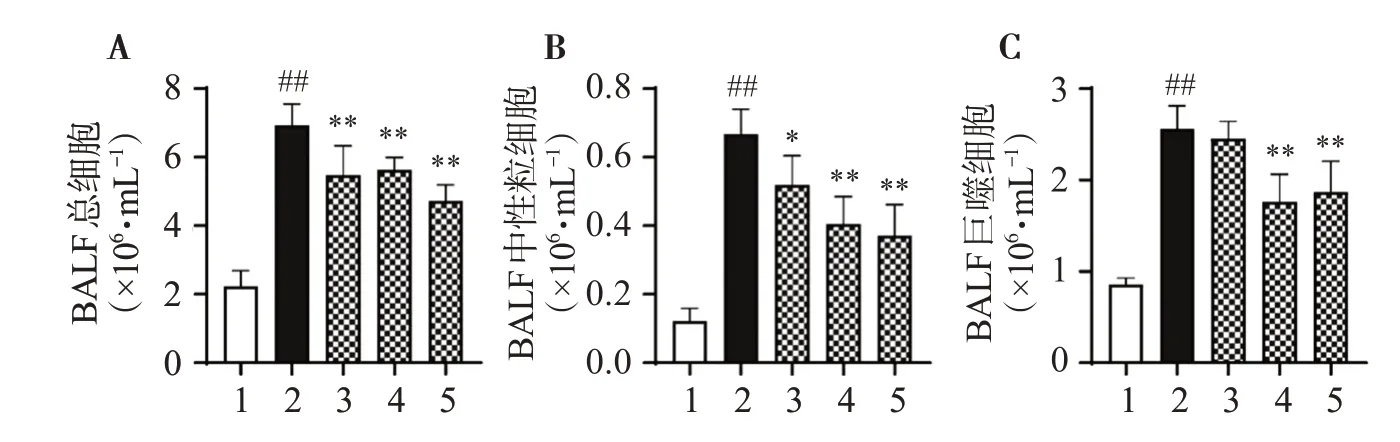
图3 各组小鼠BALF中总细胞数、中性粒细胞和巨噬细胞数量比较结果Figure 3 Comparison of the number of total cells,neutrophils and macrophages in BALF of mice in each group
2.4 各组小鼠肺组织病理HE染色比较
相较于对照组,模型组和低剂量组小鼠观察到肺组织严重的炎症反应(水肿、炎性细胞浸润);相较于模型组,DEX 中剂量组和高剂量组小鼠炎性细胞浸润缓解,表现为肺泡壁厚度和病理评分降低,差异具有统计学意义(P<0.05),见图4。

图4 各组小鼠肺组织病理HE染色比较结果Figure 4 Comparison of HE staining results of lung tissue pathology of mice in each group
2.5 各组小鼠肺组织中NLRP3炎性小体表达比较
与对照组比较,模型组小鼠肺组织中NLRP3、ASC、Caspase-1 p20 和IL-1βp17 蛋白表达水平显著升高;相较于模型组小鼠,DEX 低、中、高剂量组小鼠肺组织中NLRP3、ASC、Caspase-1 p20 和IL-1βp20 蛋白表达水平显著降低,差异有统计学意义(P<0.05),见图5。

图5 各组小鼠肺组织中NLRP3炎性小体表达比较结果Figure 5 Comparison of the expression of NLRP3 inflammasome in lung tissues of mice in each group
3 讨论
脓毒症是ALI 的常见原因,约占所有ARDS 病例的25%[9]。LPS 诱导的ALI 具有多种病理生理学特征,并与相互关联的炎症级联反应发展有关;促炎细胞因子在导致肺损伤的炎症反应发生和发展过程中具有重要作用[10-11]。LPS 诱导的ALI 模型与肺中性粒细胞的积累和巨噬细胞的激活有关,促进炎症细胞因子和细胞的释放,增加肺泡-毛细血管通透性。本研究发现DEX 治疗组小鼠BALF 中总细胞和中性粒细胞明显降低,BALF 蛋白含量降低,这些结果说明DEX 能有效降低ALI 小鼠的肺泡-毛细血管通透性。同时,DEX 明显降低了ALI 小鼠BALF 中炎症因子TNF-α、IL-1β、IL-6 和MCP-1 含量,这些因子与炎性细胞浸润肺部密切相关[12-13]。ALI 的病理特征表现为多形核中性粒细胞、纤维蛋白沉积物、肺泡出血和肺水肿液积聚相关的急性炎症反应[14-15]。和预期的一样,DEX 明显缓解了ALI小鼠的肺部病理损伤,包括炎性细胞浸润缓解,即肺泡壁厚度和病理评分降低。这些说明DEX 具有明显的抗ALI 小鼠的肺部炎症反应,并且给药浓度为12.5 μg/kg 时,依然具有显著的抗炎活性,包括缓解肺泡-血管通透性和炎症因子产生。
据报道,DEX预处理可上调Cav-1的表达,降低髓过氧化物酶活性和炎症细胞浸润,缓解肺组织病理损伤,抑制炎症反应以减轻LPS 诱导的ALI[16]。另外,DEX 能抑制ALI 小鼠肺组织TLR-4 和NF-κB的表达,并且DEX 通过抑制HMGB1 介导的TLR-4/NF-κB 和PI3K/Akt/mTOR 途径从而缓解LPS 诱导的急性肺损伤[17]。除了抗炎反应外,DEX 通过抑制间隙连接蛋白和降低连接蛋白-43 的蛋白表达减少LPS 诱导的肺成纤维细胞凋亡,并维持肺泡-毛细血管的通透性[18]。DEX 也通过激活Nrf2/Keap1 信号通路和调节抗氧化基因的表达改善LPS 诱导的肺部炎症和氧化应激[19]。上述文献报道了DEX 的抗炎相关通路,但大多涉及TLR4 介导的信号途径。近期有研究[20]发现DEX(25 μg/kg)通过靶向miR‐381 抑制ALI 小鼠肺组织中NLRP3 炎性小体活化,但DEX 是否呈剂量依赖性抑制ALI 小鼠NLRP3 炎性小体活化尚不清楚。本研究探讨了不同剂量的DEX对NLRP3炎性小体活性的影响。
炎性小体是一类位于细胞质多蛋白复合物,在先天免疫中发挥重要作用,炎性小体控制促炎细胞因子的成熟和分泌,包括IL-1β、IL-18 和细胞焦亡。NLRP3 炎性小体由NOD 样受体(NLRP3)、衔接蛋白ASC 和Caspase-1 组成,是一种重要的细胞内多蛋白炎症复合体[21]。在各种刺激(微生物和应激物质等)下,NLRP3、ASC 和pro-Caspase-1 组装,形成聚合体,切割pro-Caspase-1 激活Caspase-1,并切割pro-IL-1β形成成熟的IL-1β[22]。之前研究发现DEX(25 μg/kg)能抑制ALI小鼠肺组织中NLRP3和Caspase-1 p20 的表达,并降低血清IL-1β水平[7]。本研究结果发现DEX 不仅能抑制ALI 小鼠肺组织中NLRP3 和Caspase-1 p20 表达,并降低ASC(炎性小体组装的关键蛋白)和IL-1βp17(即成熟型IL-1β)表达。这些结果说明DEX 可能是通过抑制ALI 小鼠肺组织中NLRP3 炎性小体的活化而降低ALI 小鼠全身炎症反应(即血清炎症因子水平降低),并缓解组织损伤。
综上所述,本研究发现DEX 对LPS 诱导的ALI小鼠具有保护作用,包括缓解肺损伤、肺水肿和炎症反应,并呈剂量依赖性抑制NLRP3 炎性小体活化。但DEX 的抗炎作用涉及多种信号通路,包括TLR4 介导的信号等,这些信号之间是否密切相关或涉及其他信号调节仍不清楚。后续研究会进一步研究DEX抗ALI损伤的确切机制。
