高效液相色谱法和酶放大免疫法检测伏立康唑血药浓度相关性分析*
2022-12-08李俊明卓思珺陈仕鹏刘成裕谢瑞杰
李俊明,卓思珺,陈仕鹏,刘成裕,谢瑞杰
(广西壮族自治区柳州市人民医院药学部,广西 柳州 545006)
伏立康唑(VRC)为三唑类抗真菌药,抗菌活性强、抗菌谱广,临床应用广泛[1-2]。VRC在体内呈非线性代谢、个体差异大,剂量与血药浓度相关性不稳定,应针对患者具体情况并结合血药浓度结果制订个体化用药方案,最大限度发挥疗效、减少药品不良反应[3-5]。高效液相色谱(HPLC)法为检测VRC血药浓度的常用方法[6],而近年酶放大免疫(EMIT)法也逐步用于血药浓度检测[7-8]。为探讨这两种检测方法对VRC血药浓度的影响,本研究中收集VRC达稳态血药浓度的真菌感染患者血液样本59份,分别使用两种方法进行测定,分析测定结果的相关性,并对我院两种检测方法结果进行比较分析,以便临床正确解读检测数据,调整用药方案。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:年龄2~90岁;采血时VRC已达稳态浓度(即负荷给药24 h后或常规给药6 d后)。
排除标准:标本量<4 mL;标本溶血。
样本收集:收集医院2019年至2020年住院和门诊患者常规VRC检测样本2 045份,2019年收集1 054份,其中59份采用2种方法平行检测,其余均采用HPLC法检测;2020年收集991份,均采用EMIT法检测。
1.2 血药浓度检测方法
1.2.1 HPLC法
色谱条件:色谱柱为Hypersil ODS柱(250 mm×4.6 mm,5 μm);流动相为25 mmol/L KH2PO4缓冲液-甲醇-乙腈(55∶15∶30,V/V/V);流速为1.0 mL/min;检测波长为256 nm;柱温为35℃;进样量为10 μL。
样本处理及内标选择:采用10 % HClO4溶液沉淀蛋白法前处理血清样本,以硝西泮作内标。
方法学考察:按相关规定进行精密度、稳定性、重复性试验考察。结果表明,仪器精密度良好,供试品溶液在室温下放置12 h内基本稳定,方法重复性良好。
1.2.2 EMIT法
按照Viva-E型全自动生化分析仪(西门子医学诊断产品有限公司,定量范围为0.5~16.0 μg/mL)的操作规范。取血液样本,5 000 r/min离心5 min,取上清液,采用EMIT VRC测定试剂检测。
1.3 统计学处理
采用SPSS 18.0及MedCalc 19.0.4统计学软件分析。组间差异采用双侧配对t检验、配对Wilcoxon检验、Passing-Bablok法和Bland-Altman法分析,并对测定结果进行一致性评价。
2 结果
2.1 VRC血药浓度检测结果相关性分析
结果见表1。计算可知,两种检测方法测得的VRC血药浓度结果具有高度相关性(r=0.879,P<0.05)。
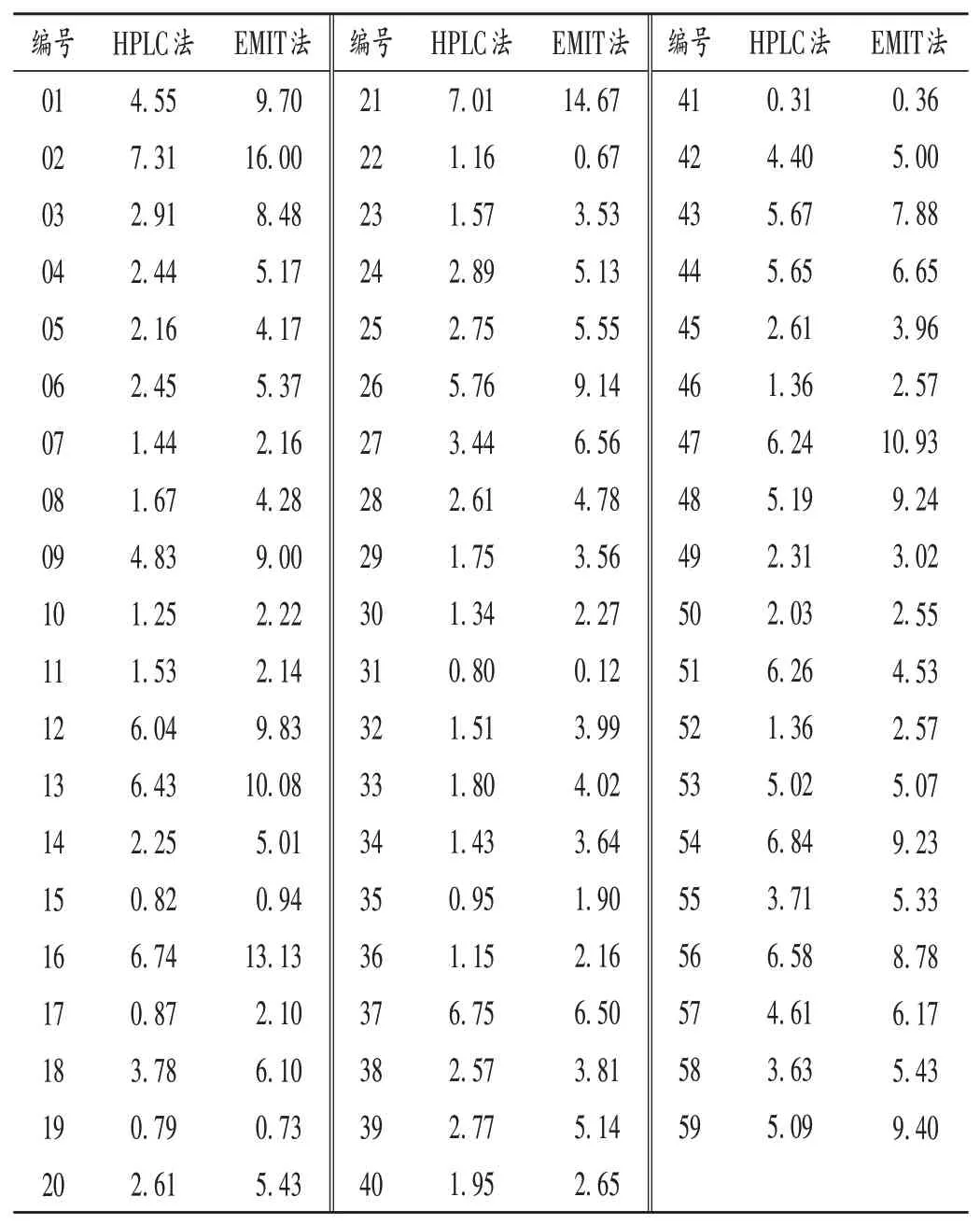
表1 HPLC法及EMIT法VRC血药浓度检测结果(μg/mL,n=59)Tab.1 Results of serum drug concentration determined by HPLC and EMIT(μg/mL,n=59)
2.2 检测模型建立及相关性分析
59份样本的配对样本t检验分析显示,两种检测方法结果间存在显著差异。以EMIT法血药浓度(CEMIT)测定结果(Y,μg/mL)为纵坐标,HPLC法血药浓度(CHPLC)测定结果(X,μg/mL)为横坐标,建立回归方程Y=0.054 7+1.743X(n=59),Spearman相关系数为0.923(图1 A);配对Wilcoxon测试分析结果显示,两种方法结果间存在显著差异。分别以两种检测方法结果的差值(CHPLC-CEMIT)和均值(CHPLC&EMIT)为纵坐标和横坐标,以95%的置信区间设定血药浓度的上下限,绘制Bland-Altman偏差图(图1 B)。结果显示,CEMIT为(5.432 2±3.487 98)μg/mL,高 于HPLC法 的(3.283 1±2.052 87)μg/mL,差值的均数(d)值的94.9%(56/59)在95%置信度内。可见,Wilcoxon检验和Bland-Altman分析结果均显示两种检测方法的一致性差。
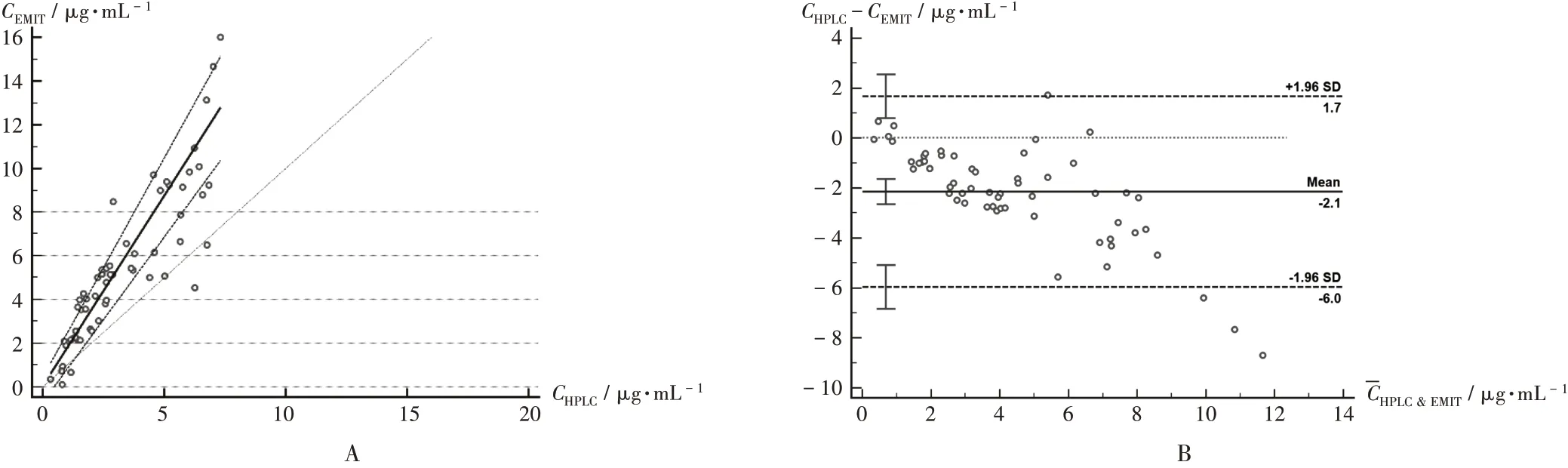
图1 同一质量浓度下两种检测方法血药浓度结果分析A.Linear regression chart B.Bland-Altman deviation plotFig.1 Serum drug concentration determined by two methods at the same mass concentration
2.3 不同质量浓度范围的两种检测方法相关性分析
HPLC法 检 测VRC有 效 谷 浓 度(Cmin)范 围 为1.0~5.5 μg/mL[3,7-8]。按3个质量浓度范围,将59份样本分为A组(<1.0 μg/mL,6份)、B组(1.0~5.5 μg/mL,40份)和C组(>5.5 μg/mL,13份),并采用Wilcoxon检 验,Passing-Bablok回 归 和Bland-Altman分 析。A组、B组、C组 的 回 归 方 程 分 别 为Y1=-5.110+7.385X1(n=6),Y2=-0.012 4+1.853X2(n=40),Y3=-38.494+7.584X3(n=13),Spearman相关系数分别为0.771,0.878,0.505。结果表明,A组和B组两种检测方法相关性较好,而C组相关性较差。Wilcoxon检验结果显示,两种检测方法结果在3个质量浓度范围内均有显著差异;Bland-Altman分析结果表明,CEMIT分别比CHPLC高0.27,2.03,3.39 μg/mL,表明3个质量浓度范围的一致性差。详见图2。
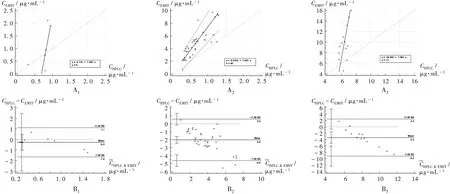
图2 不同质量浓度下两种检测方法血药浓度结果分析A1,B1.Mass concentration<1.0 μg/mL A2,B2.Mass concentration of 1.0-5.5 μg/mL A3,B3.Mass concentration>5.5 μg/mL A.Passing-Bablok regression analysis chart B.Bland-Altman deviation plotFig.2 Serum drug concentration determined by two methods under different mass concentrations
2.4 我院患者VRC血药浓度检测结果
2 045份样本主要来源于重症医学科、血液科、呼吸科(2019年占92.98%,2020年占92.23%),患者年龄和血药浓度均符合正态分布。血药浓度,HPLC法测定结果C为(2.67±1.88)μg/mL,最大血药浓度为11.76 μg/mL;EMIT法测定结果C为(4.18±2.69)μg/mL,有3例超过峰浓度(16.0 μg/mL)。详见表2。

表2 我院患者VRC血药浓度测定结果(n=2 045)Tab.2 Determination results of VRC serum concentration in patients in our hospital(n=2 045)
3 讨论
HPLC法被临床广泛用于测定各种药物的血药浓度[9-10],具有灵敏度高、专属性强的优点。但HPLC法测定前需对样本进行前处理,等待时间长且测定过程复杂,不适用于大样本量分析测定[11]。EMIT法属酶免疫分析技术,其检测基于样本中的药物与葡萄糖-6-磷酸脱氢酶(G6PD)标记的药物竞争抗体结合位点,与抗体结合后,酶活性发生改变,根据酶活性来确定样本中待测药物的浓度[12]。EMIT法所需样本体积较小,一直是临床用于确定内源性和外源性物质的工具,具有自动化程度高,样本处理简单、快速的优点,适用于急诊和大样本量分析测定。但EMIT法是利用抗原-抗体相互识别并结合来产生检测信号,与待测药物具有相同的抗原表面标志(如代谢物、内源性物质等)或抗体有多个抗原结合位点时,会干扰检测结果;同时,样本质量、环境温度等因素也显著影响检测结果。因而其灵敏度和准确性相对较低。EMIT法测定人血浆中VRC浓度时,可能无法区分药物与VRC类似物或代谢产物,导致产生的值更高影响结果[13-14]。
目前,关于VRC目标血药浓度和用药方案调整推荐的研究中多数是基于HPLC法的检测结果。丁记者等[14]及阚智慧[15]对样本进行对比研究,均发现两种检测方法具有明显的相关性和一致性,LI等[13]对比了419例儿童样本的测定结果,发现两种检测方法存在明显相关性,但EMIT法测定结果显著高于HPLC法。本研究结果显示,两种检测方法存在较好的相关性,但总体上EMIT法与HPLC法测定结果有显著差异。在0~5.5 μg/mL范围内两种检测方法具有很好的相关性。Wilcoxon测试和Bland-Altman分析表明在3个质量浓度范围,EMIT法结果均较HPLC法高,并存在显著差异。
因本研究中平行对比的样本量偏小,故对我院HPLC法(1 054例)和EMIT法(991例)的测定结果进行回顾性分析以作为补充。结果表明,在样本主要来源科室分布相近、年龄和血药浓度均符合正态分布的情况下,EMIT法较HPLC法测定结果普遍偏高。
上述研究之所以出现不同的结论,可能与样本来源有一定关系,已建立的HPLC法线性范围较窄,样本测定结果较集中,均与治疗窗浓度1.0~5.5 μg/mL接近[15]。丁记者等[14]的研究对象为口服VRC患者,可能病情和所使用药物种类相对简单,而LI等[13]的研究样本主要为儿童,其中大多数接受了造血干细胞移植,同时使用了多种药物造成干扰。本研究中患者主要来源于重症监护室,病情和用药情况复杂,测定结果分布范围宽。另外,造成结论不一与样本量也有一定关系,本研究样本量偏小,回顾性数据欠严谨。因此,关于两种检测方法的相关性和一致性需更大样本量、更进一步的深入研究。
综上所述,EMIT法和HPLC法检测VRC血药浓度时,结果总体相关性良好,鉴于EMIT法存在测定结果偏高的可能,建议在临床检测时,尤其是对于病情复杂、用药品种多的患者,应予以关注并作相应调整,同一患者多次检测应使用同一种方法,以便为临床提供更准确可靠的个体化用药依据。
