酸度对钝化液稳定性影响的理论预测
2022-12-07徐孟进冯慧杰郭安儒
徐孟进,冯慧杰,郭安儒
(1.乐凯胶片股份有限公司,河北 保定 071054;2.河北省新能源膜材料技术创新中心,河北 保定 071054;3.保定市新能源膜材料技术创新中心,河北 保定 071054; 4.航天材料及工艺研究所,北京 100076)
0 前 言
未经防腐处理的铝合金材料在服役环境中容易产生腐蚀[1],由此会带来安全隐患并造成国民经济的损失[2],因此通过研究铝合金的防腐技术以提高其耐腐蚀性具有重要意义。
铝合金表面防腐技术根据工艺的差异可分为微弧氧化技术[3]、阳极氧化技术[4]、电镀[5]及化学镀[6]技术和化学转化膜技术[7]等,其中化学转化膜技术因工艺简单、操作方便、成本低等优点而被广泛应用[8]。化学转化膜的形成主要由3个关键步骤控制:基底腐蚀、液体/基底界面质量传输和转化膜形成[9]。整个过程受到基材在钝化液中持续溶解时钝化液的酸度动态上升驱动,最终形成由不同结构的难溶盐组成的转化膜,因此,对于化学转化膜防腐技术,深入研究钝化液酸度变化对转化膜结构的影响规律显得尤为重要。
化学转化膜主要有稀土盐、磷酸盐以及铬酸盐等类型[10,11],而由于三价铬转化膜毒性低且具有和铬酸盐转化膜媲美的耐蚀性等特点,已成为六价铬最具前景的替代产品[12],是目前钝化液市场的主流。
三价铬转化膜的形成本质是难溶盐的沉淀。因此,可通过研究钝化液酸度变化时不同难溶盐的溶解特性来深入了解转化膜的成膜机理。然而,由于三价铬钝化液中涉及到的物料组分数量较多,不同物质在溶液中存在酸碱中和、电离、配位和水解等作用,过程繁庞复杂,因此对于这种多组分复杂溶液体系,通过计算手段来研究溶液中难溶物溶解度进而推测成膜机理的文献鲜有报道。国内外科研工作者们大都借助对钝化层表面结构的整体认识来反推成膜机理[13-17],因此三价铬体系的钝化层形成机理理论研究仍有很大的提升空间。
余会成[18]首次提出了三价铬钝化层沉积机理模型,可计算出铝合金/钝化液界面处的难溶盐可沉积的临界pH值条件。但由于该模型是将体系中各种难溶盐的沉积条件割裂计算并且忽略了多元配合物的存在,因此仍有改进的空间。巩婧伟等[19]通过计算锅炉钝化液的pH值,以此来准确预测氨水添加量,简化了锅炉漂洗和钝化操作过程,提高了用药经济性。然而,该计算模型依靠简单的酸碱平衡公式,只适用于弱酸弱碱组成的缓冲溶液体系,不适用与具有复杂配位、解离和溶解沉淀平衡的铝合金钝化体系。
本工作首次通过各种化学平衡以及物料守恒和质子守恒方程式建立数学模型,借助计算机求解多元高次方程组,得到三价铬钝化液中各个组分的浓度,便可通过溶度积来判断钝化液中是否有沉淀出现,从而可以预测钝化液的酸度对钝化液中不同难溶盐的沉淀规律。该模型可进一步推广到计算金属铝在钝化液中持续溶解时酸度动态上升引起的不同难溶盐的沉淀过程,可深入研究铝合金/钝化层界面层的结构形成过程。
1 模型建立
1.1 钝化液体系
研究所选对象为目前市场上有望代替传统六价铬体系的三价铬钝化液体系,包含成膜剂铬盐、配位稳定剂、成膜促进剂、封闭剂和表面活性剂等[20]。
成膜剂一般是以含有Cr、Mo、W、V、Nb、Ta、Ti、Zr的化合物作为主盐,通常以三价铬的盐为主,有时辅以Ti、Zr等离子。这些盐在成膜过程中形成氧化物,强度高,构成钝化膜的骨架,是钝化膜主要成分之一。可供选择的三价铬的盐有硫酸铬、硝酸铬、氯化铬、醋酸铬、磷酸铬、草酸铬等。本研究选用硫酸铬、氟化铬和五氧化二钒的复配为成膜剂。三价铬钝化液中的配位剂,有氟化物(F-离子)、铵盐、有机羧酸及其盐,以及有机膦酸及其酯等。其作用是:参与形成三价铬的混合配位化合物,调节水合三价铬离子的动力学稳定性,能在较宽的pH值范围内稳定Cr3+的浓度,控制成膜反应速率,保证钝化膜耐蚀性的稳定,防止Cr3+形成沉淀,保证钝化液的稳定。本研究选用氟化物和铵盐作为配位剂。对于成膜促进剂,一般采用无机阴离子,如硝酸根、硫酸根、磷酸根等,其作用是维持溶液pH值的稳定,保证钝化过程能正常进行。本研究选用磷酸作为成膜促进剂。
具体的钝化液成分包含硫酸铬,氟化铬,氟化铵,五氧化二钒,硫酸镍,氢氟酸,磷酸和聚丙烯酸,并用氨水调节钝化液的酸度。
1.2 沉淀溶解模型
对于上述成分的钝化液,为了方便计算,初步假定在一定配比下所有物质全部溶解(为了利于模型进一步应用于研究钝化过程中铝的溶解对钝化液成分的影响,将铝也考虑在内;但在计算过程中可设定铝的浓度为零来忽略其作用)。如果所有组分全部电离,此时溶液中存在的离子为Cr3+、SO42-、F-、NH4+、VO2+(过氧钒根,经酸催化五氧化二钒水解电离得到)、Ni2+、H+、PO43-和RCOO-。然而,当进一步考虑配位解离和弱电解质的水解作用时,根据表1和表2的作用方程式,不难看出此时溶液中的主要成分为表3所列。

表1 钝化液中主要电离水解平衡及其相应平衡常数(T=25 ℃,I→0)

表2 钝化液中主要配位解离平衡及其相应平衡常数(T=25 ℃,I→0)

表3 钝化液中离子平衡浓度的符号表示
当溶液达到热力学稳定时,为了便于公式的简洁,采用表3中的符号来表示平衡状态下的离子或分子的平衡浓度。根据物料守恒得到如下公式:
C(F)=a+c+2d+t+2u+δ+2ε+4ζ+5η+6π
(1)
C(Cr)=s+t+u+v+w+x+y+z+α
(2)
C(N)=e+f+ω+2nnh
(3)
C(S)=h+i+nso+vso
(4)
C(Ni)=φ+ω+nnh+noh+nso+nrc
(5)
C(V)=n+o+p+vso+10hvo
(6)
C(P)=j+k+l+m+x+y+τ+2θ+λ+2μ
(7)
C(RCOO)=q+r+z+2α+nrc
(8)
C(Al)=β+δ+ε+ζ+π+ρ+τ+θ+λ+μ
(9)
同时,根据体系得失质子守恒,通过简单整理,得到式(10):
b=ω+2nnh+o+k+y+τ+2θ+2l+2x+2λ+
4μ+3m+r+z+2α+nrc+g+v+2w+ρ+z+
noh-a+C(HF)-d-h-p-vso-f-3C(Al)+0.4hvo
=C(N)+C(P)+C(RCOO)+C(HF)-C(V)-
3C(Al)-2f-e+2o-j+l+x+λ+2μ+2m-
q+g+v+2w+ρ+noh-a-d-h+n+0.4hvo
(10)
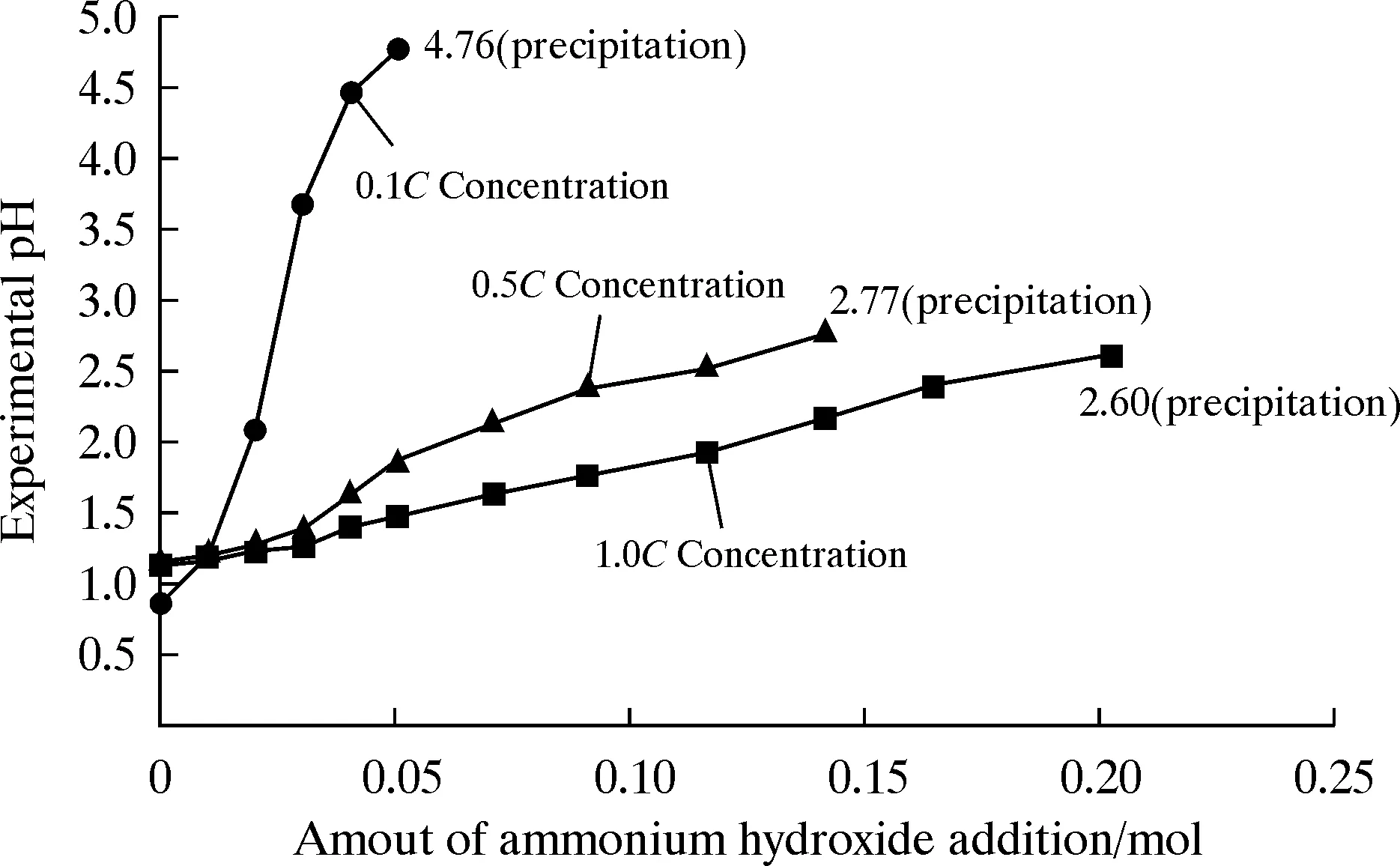
通过联立求解式(1)~(10)方程组,便可以得到在该配比下钝化液中各种离子或分子的浓度。进一步根据表4的溶度积常数,便可判断在该配比下钝化液中难溶物质的状态。比如,求得钝化液中[Cr3+]和[F-]的数值后,计算此钝化液体系中氟化铬的Q(CrF3)=[Cr3+]·[F-]3数值,比较Q(CrF3)和Ksp(CrF3)的大小,如果Q(CrF3)≥Ksp(CrF3),则说明在此配比下钝化液中氟化铬不完全溶解;如果Q(CrF3) 表4 难溶物质的溶度积常数(T=25 ℃,I→0) 为了方便求解式(1)~(10)多元一次方程组,通过表1和表2中平衡常数的数学式可以得到不同离子或分子浓度之间的数值关联式,进而可以将式(1)~(10)简化成以b、c、s、β、m、r、e、φ、i、p为未知数,相应物质的浓度和平衡常数为已知系数的十元高次方程组,辅助计算机手段便可迭代求解该十元高次方程组,进而得到钝化液中各组分的浓度。 然而,表1、表2的平衡常数K均为离子强度趋于零时(I→0)的数值[21-24],公式中的平衡浓度其实指的是活度。对于钝化液体系,其离子强度比较大,此时的离子或分子浓度大于其活度,故需进行平衡常数校正。对于离子强度为0.3 mol/L左右的钝化液,用Davies关系式[21]计算活度系数,并借鉴文献[24]中的方法对各种平衡常数进行迭代校正。 (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) 考虑到便于分析酸度对钝化液稳定性的影响,将除氨水外的其他钝化液组分的配比固定。为了验证钝化液随pH值变化时沉淀现象的计算结果,进行了随氨水添加量变化的钝化液外观趋势试验。为了考察理论模型在不同钝化液离子强度(对应不同钝化液浓度)下的计算偏差规律,进一步对比了相同配比下不同浓度钝化液体系pH值和沉淀现象的试验数据和计算结果。 仪器:90-1型恒温磁力搅拌器,DELTA 320型pH计,ME303电子天平。 试剂:氟化铬,氟化铵,硫酸镍六水合物,氢氟酸(≥40%),磷酸(>85%),氨水(25~28%),五氧化二钒,均为分析纯;硫酸铬,工业级(>95%);聚丙烯酸,工业级(30%)。 往四氟乙烯杯中添加纯水(三级)500 mL,室温搅拌条件下加入定量的氢氟酸、氟化铵、磷酸和聚丙烯酸。快速搅拌均匀,静置30 min。之后在室温搅拌条件下加入硫酸铬、氟化铬、五氧化二钒和硫酸镍,搅拌至溶解,呈澄清透明状,此时,浓度记为1.0C。往1.0C浓度钝化液中添加一定量的纯水,可保证相同钝化液有效成分配比不变,配制成0.5倍和0.1倍浓度的钝化液,分别将浓度记为0.5C和0.1C。 室温搅拌条件下,向等质量上述不同浓度的钝化液中分批次逐步加入定量氨水。每批次滴加时,边滴加氨水边观察是否有沉淀出现,若发现无沉淀出现,该批次氨水滴加结束后继续搅拌30 min,并静置30 min,之后采用pH计测量钝化液的pH值。若观察到有沉淀出现,暂停滴加氨水,继续搅拌,如果沉淀溶解,则继续滴加,直至出现的沉淀不再溶解为止,记录此时的氨水添加量,并测定pH值,此时的pH值为钝化液出现沉淀的试验pH值。出现沉淀后,继续滴加氨水,并记录pH值的变化趋势和沉淀情况。 如上所述,为了便于分析酸度对钝化液稳定性的影响,将除氨水外的其他钝化液组分的配比固定,采用氨水来调节钝化液体系的酸度。 体系的酸度通过多重迭代计算,得到了1.0C钝化液体系的酸度(亦即pH值)随氨水的添加量的理论变化趋势以及试验值(由于钝化液中存在氢氟酸,不能使用玻璃电极来测定其pH值,所以试验是通过采用耐氢氟酸腐蚀的复合锑电极来测定不同氨水添加量下钝化液的pH值),其结果见图1。 图1 1.0C钝化液体系的pH值随氨水添加的变化趋势 不同浓度钝化液体系的试验pH值和沉淀现象随氨水添加的变化趋势如图2所示。由图2可以看出,随着钝化液浓度的下降,钝化液的pH值变化对氨水添加量更为敏感,原因在于同等质量下低浓度钝化液的氢离子更少,加入等量的氨水消耗几乎等量的氢离子,因此加入等量氨水后低浓度钝化液剩余氢离子更少,其pH值变化更大。同时,随着钝化液浓度的下降,出现沉淀所需的pH值更大,原因在于低浓度钝化液中[Cr3+]更小,因此需要更高的[F-]才能达到沉淀所需的Ksp(CrF3),此时就需要较高的pH值来使弱酸氢氟酸的电离平衡向右移动,解离出更多的F-。 图2 不同浓度钝化液体系的实验pH值随氨水添加的变化趋势 为了考察理论模型在不同钝化液离子强度(对应不同钝化液浓度)下的计算偏差规律,进一步对比了不同浓度下钝化液体系pH值和沉淀现象的试验数据与计算值,结果如图3所示。经过与图1对比可知,随着钝化液浓度的降低,钝化液体系pH值的理论值更加接近试验值,并且出现沉淀时两者的误差更小。原因在于:随着钝化液浓度的下降,体系的离子强度变小,使得溶液中离子或分子平衡浓度更加接近活度,因此计算值更为准确。 图3 钝化液体系的pH值随氨水添加的变化趋势 1.0C钝化液中各种难溶盐的Ksp和Qsp大小随氨水添加量的变化趋势如图4所示。由于各溶度积平衡公式中的平衡浓度实指的是活度,比如,Ksp(CrF3)=aCr3+·aF-3=(γCr3+)·[Cr3+]·(γF-·[F-])3, 其中a为活度,γ为活度系数,[F-]指的是F-平衡浓度。因此,为了使得Q和Ksp具有可比性,均采用离子活度替代离子平衡浓度计算Q和Ksp的大小。而离子活度系数受到溶液体系离子强度的影响,随着氨水的添加,体系的离子强度会有微小变化,因此Ksp的大小会随着氨水的添加而有微小变化。 图4 理论模型计算得到的1.0C钝化液体系中各种难溶盐的-lg(Qsp)值和-lg(Ksp)值随氨水添加浓度的变化趋势(离子强度I>>0) 通过比较计算模拟得到的各种难溶盐的Ksp和Qsp大小发现[值得说明的是,Qsp>Ksp对应的是-lg(Ksp)<-lg(Qsp)],氢氧化铬和紫磷酸铬的Qsp在整个试验pH值范围内均小于Ksp,不会造成浑浊现象。但在pH≥3.0时,有难溶物氟化铬的Qsp≥Ksp。因此可以判断,计算过程中随着氨水量的增加,在pH≥3.0时,钝化液体系应该会出现浑浊。同时,理论计算推测在pH≤1.6时,有难溶物磷酸过氧矾的Qsp≥Ksp,因此在低pH值下(不加氨水)应该会有磷酸过氧钒析出,亦即溶液不会澄清透明。 进一步,从图1还可以看出,试验配制的钝化液随着酸度的降低,在pH≥2.5时开始变得不稳定而出现浑浊和沉淀,与计算得到的在pH≥3.0出现沉淀现象大体上吻合。但在高酸度时,钝化液体系是澄清透明的,并没有计算推测的浑浊现象出现。在高pH值区域,计算得到的沉淀现象比试验沉淀现象出现的靠后约0.5个pH值,原因可能在于:(1)通过Davies关系式校正各种平衡常数的方法在高离子强度条件下会存在偏差;(2)试验中用的各种原材料并非都是化学纯,因此按照配比称量的物料并非都是设计值,也就是说某些组分的浓度配比其计算值要高于试验值,因此,会造成沉淀现象靠后。在低pH值区域,计算出现的沉淀现象在试验中并没有发现,原因可能在于过氧钒根含量过少,生成的固体微粒因可以充当表面活性剂的聚丙烯酸的存在而变得稳定不易聚集,因此看不到颗粒沉淀物出现。总体上来说,钝化液体系的稳定性随pH值变化规律的计算结果也大体上能与试验结果相对应。 由图4可以看出,随着氨水的添加,磷酸过氧钒难溶盐的Q和Ksp值差异越来越大,与氟化铬、磷酸铬、紫磷酸铬的趋势相反,说明在该体系中磷酸过氧钒将不会随着氨水的添加而沉淀出来。由于溶液中离子浓度受到配位解离平衡和电离水解平衡的综合影响,而各种离子的配位平衡和分子的电离平衡常数大小存在差异,因此综合计算后,各种难溶盐的Q和Ksp值差异趋势将会有所不同。 基于沉淀溶解平衡、配位解离平衡和电离水解平衡建立了钝化液溶解沉淀模型,经计算结果与试验数据的对比,发现建立的钝化液溶解沉淀模型大体上能反映钝化液的酸度对稳定性影响规律:在pH=2.3~3.0范围内,钝化液体系pH值的计算值与试验值的吻合性较好,误差值小于10%;试验配制的钝化液随着酸度的降低,在pH≥2.5时开始变得不稳定而出现浑浊和沉淀,与计算得到的在pH≥3.0出现沉淀现象大体上吻合;并且随着钝化液浓度的降低,钝化液体系pH值的理论值更加接近试验值,并且出现沉淀时两者的误差更小。该成果可以进一步推广到计算有铝存在的条件下不同配比的钝化液的沉淀溶解状况,进而可研究铝的溶解对钝化液稳定性的影响规律,由此指导钝化液配方的设计。甚至可以预测在钝化过程中钝化层粒子在铝表面的沉淀先后顺序,对深入理解钝化机理有一定指导意义。这些将在以后的试验中作进一步深入研究。
1.3 数值计算和非零离子强度下模型的校正

2 试 验
2.1 仪器和试剂
2.2 钝化液配制
2.3 钝化液pH值调节
3 结果与讨论
3.1 酸度随氨水添加量的变化趋势理论计算和试验对比



3.2 沉淀现象随氨水添加量的变化趋势理论计算和试验对比

4 结 论
