FPG、TG、HDL-C与双相情感障碍患者预后的相关性分析
2022-12-07胡孝芬杨善杰欧阳泽祥韩友松
胡孝芬,杨善杰,欧阳泽祥,韩友松,金 晶
(安徽省安庆市第六人民医院1临床心理科,2精神科,安徽 安庆 246003)
双相情感障碍(bipolar disorder,BPD)是常见的慢性、复发性精神疾病,其低诊断率、低治疗率、高复发率问题突出,且治疗难度高,严重增加个人、家庭、社会负担[1]。目前BPD的治疗以心境稳定剂、非经典抗精神病药物、抗抑郁药为主,尽管可在短期内在一定程度上减轻患者症状,但因卫生资源配置不足、患者服药依从性不佳等多方面因素的影响,患者面临着较高的预后不良风险[2]。预后不良不仅会降低患者及家属治疗信心,还会进一步提升治疗难度。代谢综合征是一种复杂的代谢紊乱症候群,以胰岛素抵抗、高血压、血脂及糖耐量异常等为主要表现[3]。代谢综合征在精神系统疾病患者中的发病率高于精神正常群体,且显著影响其生活质量[4]。近年来报道发现,精神分裂症及BPD患者存在糖脂代谢紊乱现象,尤其是代谢综合征诊断指标空腹血糖(fasting plasma glucose,FPG)、血脂参数异常率较高,BPD患者发生代谢综合征的机制可能为情绪驱动饮食行为改变、机体炎症水平和类固醇激素水平升高、家族遗传因素等,但具体机制尚未完全阐明[5-6]。从既往研究中可推测FPG、甘油三酯(triglycerides,TG)及高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)水平与BPD预后关系密切,目前关于对BPD预后预测的实验室指标较少,多通过临床症状进行评估,预测效能低,亟需寻找可靠、经济、方便的实验室指标对该类患者的预后进行评估,以及早采取有效干预手段改善患者预后,减轻患者家庭负担。为此,本研究选取110例BPD患者,通过随访获取其预后情况,并探讨FPG、TG、HDL-C对BPD预后的影响,为临床及早调整治疗策略提供理论依据,以期改善BPD患者的预后。
1 资料与方法
1.1一般资料选取2017年8月-2019年8月安徽省安庆市第六人民医院接诊的BPD患者110例。男性59例,女性51例;年龄18~65岁,平均(32.87±5.10)岁。纳入标准:(1)符合《精神病学》中BPD诊断标准[7];(2)18~65岁;(3)入组前未使用过抗精神病药物、抗抑郁症药物、心境稳定剂治疗;排除标准:(1)合并肝炎等消化系统疾病,甲亢或甲减等内分泌疾病;(2)认知功能显著损害或持续兴奋躁动而无法进行量表评估的患者;(3)妊娠期或哺乳期妇女;(4)临床资料缺失者。本研究获取医院伦理委员会批准,患者或家属签署知情同意书。
1.2方法
1.2.1 外周血指标的检测 受试者入组后,次日清晨空腹采集肘部静脉血5 mL,采用cobas C 501全自动生化分析仪(德国Roche Diagnostics GmbH公司)检测FPG(正常值<6.1 mmol/L)、TG(正常值<1.7 mmol/L)、总胆固醇(total cholesterol,TC,正常值2.9-6.0 mmol/L)、HDL-C(正常值:男性≥0.91 mmol/L,女性≥1.01 mmol/L)、低密度脂蛋白(low-density lipoprotein cholesterol,LDL-C,正常值2.07~3.12 mmol/L)。
1.2.2 BPD治疗与预后判断 所有BPD患者经过1周清洗期(停用既往服用药物,以排除干扰)后纳入研究,根据《中国精神疾病防治指南》中相关标准选用碳酸锂联合齐拉西酮方案进行治疗[8]:碳酸锂(湖南千金湘江药业股份有限公司,国药准字H43020372,规格0.25 g)起始剂量为0.5 mg/d,根据病情调整剂量,1周内最大剂量为1.5 g/d;齐拉西酮(江苏恩华药业股份有限公司,国药准字H20061142,规格20 mg(以C21H21ClN4OS计)起始剂量为20 mg/d,10日内最大剂量160 mg/d,若出现胃肠道不良反应、头晕等并发症则酌情减量。连续治疗24周。
1.2.3 随访及预后评估 治疗完成后对患者进行随访,随访1年,门诊复诊评估患者预后情况,包括医师评估和自我评估。他评工具:①汉密尔顿抑郁量表17(Hamilton depression rating scale,HAMD-17)[9]:包括抑郁情绪、自杀、睡眠情况等共17项内容,总分17~24分,<7分为正常、7~17分为可能抑郁、>17分为肯定抑郁。②贝克-拉范森躁狂量表(Bech—Rafaelsen mania rating scale,BRMS)[10]:包括动作、言语、意念飘忽、言语/喧闹程度等13个项目,每个项目采用5级评分方式(0~4分),总分42分,分数越高,患者症状越严重。<5分为无明显躁狂、6~10分为有躁狂、>22分为严重躁狂。自评工具:①抑郁症快速自评量表(quick inventory of depressive symptomatology self-report,QIDS-SR16)[11]:包括睡眠、悲伤情绪、食欲、体重等共16项内容,总分27分,分数越高抑郁情况越严重,>5分为有残留抑郁症状。②心境障碍问卷(mood disorder questionnaire,MDQ)[12]:包括兴奋、注意力、易激惹等共13个问题,总分13分,>5分为有狂躁残留症状。预后不良判定:HAMD-17<7分且QIDS-SR16≤5分为无抑郁残留症状,BRMS<5分且MDQ≤5分为无狂躁残留症状,将无抑郁残留症状同时无狂躁残留症状的患者纳入预后良好组,其余纳入预后不良组。
1.2.4 临床资料的收集 患者入组后收集其临床资料,包括性别、年龄、受教育年限、婚姻状态、病程、腰围(waist circumference,WC)、体质量指数(body mass index,BMI)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP),有无家族史、疾病分型、服药依从性(采用Morisky问卷[13]评估服药依从性,含8个条目共8分,8分为依从性好,6~7分为依从性一般,<6分为依从性差),记录精神疾病患者的家庭负担访谈调查表(family experience interview schedule,FEIS)评分[14][量表包括患者暴力行为、照料者抑郁和孤立感等共5个维度,共28个条目,采用4级评分(1~4分)或2级评分(0~1分),分数越高负担越轻]、自杀意图评分(采用8条目自杀意图量表[15]评估,包括隔离性、时间性、防范性、寻求帮助等共8个条目,各条目评分0~2分,总分16分,积分越高自杀意图越强),统计实验室指标:FPG及血脂4项等。
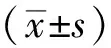
2 结果
2.1BPD预后情况及不同预后患者一般资料比较
随访12个月共12例患者失访,最终纳入98例。98例患者中66例无抑郁残留症状同时无狂躁残留症状,设置为良好组,其余32例设置为不良组。两组年龄、性别、家族史、受教育年限、婚姻状态、自杀意图评分、疾病分型、病程、DBP临床资料比较,差异无统计学意义(P>0.05);不良组FEIS评分低于良好组,服药依从性差占比、WC、BMI、SBP高于良好组(P<0.05)。见表1。

表1 不良组、良好组一般资料比较
2.2不良组、良好组代谢指标水平比较两组TC、LDL-C水平比较,差异无统计学意义(P>0.05);不良组HDL-C低于良好组,FPG、TG高于良好组(P<0.05)。见表2。

表2 两组代谢指标水平比较
2.3BPD预后的影响因素分析对表一单因素分析有差异的影响因素为自变量,并进行赋值,以BPD患者预后(良好=0,不良=1)为因变量行Cox回归分析,见表3。Cox回归分析显示,FPG、TG高,服药依从性差,FEIS评分、HDL-C低是影响BPD预后的独立危险因素(P<0.05)。见表4。

表3 各因素赋值表

表4 BPD预后影响因素的多因素分析
2.4FPG、TG、HDL-C单独及联合预测BPD预后不良的效能ROC结果显示,FPG、TG、HDL-C预测BPD预后不良的最佳截断点分别为6.01、1.72、1.26 mmol/L,三者单独及联合预测BPD预后不良的AUC分别为0.636、0.752、0.827、0.848。见表5、图1。
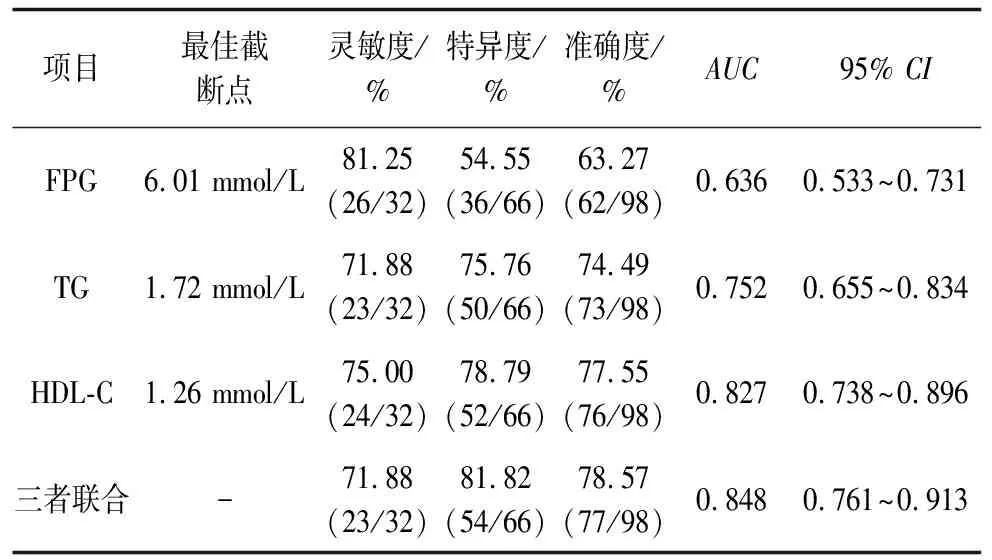
表5 FPG、TG、HDL-C单独及联合预测BPD预后不良的效能
2.5不同FPG、TG、HDL-C水平BPD患者的预后情况Kaplan-Meier比较以ROC曲线最佳截断点分组,FPG>6.01 mmol/L患者共61例,包括失访5例、预后不良26例、预后良好30例;FPG<6.01 mmol/L患者共49例,包括失访7例、预后不良6例、预后良好36例;FPG>6.01 mmol/L与FPG<6.01 mmol/L患者Kaplan-Meier曲线比较,差异有统计学意义(χ2=12.543,P<0.001),见图2。TG>1.72 mmol/L患者共43例,包括失访4例、预后不良23例、预后良好16例;TG<1.72 mmol/L患者共67例,包括失访8例、预后不良9例、预后良好50例;TG>1.72 mmol/L与TG<1.72 mmol/L患者Kaplan-Meier曲线比较,差异有统计学意义(χ2=23.905,P<0.001),见图3。HDL-C<1.26 mmol/L患者共42例,包括失访4例、预后不良24例、预后良好14例;HDL-C>1.26 mmol/L患者共68例,包括失访8例、预后不良8例、预后良好52例;HDL-C<1.26 mmol/L与HDL-C>1.26 mmol/L患者Kaplan-Meier曲线比较,差异有统计学意义(χ2=29.007,P<0.001),见图4。
3 讨论
BPD是中国重点防治的精神疾病之一,以情感或心境异常改变为主要特征,且常伴有行为、心理生理、认知、人际关系方面的变化或紊乱。越来越多的研究发现[16-17],BPD患者合并代谢综合征的比例显著高于精神正常群体,且可能是导致BPD预后不良的原因之一。目前关于BPD与代谢综合征的关联尚未明确,多认为两者在免疫、内分泌方面具有共同的特征与病理机制,如下丘脑-垂体-肾上腺轴功能亢进、免疫炎症因子释放增加、氧化应激、遗传与环境因素等[18-19]。本研究经Cox回归分析显示,FEIS评分低、服药依从性差是影响BPD预后的独立危险因素。BPD病情反复,家庭负担较重,且长期治疗可能导致患者精神上承受着较大压力,可能导致抑郁等其他并发症,可能对预后造成影响[20]。由于目前BPD的治疗以抗精神病药物为主,因此服药依从性与该病治疗效果具有直接关联。既往报道指出,缺乏治疗态度与信心、阴性症状影响、缺乏自知力、社会心理因素等均可能影响患者服药依从性,侧面反映其精神状态与恢复环境不佳,影响预后[21]。
此外,本研究发现FPG、TG高,HDL-C低也是影响BPD预后的独立危险因素,且采用ROC曲线分析FPG、TG、HDL-C单独及联合预测BPD预后不良的效能,结果显示三者单独及联合预测BPD预后不良的AUC分别为0.636、0.752、0.827、0.848,提示三者联合预测的效能高于单独预测。本研究以ROC曲线获得的最佳截断点为分组标准,进行Kaplan-Meier法分析,结果显示FPG<6.01 mmol/L预后曲线优于FPG>6.01 mmol/L患者,TG<1.72 mmol/L预后曲线优于TG>1.72 mmol/L,HDL-C>1.26 mmol/L预后曲线优于HDL-C<1.26 mmol/L患者,进一步证实BPD患者血清FPG、TG、HDL-C水平可影响预后。分析原因可能为:(1)FPG、TG、HDL-C异常提示患者去甲肾上腺素及5-羟色胺功能缺陷,导致下丘脑-垂体-肾上腺轴活性失调,引起BDP神经生物学上的病理生理学状态异常;(2)糖脂代谢紊乱导致生物素异常释放,有研究认为BDP与生长激素之间存在双向调节,但具体机制尚待探索[22];(3)导致雌激素分泌量减少,而雌激素可促进5-羟色胺合成,抑制儿茶酚胺氧位甲基转移酶、单胺氧化酶活性,提高突触间隙去甲肾上腺素浓度;(4)与单纯BPD患者比较,糖脂代谢异常的BPD患者认知功能更差,尤以定向损害、视空间与执行功能更为严重。此外,有国外学者认为[23-24],BPD患者糖脂代谢异常可能与大脑脂质代谢异常、血管反应性损伤、氧化应激、神经炎性反应密切相关,导致认知功能损害及神经退行性变。因此,在治疗BPD时,需加强检测其糖脂代谢指标,针对指标异常患者配合使用二甲双胍或健康减肥药物,并配合科学运动,积极控制糖脂代谢指标,以改善药效。
综上所述,BPD预后不良患者FPG、TG异常升高,HDL-C异常降低,FPG、TG、HDL-C联合检测可作为预测BPD预后的重要参考指标,提示临床在BPD治疗过程中应对FPG、TG、HDL-C进行实时监测,对于存在危险因素的患者应及时采取有效干预手段,以改善治疗结局。本研究由于经费和时间的限制,纳入的样本量较小,在后期研究中应扩大样本量,对本研究ROC曲线提示的最佳截断点进行验证,为临床工作者提供参考依据。
