热袍菌门最新研究进展
2022-12-06马诗淳彭成慧杨毅
马诗淳, 彭成慧, 邓 宇, 张 辉, 杨毅
(1.农业部沼气科学研究所, 成都 610041; 2国家农业微生物双流观测实验站, 成都 610000; 3.三亚中国农业科学院国家南繁研究院, 海南 三亚 572024; 4.四川大学, 成都 610065)
热袍菌门(Thermotogota)是一类广泛分布于高温、厌氧环境的细菌。比较基因组研究发现,热袍菌门与古菌存在水平基因转移,具有大量的(24%)古菌同源蛋白,在细菌域的系统进化树上呈一深度分支,可能是极端嗜热细菌的共同祖先[1]。趋异/趋同进化分析揭示热袍菌基因组中具有磷酸二肌醇生物合成相关的基因,嗜温的mesotoga起源于热袍菌目。同时,它具有多种高度热稳定的水解酶编码基因,能够利用多聚糖、单糖产生氢气[2]。因此,热袍菌目一直是研究生命进化、生物质降解、生物制氢重要模式菌种[3-5]。本文总结了热袍菌门在分类学、环境适应机制、生理生化功能等方面的研究进展。
1 热袍菌门的系统分类地位
自Huber[6]等分离到Thermotogamaritima建立热袍菌目(Thermotogales)以来,这类生长温度高达90℃的极端嗜热细菌在生命进化和能源利用领域备受关注。2001年,Reysenbach等提出热袍菌纲(Thermotogae)[7]。30多年来,国内外学者陆续从海洋地热区、陆地热泉和油藏等生境分离到热袍菌目新物种。随着物种数量的增加和基因组数据的积累,2015年,Bhandari[8]等对热袍菌纲进行了重新分类,将其划分为Thermotogales, Kosmotogales 和Petrotogales 3个目。2021年,Aharon Oren和George M Garrity提出热袍菌门(Thermotogota)[9]。目前,热袍菌门包含4目(新增Mesoaciditogales)[10],5科(Thermatogaceae, Fervidobacteriaceae, Kosmotogaceae, Petrotogaceae和 Mesoaciditogaceae)科,13属(Thermotoga,Fervidobacterium,Geotoga,Petrotoga,Marinitoga,Thermosipho,Kosmotoga,Oceantoga,Mesotoga,Pseudothermotoga,Tepiditoga,Athalassotoga,Mesoaciditoga)53种(见表1)。
2 热袍菌门的生理特征
热袍菌门成员的生长温度范围广(25℃~95℃),包含极端嗜热,嗜热,嗜温物种(见表1)。除Thermotogales(Tt.affectus)只能够在嗜热条件下生长,其他物种均可在中温和高温条件下生长,但仅M.prima的最适生长温度为中温(37℃)。所有物种均不形成芽孢,革兰氏染色阴性(D.tunisiensis为阳性);K.shengliensis的细胞呈球形,其他物种均为杆状细胞,外具独特的鞘状结构包被。Mesoaciditogales是热袍菌门唯一的中度嗜酸物种,最适生长pH值 5.5~6.0。
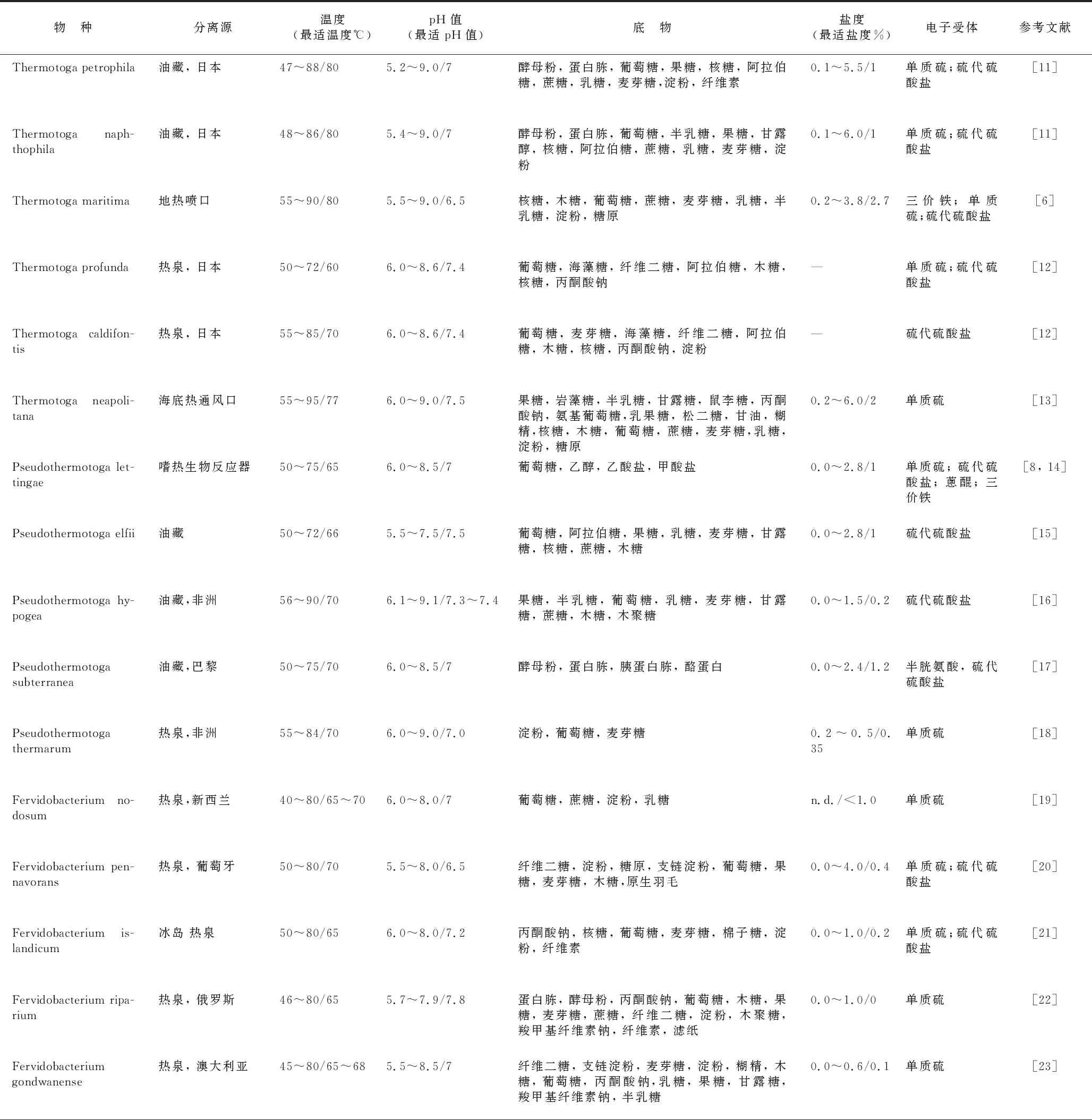
表1 有效发表的热袍菌门物种及生理特性
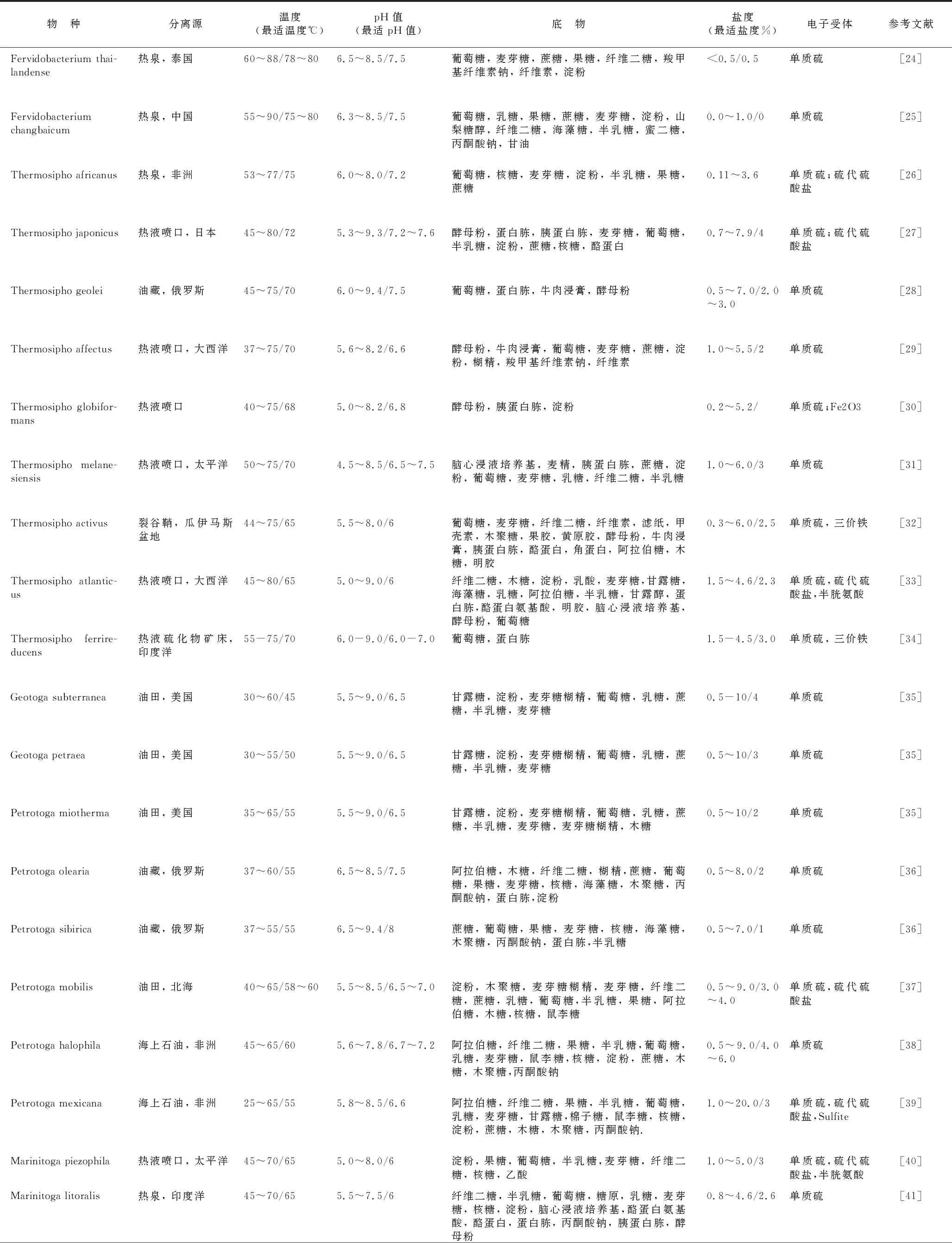
(续表1)

(续表1)
3 热袍菌门的环境适应机制
3.1 中温热袍菌的发现及其温度适应机制
长期以来,人们对热袍菌的认识都是基于其极端嗜热或嗜热的特性。但是,随着微生物分子生态学的发展,在多种中温的地上和地下厌氧生境中检测到了与热袍菌目16S rRNA基因高度相似的基因序列,如多氯联苯的富集物(30℃),以及降解邻氯苯酚、多环芳烃、邻苯二甲酸二甲酯的微生物群落的海港沉积物的富集物、厌氧消化污泥(34℃)[54, 56-57]。这一类可在中温环境中生长代谢的热袍菌目成员被称为栖温袍菌(“mesotoga”)[58]。
嗜温的热袍菌门M1族系普遍存在于中温、富含烃类的油藏及油污土等厌氧生境,与分离自高温油藏、可营中温生长的K.olearia16S rRNA相似性最高。通过构建Fosmid基因文库,Nesbo[59]等提出“M1起源于栖息在高温油藏的物种,是适应油藏温度降低的结果”的假说。2012年,该团队分离了热袍菌门的首个嗜温物种M.prima,基因组分析发现该物种通过水平基因转移(HGT)从厚壁菌门、古菌等物种中获得了32%的蛋白质编码基因,其中25%来自于梭菌目的中温物种。分析不同培养温度下的K.olearia表型及基因表达情况发现,温度对细胞膜的组成及代谢模式具有明显影响。高温条件下(65℃)能量和碳水化合物代谢相关的基因上调表达,当培养温度降低至40℃时,冷应激蛋白Csp、核糖体蛋白、参与氨基酸代谢和不饱和脂肪酸合成的基因上调表达,并且细胞膜脂肪酸的组成更复杂,不饱和脂肪酸(9-十八碳烯酸)的含量增加。此外,K.olearia还通过复制和/或HGT等方式增加Csp等基因的拷贝数,以应对低温生长。但K.olearia适应高温生长的机制尚不清楚[60-61]。
3.2 热袍菌门耐受氧胁迫的机制

通常,O2在氧化还原酶(如氢酶)的介导下转化成H2O2和ROS,H2O2和ROS与蛋白质(参与物质与能量代谢)的Fe-S簇等活性位点相互作用,使其丧失生物活性,从而导致细胞代谢系统崩溃[69]。在Clostridiumacetobutylicum等厌氧微生物中,Suf和Nif系统在FeⅡ吸收基因的诱导下表达,维持Fe-S簇的生物合成,以抵御O2对细胞的毒害[70-71]。利用差异蛋白质组分析,仅发现Tt.maritimaSuf C在氧胁迫下上调表达[68]。
当细胞内存在Fe(Ⅱ)(包括损伤的Fe-S簇)时,O2的氧化产物H2O2可以与其发生Fenton化学反应(Fe(Ⅱ)+H2O2→Fe(Ⅲ)+OH﹒+OH-),产生具有强氧化性的OH。OH与DNA分子非选择性结合,引起基因突变甚至细胞凋亡(致死突变)[72]。厌氧微生物主要通过诱导表达NTP焦磷酸转移酶(pyrophosphohydrolases, MutT1)、DNA结合铁蛋白类似物(Dps),核糖核苷还原酶(ribonucleotide reductase, NrdA)等核苷酸合成酶保护DNA与RNA[73]。迄今为止,仅发现Tt.maritima通过铁蛋白亚基的解聚活动保护DNA[74],还没有热袍菌在氧胁迫下参与DNA保护和修复的基因被报道。
在0.5%的氧浓度下,Tt.maritima能够以73.6μmoles O2/g蛋白·min速率消耗O2,这一结论不仅彻底改变了人们对热袍菌目不能以氧作为末端电子受体的认识[66],还为Van等人的假设提供了部分证据。结合比较基因组分析,通过电化学分析和体外验证,Le Fourn小组提出了T.maritime的O2及ROS消耗系统——氧还原链[75](见图1)。氧还原链是一种NAD(P)H依赖性的O2及ROS的解毒系统,由成簇排列的NADH氧化还原酶(NADH oxidoreductase, NRO)、红素氧还蛋白(rubredoxin, Rd)和FprA(flavo-diiron protein)组成。当环境中存在O2时,Rd作为电子传递的媒介,将NRO的辅酶NADH所携带的电子传递给FprA,再由FprA将O2还原成H2O,消耗O2;但是当环境中存在ROS时,Rd将电子分别分配给具有过氧化氢酶活性的Rbr和具有过氧化物酶活性的neelaredoxin(Nlr),清除ROS。当环境中氧当环境中出现ROS积累时,Tt.maritima通过交替表达两组不同的过氧化物酶系编码基因应对不同的氧化压力。ROS浓度较低时,烷基过氧化物还原酶(alkyl hydroperoxide reductase, Ahp)/硫醇过氧化物酶(thioredoxin-dependent thiol peroxidase,Bcp2)酶系编码基因表达上调;ROS浓度较高时,Bcp1(即Ahp C)/Rbr氧化还原酶编码基因表达上调。Couturier[76]等人证实上述蛋白具有过巯基依赖型氧化物蛋白活性。系统发育学研究发现,Tt.maritima氧还原链中的5个酶是通过水平基因转移从Thermococcales中获得,以适应环境变化。但是,在后来的进化中,部分基因已在一些物种中(如Kosmotoga,Petrotoga,Thermosipho)丢失。
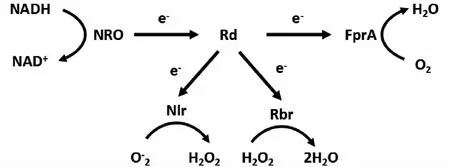
图1 Tt. maritime NAD(P)H依赖性的氧及氧自由基的解毒系统的结构示意图
4 热袍菌门的代谢功能
4.1 糖类水解
热袍菌门物种营有机异养生长,可利用的底物主要包括多种戊糖、己糖、二糖和多糖,以及酵母粉、乙酸盐、甲醇和果胶等(见表1)。近年来发现,热袍菌门含有大量的底物特异性ABC转运蛋白,以及多种α-和β-糖苷水解酶(GH),用于水解各类碳水化合物[77-78]。Tt.maritima基因组中,参与水解单糖和多聚糖的基因占已知基因的7 %[79]。与其他厌氧微生物相比,Tt.maritima不产生纤维小体等大分子聚合蛋白,主要利用各种胞外和胞内水解酶完成多聚糖的降解(见表2)。F.pennavorans和F.islandicum还具有羽毛角蛋白降解能力,分别分泌嗜热碱性丝氨酸蛋白酶fervidolysin和金属蛋白酶[20, 80]。目前,已成功表达了果胶酶、淀粉酶、木聚糖酶、角蛋白酶等生物酶[5, 81-84],其最适酶促反应温度均高于80℃,热稳定性强,具有潜在的工业应用潜力[78, 85-86]。

表2 Tt. maritima基因组中注释到的α-和β-糖苷酶
为了提高生物酶的热稳定性和活性,已将定点突变、固定化等技术成功应用于木聚糖酶、鼠李糖酶的研究[83, 115-116]。通过定向改造Tt.maritimeMSB8的木聚糖酶 XYN10B,将其在100℃的半衰期活性提高了3.3~3.5倍[116]。采用计算机辅助设计,α-L-鼠李糖苷酶的催化效率提高了200余倍[117]。将Tt.neapolitana的内切-1,4-β-半乳糖酶、α-l-阿拉伯呋喃糖苷酶与内切-1,4-β-木聚糖酶 (XynA),内切-1,4-β-甘露糖酶(ManB/Man5A)和β-葡萄糖苷酶 (GghA)联合作用,可用于大麦秸秆和玉米麸皮半纤维素水解[118]。T.maritima中,利用半乳甘露聚糖的功能酶(如甘露聚糖酶、β-甘露糖苷酶、α-乳糖酶)可降解用做油井和气井压裂液的瓜胶。T.neapolitana和T.maritima的木糖异构酶可以在高温发酵条件下提高果糖浓度[119]。
4.2 发酵产氢代谢
基因组分析发现,在Tt.maritima中,绝大多数葡萄糖可通过EM途径转化为丙酮酸,但仍有13%的葡萄糖通过产能水平较低的ED途径进行代谢[119-120],最终产生氢气、乙酸和乳酸等代谢产物。其中,氢气合成由[FeFe]-氢酶介导,[FeFe]-氢酶耦合吸能的NADH氧化产氢反应和放能的还原性铁氧还蛋白(Fd)氧化产氢反应,从而推动产氢代谢[121]。在产乙酸代谢途径中,磷酸乙酰转移酶和乙酸激酶不需要消耗还原力,可以避免NADH的再氧化,同时产生还原性Fd和ATP。然而,在乳酸发酵途径中,乳酸脱氢酶需要消耗糖酵解过程中产生的还原力NADH,与氢气合成竞争还原力。因此,乙酸发酵更有利于H2的合成。
除了Mesotoga,几乎所有的热袍菌门物种都可以利用各种简单和复杂的糖类发酵产氢。其中,热袍菌目的氢气产量接近理论极限值(4 mol H2/mol葡萄糖);Marinitoga具有良好的氢耐受性,嗜压细菌Mn.piezophila的最适氢分压高达40 KPa,Mn.Hydrogenitolerans和Mn.okinawensis的生长速率不受氢分压的抑制[42-43]。
研究发现,干扰NADH和还原性铁氧还蛋白的因素均会影响氢气产率,如氢分压、曝气、氧气、氮源、硫源等。Tt.neapolitana和Tt.maritima中,较低的氢分压有利于乙酸积累;氢分压增加过程中,葡萄糖异化作用由乙酸通路向消耗NADH的乳酸合成通路转换;当氢分压为607 mbar,底物的消耗率、生物量、氢气产量均会降低[3, 122]。Tt.neapolitana发酵过程中进行曝气(N2)可降低氢分压,将氢气产量提高一倍以上[65]。在微氧条件下,F.pennavorans,Pseudot.elfii和Tt.neapolitana的氢气产量超过了理论产气量,目前机制尚不清楚[64, 123]。补加适量有机氮源(酵母粉>2 g·L-1)时,Tt.neapolitana和Tt.maritima的氢气产量提高30%左右[124]。硫单质、巯基或亚铁等可作为热袍菌的电子受体,促进菌体生长,同时可满足氢酶等氧化还原酶合成铁硫簇的硫素需求,因此,补加半胱氨酸、硫化钠等可将氢气产量提高2倍[122]。
Tt.neapolitana和Tt.maritima可发酵多种单糖和多聚糖、有较高的氢气产率,Tt.neapolitana的氢气产率可达3.46~3.85 mol H2·mol-1葡萄糖[125]。目前已对其利用纤维素、淀粉、蛋白质、废纸浆等产氢的工艺进行了许多的探索和研究。Tt.maritima发酵果蔬垃圾的氢气产量为3.36 mol H2·mol-1己糖和209 L H2·kg-1VS,产氢速率为28.82 mmol·h-1L-1[126]。
4.3 嗜二氧化碳乳酸发酵
在Tt.neapolitana的糖酵解产氢过程中,当有充足的CO2或碳酸氢钠时,部分外源CO2可与乙酰辅酶A偶联,产生乳酸(见图2),这一乳酸和氢气合成过程被命名为嗜二氧化碳乳酸发酵(Capnophilic Lactic Fermentation,CLF)[127]。由于其他细胞过程可提供额外还原力维持NADH依赖特性代谢途径,理论上,CLF可将糖完全转化为乳酸(或其他丙酮酸衍生物),乳酸产量高于暗发酵的理论产量,且不影响氢气合成。在富含CO2的条件下,Tt.neapolitanasubsp.capnolactica是热袍菌目中唯一一个乳酸和氢气产量均增加的物种[128]。转录组研究证实,CO2诱导了糖酵解和ED途径等核心碳代谢的重排及激活机制,从而增加维持CLF所必需的还原力NADH[129]。
CLF可以回收糖酵解产生的乙酰辅酶A和外源CO2,是一种极具吸引力的生物技术。Pradhan[130]等构建了Tt.neapolitana的CLF模型,用于指导改善其生物产氢和乳酸发酵性能。同时,遗传改造、电刺激等方法对Tt.neapolitana产乳酸代谢也具有一定的促进作用[131-132]。Esercizio等人通过乙酰辅酶A合成酶的异源表达,将Tt.neapolitanaDSM33003的乳酸产量增加1.7倍,但产氢代谢受损。目前已证实,Tt.neapolitana可用于淀粉的CLF和生物制氢,乳酸和H2产量分别为0.88±0.39~0.33±0.11 mol乳酸/mol葡萄糖eq.和3.34(±0.17)~2.79(±0.17)mol H2/mol葡萄糖eq.[133]。

注:葡萄糖的乙酸发酵(黑色箭头)产生H2和乙酸盐。反应器顶空CO2浓度的增加决定乙酰辅酶A向乳酸盐(红色箭头)的回收利用,而不会影响氢气合成。LDH,乳酸脱氢酶;PROR,丙酮酸铁氧还蛋白氧化还原酶。
5 展望
热袍菌门的发现研究已有30多年历史,生物信息学的发展有效推动了热袍菌门在系统分类地位、环境适应特性、生理代谢机制、功能基因资源挖掘等方面的研究进展。获得了一批嗜热、嗜温的新物种,在转录水平揭示了其对温度、氧胁迫的应答机制,发现了一系列可用于纤维素、半纤维素、角蛋白等复杂生物质转化的嗜热/极端嗜热水解酶,评估了菌种在生物制氢、乳酸发酵中的应用潜力。热袍菌门成员都来自于从高温环境,具有多样的嗜热或极端嗜热代谢特性,不仅可以作为重要的工业酶来源,也是碳捕获、可再生能源和高附加值化学基产品生产的潜在菌种资源。
但是,我们对热袍菌门的认识仍十分有限。热袍菌门广泛存在于富含碳氢化合物的油藏环境,目前获得的物种均为碳水化合物水解菌和硫/铁还原细菌,尚未发现烃类代谢功能,该类群在油藏中的生态功能及与其他物种的互作关系尚不清楚。其次,目前热袍菌门的遗传代谢机制研究都是在体外进行,遗传操作技术几乎处于空白,无法开展体内验证研究。另外,CLF代谢的能量平衡、乙酸/乳酸平衡等机制有待深入研究,以指导菌种定向改造和发酵工艺优化,从而提高固碳产氢效率。最后,多聚糖的水解通常由多种水解酶协同作用,需深入研究热袍菌不同水解酶的结构和功能,指导生物酶的定向改造,提高酶活性和稳定性;同时,结合多酶协同催化体系的辅助设计,构建纤维素、几丁质、果胶等复杂多聚糖的酶解系统,为实现工业化应用提供物质和技术保障。
