甜瓜离体叶片持绿培养基的筛选及相关生理指标的测定
2022-12-05刘梦丽贺玉花户克云孔维虎徐永阳赵光伟
刘梦丽,贺玉花,2,户克云,孔维虎,2,张 健,2,徐永阳,2,赵光伟,2
(1.中国农业科学院郑州果树研究所 郑州 450009; 2.中国农业科学院三亚国家南繁研究院 海南三亚 572000)
甜瓜(Cucumis meloL.)是一种重要的经济作物,在生产中病害时有发生,病菌保存是开展病害研究的前提。然而,甜瓜的白粉病、霜霉病等病原菌属专性寄生菌,必须进行活体寄生保存[1-2]。当前,对甜瓜白粉病、霜霉病病原菌的保存多采用幼苗不间断接种保存,费时费工,接种成功率低。离体接种保存不仅操作方便、环境可控,能够保证接种效率和成功率,还便于开展大规模抗性鉴定[3-4]。通过培养离体叶片来保存活性寄生菌是一种行之有效的方法[5-6]。离体叶片的生理活性是决定病菌保存时间的关键。因此,筛选离体叶片的持绿培养基,保持其生理活性,延长其持绿时间对于种质资源的抗性鉴定和病原菌保存都具有重要意义[7]。
前人研究发现,含有苯并咪唑的培养基保存小麦离体叶段能够使叶片较长时间保持绿色[5]。6-苄氨基嘌呤(6-BA)也有延缓小麦、蚕豆和牡丹等作物叶片衰老的作用[8-10]。激动素(KT)不仅可用于青菜的保鲜,还能够延缓红掌叶片的衰老[11-12]。在离体保存过程中,叶片的生理活性指标也会发生变化[13]。随着时间的增加,植物离体叶片细胞活性下降,叶片变黄,叶绿素和蛋白质含量降低[14-15]。当植物的叶片施用细胞分裂素后,可增强其超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,减少叶片中H2O2的积累,延缓衰老叶片中叶绿素的降解,显著提高可溶性蛋白含量[10,16]。
笔者以B391 为试验材料,从不同浓度苯并咪唑与6-BA 和KT 配比的培养基中,筛选出了25 ℃条件下甜瓜离体叶片最适的持绿培养基,以期为后续开展甜瓜抗病性研究提供帮助。
1 材料与方法
1.1 材料
试验于2021 年4-12月在中国农业科学院郑州果树研究所智能温室和人工气候箱内进行,由中国农业科学院郑州果树研究所甜瓜遗传育种课题组提供的高代自交系厚皮材料B391 为试验材料。
挑选籽粒饱满匀称的种子浸种催芽,待种子发芽后播种于装有基质的营养钵内进行育苗,苗期进行一致的水肥管理及病虫害防治。待幼苗长至4~5叶期时,取长势一致、无病虫害及损伤的第3 片真叶,带回实验室,用流动的水冲洗2 h,待用。
1.2 试验设计与材料处理
参照前人研究[5,11,16]试验共设4 个苯并咪唑质量浓度水平:100、75、50、25 mg·L-1;3 个6-BA 质量浓度水平:75、50、25 mg·L-1;3 个KT 质量浓度水平:30、20、10 mg·L-1。将苯并咪唑分别与6-BA 和KT 进行配比,如表1 所示,共设置24 个处理,以无菌水为对照(CK)。各处理溶液pH 值7.0 左右,灭菌(121 ℃,20 min)后备用。

表1 试验设计的处理组合
在超净工作台上,吸取溶液4 mL 加入底部垫有两层无菌滤纸的培养皿中,做好标记,待用。将1.1中冲洗过的叶片,放入盛有酒精(50%)的烧杯中浸泡10 s 消毒,再用无菌水清洗两遍后(注意动作轻缓,不要对叶片造成损伤),放置在无菌纸上擦干叶片表面的水分。用已灭菌的剪刀,在叶柄基部2~3 cm 处斜剪,再用无菌脱脂棉包裹,放入上述培养皿中,最后用封口膜封口,随后置于人工气候箱(温度25 ℃,光照/黑暗为16 h/8 h,湿度80%)中进行培养。
1.3 测定指标与方法
筛选甜瓜离体叶片最适持绿培养基甜瓜离体叶片时,在处理后的0、5、10、15、20 d,每个处理分别取6 个甜瓜离体叶片,采用SPAD-502 叶绿素含量测定仪分别测定甜瓜叶片5 个点的SPAD 值(图1),取其平均值。使用最适的持绿培养基培养甜瓜离体叶片,以无菌水为对照,处理后0、3、6、9、12、15、18 d,处理和对照分别取9 个甜瓜离体叶片测量叶片SPAD 值,取其平均值。3 个叶片混合后进行以下各个指标的测定,3 次重复,取其平均值。采用考马斯亮蓝G-250 法测定叶片蛋白质含量,采用95%乙醇浸泡比色法测定总叶绿素含量、叶绿素a含量、叶绿素b 含量,采用氮蓝四唑方法测定SOD活性[17]。使用Abbkine 公司生产的Chekine 试剂盒测定叶片的POD、CAT 活性和H2O2含量,使用酶标免疫分析仪(SpectraMax i3x)进行读数。

图1 叶片SPAD 值的测量位置
1.4 数据处理
收集数据后,使用Excel 2019 进行数据处理并作图,使用GraphPad Prism 9.0.0 进行数据显著性分析。
2 结果与分析
2.1 持绿培养基的筛选
结合叶片表型的观察以及各时期SPAD 值的比较,由图2 和表2 可知,甜瓜离体叶片在苯并咪唑与KT 培养基培养第20 天,处理13~24 的叶片都出现明显发黄现象,且其SPAD 值都低于CK,表明苯并咪唑与KT 配比培养基不能使叶片持绿。在苯并咪唑和6-BA 培养基培养第20 天,处理1 和10的叶片SPAD 值低于CK,处理1 叶片发黄严重并伴随着多处黄色斑块,处理10 叶片出现多处黄色点状斑块,处理5 叶片整体黄化且叶脉明显变黄,其余处理SPAD 值高于CK,表明苯并咪唑和6-BA配比培养基对叶片保持持绿有促进作用。其中处理6 的SPAD 值(24.55)最高,高于其他处理和对照,比CK 高36.16%,除了叶脉基部变黄,大部分叶片仍能保持绿色。最终,筛选出处理6 的培养基为甜瓜离体叶片最适的持绿培养基。

图2 不同处理各时期的离体叶片表型
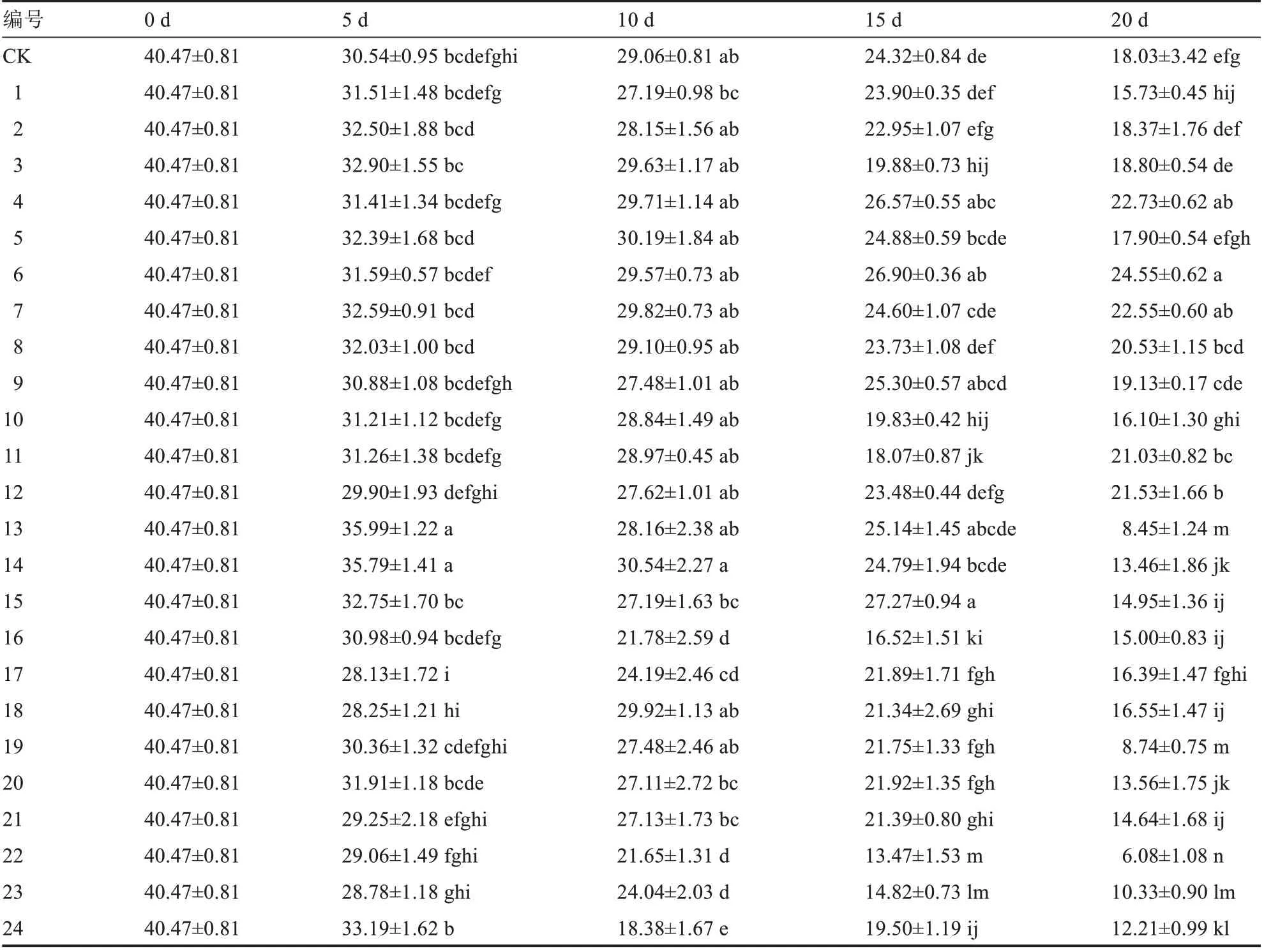
表2 不同处理各时期的离体叶片SPAD 值统计
2.2 持绿培养基对甜瓜离体叶片叶绿素含量、SPAD值和蛋白质含量的影响
由图3 可以看出,随着处理后时间的增加,甜瓜离体叶片的SPAD 值及总叶绿素、叶绿素a、叶绿素b、蛋白质含量都逐渐降低。甜瓜离体叶片在经过最适持绿培养基处理后,在各个时期的所有测定值均高于或等于CK。在各个时期,处理组叶片的SPAD 值均显著或极显著高于CK。在第18 天时,对照叶片的SPAD 值降低了90.85%,处理叶片的SPAD 值降低了74.26%。在处理后第6 天,处理组叶片蛋白质含量比CK 高65.37%,两者存在极显著差异。由此可知,最适持绿培养基能够延缓甜瓜离体叶片中叶绿素和蛋白质的降解,从而使甜瓜离体叶片能够较长时间地保持活性,达到持绿的效果。
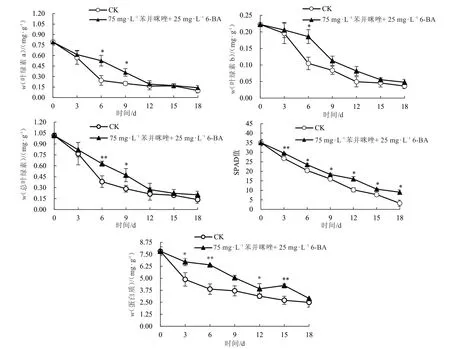
图3 持绿培养基处理的离体叶片叶绿素含量(A、B 和C)、SPAD 值(D)和蛋白质含量(E)
2.3 持绿培养基对甜瓜离体叶片抗氧化酶活性和H2O2含量的影响
由图4 可以看出,随着处理时间的增加,甜瓜离体叶片的H2O2含量和POD 活性逐渐增加;SOD和CAT 活性均呈先升高后降低的趋势,并在处理后第3 天达到最大值。与CK 相比,处理组叶片在各个时期的POD、SOD、CAT 活性均高于对照组,H2O2含量均低于CK。其中,在处理后的各个时期,处理组甜瓜离体叶片SOD 和POD 活性均显著或极显著高于CK。以上结果表明,最适持绿培养基能够有效增强甜瓜离体叶片防御酶的活性,从而增强了甜瓜叶片清除H2O2的能力,达到叶片持绿的效果。
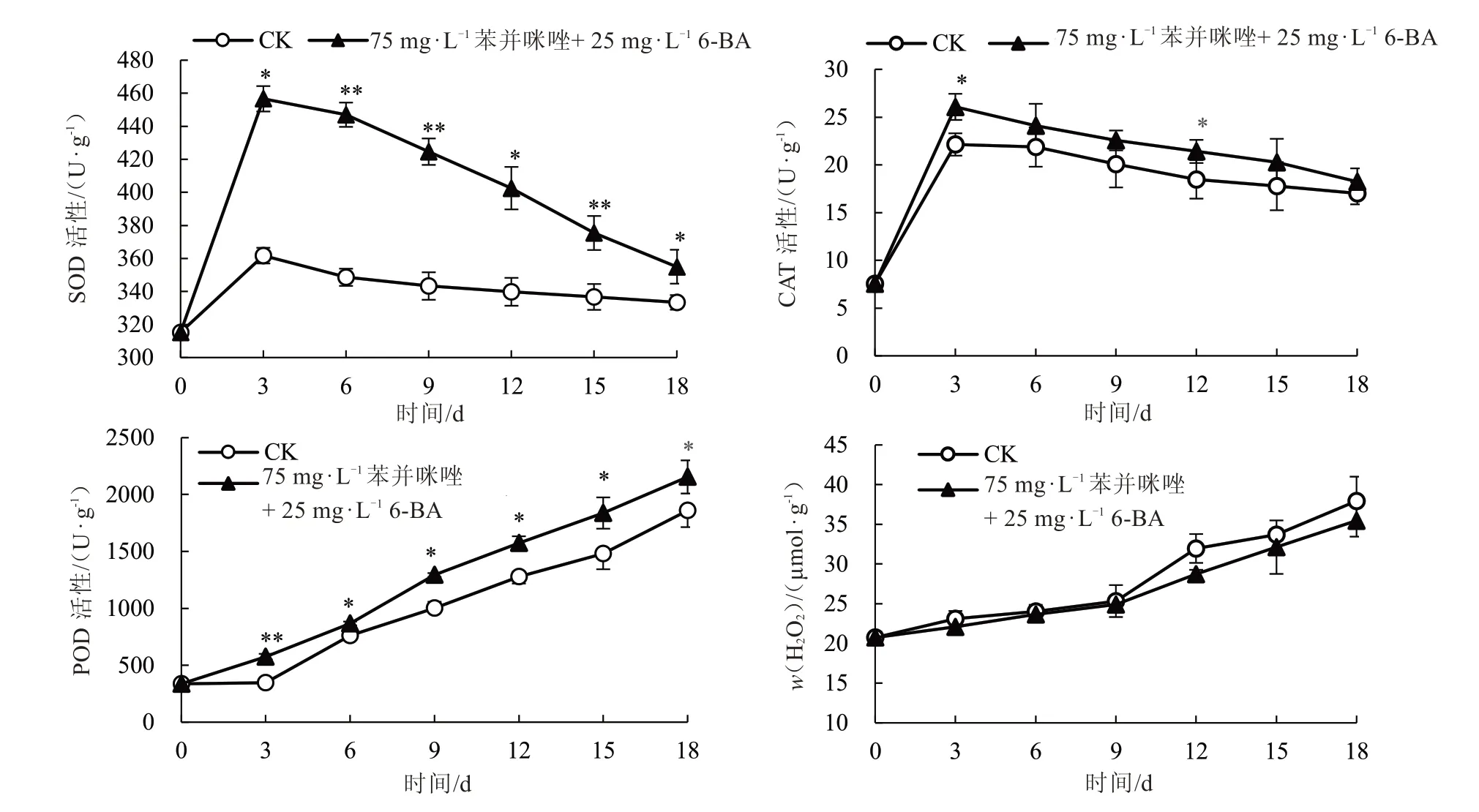
图4 持绿培养基处理的离体叶片抗氧化酶活性(A、B 和C)和H2O2 含量(D)
3 讨论与结论
叶片在离体情况下,会快速发生黄化,伴随着体内一系列生理生化变化[13]。研究表明,当培养基中含有一定浓度的苯并咪唑时,离体叶片能较长时间保持绿色[5]。外源施用6-BA 和KT,同样有延缓叶片衰老的作用[18-19]。笔者从24 个不同浓度苯并咪唑与6-BA、KT 配比的培养基中,筛选出最适的持绿培养离体叶片的培养基为75 mg·L-1苯并咪唑+25 mg·L-16-BA。与对照(无菌水)对比,最适的持绿培养基能够有效增加叶片持绿时间,与前人研究结果一致。
叶片在黄化过程中,叶片内积累大量的活性氧,对细胞膜造成破坏,细胞结构发生变化,通常伴随着叶绿素和蛋白质降解,从而使叶片光合速率降低[14]。叶片内的抗氧化系统(POD、SOD、CAT)会及时清除体内多余的自由基,能有效阻止体内超氧阴离子自由基、H2O2、羟基自由基等的累积,防止膜脂的过氧化作用,延缓植物衰老,使植物维持正常的生长和发育[20]。叶绿素含量的多少能够直接影响植物的光合效率,较高的光合速率能够使叶片保持较高的活性[21]。在叶片黄化过程中,叶片内蛋白质迅速降解,核酸合成减弱,进而加速叶片黄化,蛋白质含量也是评价叶片活性的重要指标[15]。喷施6-BA 能显著延缓植物叶片的叶绿素含量下降,显著提高叶片的可溶性蛋白含量,提高其SOD、POD和CAT 活性,减慢H2O2的上升速率,延缓叶片的衰老[10,22]。在笔者的试验中,甜瓜叶片在黄化进程中,叶片SPAD 值和总叶绿素、叶绿素a、叶绿素b 及蛋白质含量都逐渐降低,与前人研究结果一致。在甜瓜叶片黄化进程中,叶片SOD、CAT 活性先升高后降低,POD 活性逐渐升高,其变化与辣椒[13]叶片在衰老过程中的变化一致。
前人研究表明,用含有30 mg·L-1苯并咪唑的甘露醇培养基培养离体的甜瓜子叶,用来分离纯化、保存甜瓜白粉病菌[23]。用含有50 mg·L-1苯并咪唑的0.5%琼脂培养基培养甜瓜离体叶片,用来接种白粉病菌,20 d 后叶片基本绿色,且叶片出现白粉病斑,用显微镜观察,白粉病菌没有受到污染,且孢子活性较强,适合接种[4]。由此看来,培养甜瓜离体叶片来保存病菌切实可行。
笔者从24 个处理中,筛选出处理75 mg·L-1苯并咪唑+25 mg·L-16-BA 为甜离体叶片最适持绿培养基。与对照(无菌水)相比,该培养基能够通过增强叶片保护酶(POD、SOD、CAT)活性,加强活性氧清除能力,减缓叶绿素和蛋白质的降解,使得甜瓜叶片在离体条件下能够保持较长时间的活性,该处理能有效延缓叶片黄化,增加叶片在离体环境下的持绿时间,可用于提高病菌离体接种的准确性以及延长病菌的离体保存时间,这对探索甜瓜专性寄生菌理想的保存方法以及快速、准确、可重复地评价种质资源抗性具有重要意义,也可以为进一步的甜瓜抗性遗传规律及基因定位的研究奠定基础。
