椰壳生物碳吸附Cd(II)的性能和机制
2022-12-05石云龙于长江林强张丽梅李晗贾振亚
石云龙, 于长江*, 林强, 张丽梅, 李晗, 贾振亚
(1.海南师范大学化学与化工学院/水环境污染治理与资源化重点实验室/热带药用资源化学教育部重点实验室/天然高分子功能材料重点实验室, 海口 571158; 2.海南环泰检测技术有限公司, 海口 571158)
随着化工、采矿和冶炼等工业的发展,大量未达标的含Cd废水排放造成环境严重污染。人体摄入过量的Cd可导致癌症等严重的疾病[1]。重金属废水处理方法主要包括吸附、化学沉降、离子交换、纳滤膜过滤等[2]。吸附法的处理成本较低、效率较高且可适用范围广,是最常用的处理技术[2]。新型吸附材料主要有:GO-MnFe2O4[3]、CA/CMC@MnFe2O4[4]、氨基改性凹凸棒石[5]、氧化纤维素水凝胶[6]、Li-Al类水滑石[7]、纳米零价铁[8]等,这些材料具有较好的吸附性能,但是制备成本较高在一定程度上限制了其实用性能。
生物碳是由生物质在缺氧的条件下热解制备,具有价格低、来源广、适用广等特点被广泛用于吸附重金属污染物[9]。使用香蕉秸秆[10]、马缨丹[11]、牛粪[12]、龙葵种子[13]、造纸厂污泥[14]、香根草[15]、小麦秸秆[16]等生物质为原料制备生物碳吸附重金属已有报道。研究显示:生物碳表面可溶性碳酸盐、磷酸盐与金属离子形成沉淀是重要的吸附机理。不同原料制备的生物碳,其孔隙结构、比表面积、所含无机物成分和官能团等理化性质有较大差异[9],选择生物质原料是制备高吸附性能生物碳的前提条件[9]。
椰壳活性炭被广泛用于吸附金属离子[17],其制备过程中需要使用活化剂与炭材料或椰壳进行一系列交联、缩聚反应,再经过强酸等试剂洗脱而产生多孔的结构[18]。在活化和清洗过程中活性炭表面的无机盐被去除,这在一定程度上降低了材料的吸附性能。使用椰壳制备生物碳吸附重金属的报道较少,研究椰壳生物碳对Cd(II)的吸附机理,尤其是其表面的无机盐在吸附Cd(II)过程中的作用对扩展椰壳生物碳在重金属污染治理中的应用有重要意义。
因此,现制备椰壳生物碳(coconut shell biochar,CSBC),通过XRD、XPS、FTIR、EDS等表征方法分析CSBC对Cd(II)的吸附机理,考察CSBC对Cd(II)的吸附性能。目的是制备一种经济、绿色、高效的Cd(II)吸附剂,能够被广泛用于重金属污染治理。
1 实验材料及方法
1.1 试剂
NaOH(分析纯,上海易恩化学技术有限公司),CdCl2、NaNO3(分析纯,上海百舜生物科技有限公司),HNO3(阿拉丁),Cd标液(国家计量科学研究院),pH缓冲试剂(爱普尔)。
1.2 仪器
JSM-7400F扫描电子显微镜,UItima Ⅳ型X射线衍射仪(日本 Rigaku公司),OTF1200X管式炉(合肥科晶材料技术有限公司),HX-2112型恒温培养摇床(上海海向仪器设备有限公司),梅特勒-托利多Seven 系列pH测试仪(美国Mettler-Toledo公司),AA-7000原子吸收分光光度计(日本Shimadzu公司)。
1.3 CSBC的制备
将椰壳用蒸馏水清洗干净后放入鼓风干燥箱在70 ℃烘48 h使材料完全干燥、用粉碎机将椰壳粉碎后过200目筛子,将椰壳粉在100 ℃烘干后在管式炉高温热解。程序升温方法为:使用油泵抽真空15 min、以200 mL/min的流速通高纯N220 min,在100 mL/min N2流速的条件下分别以5 ℃/min、的加热速度升温至200 ℃,之后继续以10 ℃/min的升温速度升温至700 ℃,在700 ℃恒温热解3 h后以10 ℃/min的降温速度冷却至200 ℃,随后自然冷却到室温[19],将热解完成的CSBC装袋干燥保存。
1.4 pH对CSBC吸附Cd(II)的影响
称取一定量CdCl2加入烧杯中,添加300 mL 0.01 mol/L NaNO3水溶液,配置一系列60 mg/L的Cd(II)溶液,调节溶液的pH分别为2、3、4、5、6。分别取不同pH的100 mL Cd(II)溶液加至一系列锥形瓶,每个pH做3组平行实验,各加入0.1 g CSBC,将锥形瓶放入恒温摇床在25 ℃振荡24 h,吸附完成后测试Cd(II)浓度以及溶液的pH[20]。每个pH点试验重复3次。
1.5 动力学吸附实验
在25 ℃进行CSBC吸附Cd(II)的动力学实验。配制pH=5,60、0.01 mol/L NaNO3为背景电解质的Cd(II)溶液。分别取100 mL CdCl2溶液加入一系列锥形瓶,各加入0.1 g CSBC,将锥形瓶置于恒温摇床在25 ℃振荡,定时(1~26 h)取1 mL Cd(II)溶液,稀释后测试Cd(II)浓度[21]。每个取样点试验重复3次。
用吸附量qt衡量t时刻CSBC 对Cd(II)的吸附效果,计算公式为
(1)
式(1)中:qt为t时刻Cd(II)的吸附量;C0为Cd(II)溶液初始浓度,mg/L;Ct为t时刻Cd(II)溶液浓度,mg/L;V为Cd(II)溶液体积,L;m为加入CSBC的质量,g。
1.6 等温热力学吸附实验
在25 ℃进行CSBC吸附Cd(II)等温热力学实验。配制pH=5、浓度为50~300 mg/L以0.01 mol/L NaNO3为背景电解质的Cd(II)溶液。分别取100 mL,50~300 mg/L的CdCl2溶液加入一系列锥形瓶中,各加入0.1 g CSBC,将锥形瓶置于恒温摇床在25 ℃振荡24 h,取1 mL Cd(II)溶液,稀释后测试Cd(II)浓度[21]。每个浓度点试验重复3次。
用吸附量qe衡量平衡时刻CSBC对Cd(II)的吸附效果,计算公式为
(2)
式(2)中:qe为平衡时刻Cd(II)的吸附量;C0为Cd(II)溶液初始浓度,mg/L;Ce为吸附平衡时Cd(II)浓度,mg/L;V为Cd(II)溶液体积,L;m为加入CSBC的质量,g。
2 结果与讨论
2.1 SEM分析
CSBC吸附Cd(II)前、后表面形态结构如图1所示,从图1中可知,CSBC吸附Cd(II)后其表面被白色固体覆盖,说明CSBC表面的无机盐在吸附的过程中与Cd(II)形成了沉淀。

图1 CSBC吸附Cd(II)前、后电镜图Fig.1 SEM images of CSBC before and after Cd(II) adsorption
2.2 CSBC元素和比表面积分析
CSBC元素和比表面积分析结果如表1所示,可知CSBC碳化程度较高,含有少量的N元素,BET比表面积为53.16 m2/g。
2.3 pH的影响
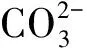
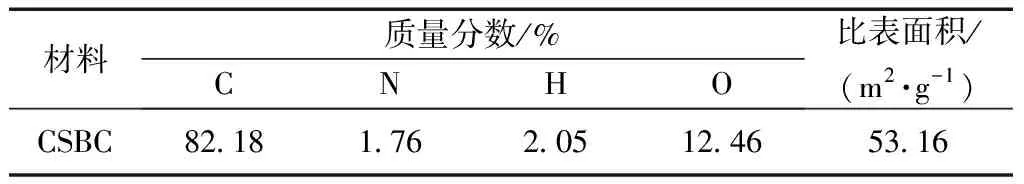
表1 CSBC的理化性质Table 1 Physical and chemical properties of CSBC
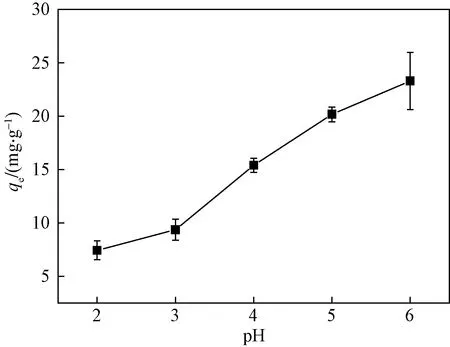
图2 不同初始 pH 条件下CSBC对溶液中Cd(II)的吸附量Fig.2 Effect of different initial pH on Cd(II) adsorption by CSBC
2.4 动力学吸附
应用Pseudo-first-order model(3)、Pseudo-second-order model(4)拟合CSBC对Cd(II)的动态吸附,拟合参数如表2所示,拟合公式[22]为
qt=qe(1-e-k1t)
(3)
(4)
式中:qt为t时刻吸附容量,mg/g;qe为平衡时吸附容量,mg/g;k1为一阶速率常数,min-1;k2为二阶速率常数,g/(mg·min);t为时间,min。
CSBC对Cd(II)吸附量随时间的变化曲线如图3所示,2 h 内CSBC吸附Cd(II)速率很快,之后吸附速率逐渐降低。CSBC 2 h 内吸附Cd(II)速率较快,主要是CSBC表面的碳酸盐与Cd(II)形成了沉淀,之后CSBC对Cd(II)吸附速率减慢,这一阶段主要是CSBC的官能团与Cd(II)形成配位键[23]。
由表2可知,Pseudo-second-order model能够很好地拟合CSBC吸附Cd(II)的过程(R2=0.949 6),且Cd(II)的平衡吸附量与实验吸附值极接近,表明CSBC对Cd(II)的吸附主要受化学吸附控制[24]。
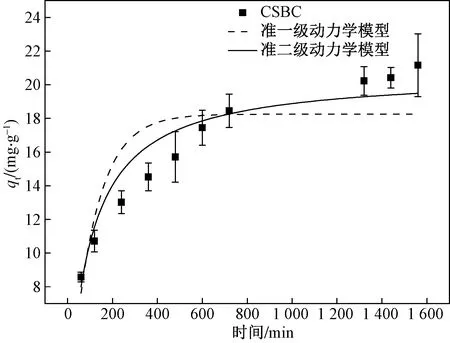
图3 CSBC对Cd(II)的吸附动力学Fig.3 Cd(II) equilibrium kinetics of CSBC

表2 CSBC吸附动力学模型拟合参数Table 2 Constants and correlation coefficients for the kinetic adsorption by CSBC
2.5 等温热力学吸附实验
采用Langmuir、Frenudlich模型对CSBC吸附Cd(II)实验数据进行拟合,拟合方程[25]为
(5)
(6)
式中:qe为吸附平衡时CSBC对Cd(II)的吸附容量,mg/g;qm为CSBC对Cd(II)饱和吸附容量,mg/g;ce为吸附平衡时Cd(II)溶液浓度,mg/L;KL为Langmuir表征吸附剂和吸附质之间亲和力的一个参数;KF为 Freundlich吸附容量的参数;为等温线变化趋势。
CSBC吸附Cd(II)拟合曲线如图4所示,拟合参数如表3所示。

图4 CSBC吸附Cd(II)的等温线及拟合曲线Fig.4 Fitting curves of adsorption isotherms of Cd(II) onto CSBC

表3 CSBC对Cd(II)的等温吸附曲线的拟合参数Table 3 Adsorption isotherm fitting parameters for Cd(II) adsorption onto CSBC
由表3可见CSBC吸附Cd(II)的数据在Langmuir 吸附模型中具有更好的拟合效果(R2=0.965 1),而且Langmuir模式拟合的qm和实验值很接近,由此可知Langmuir模式能够更好地描述CSBC吸附Cd(II)的热力学实验,吸附形式为单层吸附[26],Langmuir模式拟合的最大吸附量为29.36 mg/g。
2.6 吸附机理
2.6.1 XRD分析
CSBC吸附Cd(II)前、后的XRD数据对比如图5所示。CSBC的2θ衍射峰与KCl(JCPDS no.41-1476)的特征峰相符[27],说明CSBC表面有一定量的KCl。CSBC吸附Cd(II)后XRD测试图出现新的衍射峰,2θ衍射峰23.5°、43.8°、49.9°、61.8°、65.5°、75.0°分别对应(0 1 2)、(2 0 2)、(0 2 4)、(2 1 4)、(3 0 0)、(1 2 8)晶面,与CdCO3标准卡片(JCPDS no.42-1342)相符[28],2θ衍射峰30.3°、36.2°、47.9°、58.0°分别对应(0 0 1)、(2 2 0)、(2 4 0)、(2 2 1)晶面,与Cd(OH)2标准卡片(JCPDS no.40-0760)相符[29],表明CSBC表面生成了CdCO3和Cd(OH)2。

图5 CSBC吸附Cd(II)前后的XRD图Fig.5 XRD pattern before and after adsorption of Cd(II) by CSBC
2.6.2 FTIR分析
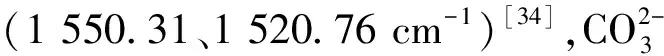
2.6.3 EDS分析
CSBC吸附Cd(II)前、后EDS图如图 7所示,结果显示吸附Cd(II)后CSBC表面Cd元素的质量分数为23.41%,K元素在清洗中被去除。
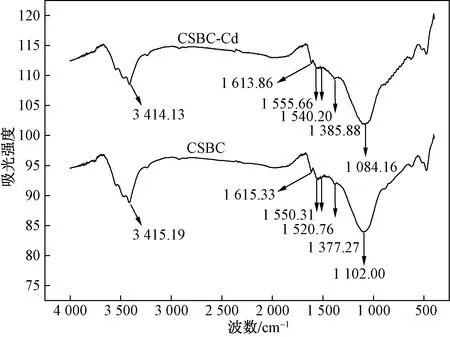
图6 CSBC吸附Cd(II)前后的红外光谱图Fig.6 Infrared spectra before and after adsorption of Cd(II) by CSBC

图7 CSBC吸附Cd(II)前后能谱分析图Fig.7 EDS patterns before and after adsorption of Cd(II) by CSBC
2.6.4 XPS分析

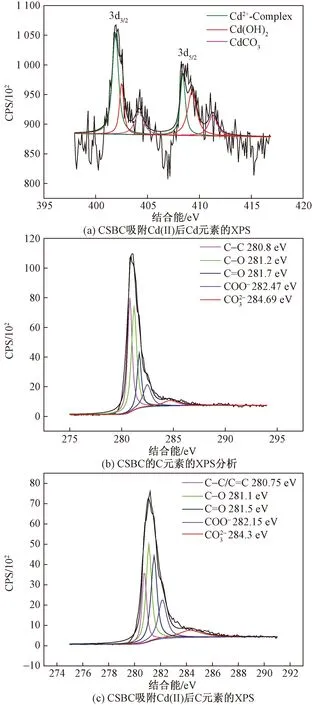
图8 CSBC吸附Cd(II)后Cd 3d XPS分析,CSBC吸附Cd(II)前、后C1 s XPS分析Fig.8 Cd 3d for CSBC after Cd(II) adsorption, C1 s for CSBC before and after Cd(II) adsorption
2.6.5 机理示意图

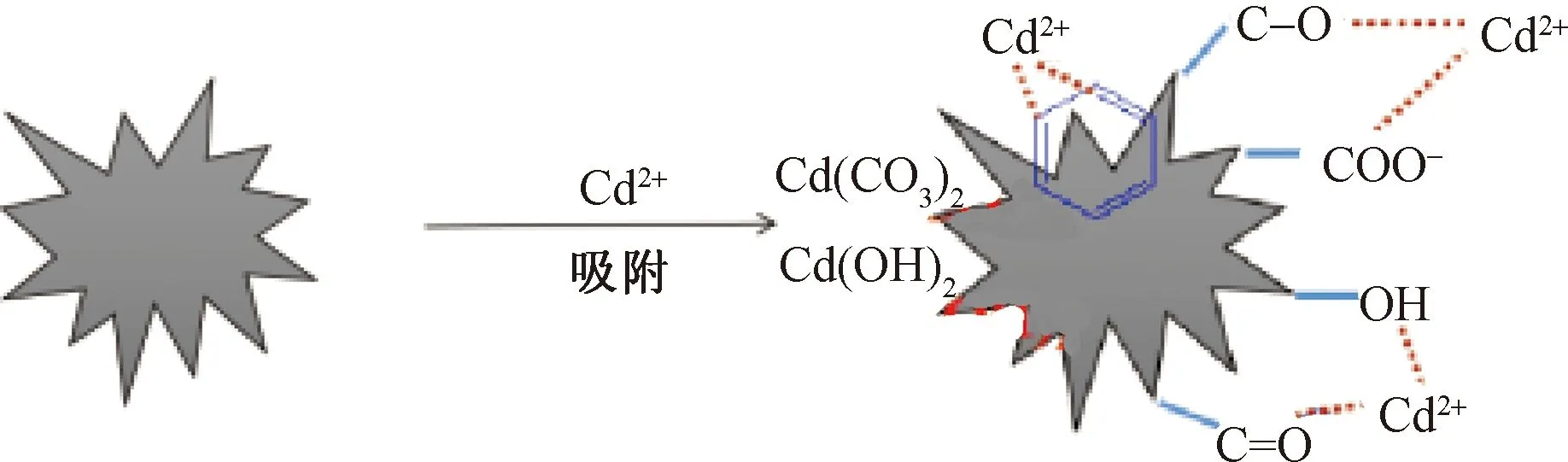
图9 CSBC吸附Cd(II)机理示意图Fig.9 The adsorption mechanism of Cd(II) by CSBC
3 结论
(1) pH对CSBC吸附Cd(II)影响较大,在pH=2~6的范围内CSBC对Cd(II)吸附量随着pH升高而增强。
(2) 在25 ℃、pH=5的条件下CSBC吸附Cd(II) 吸附等温线符合Langmuir模型,最大理论吸附量为29.36 mg/g,CSBC对Cd(II)的动力学吸附过程符合Pseudo-second-order model,吸附过程以化学吸附为主。

(4)CSBC制备成本低,对Cd(II)有较强的吸附作用,可以广泛用于去除水体、土壤中的Cd(II)。此外CSBC经过处理可以安装在净水器的吸附柱中,用以去除各类重金属有害物质。
