多花黄精种子层积过程生理变化研究
2022-12-05张武君赵云青刘保财陈菁瑛黄颖桢程远航
张武君,赵云青,刘保财,陈菁瑛 ,黄颖桢,程远航
(1.福建省农业科学院农业生物资源研究所,福建 福州 350003;2.福建省农业科学院药用植物研究中心,福建 福州 350003)
0 引言
【研究意义】多花黄精(Polygonatum cyrtonemaHua)为百合科黄精属多年生草本植物,以干燥根茎入药,其性甘平,归脾、肺、肾经,具有补气养阴,健脾,润肺,益肾之功效,用于治疗脾胃气虚、胃阴不足,肺虚燥咳,精血不足,须发早白,内热消渴等疾病[1],是传统经典的药食两用植物。现代研究也表明其含多糖、甾体皂苷类、黄酮类、苯丙素类、生物碱类等多种成分,具有抗氧化、抗骨质疏松、抗肿瘤等广泛药理作用[2]。近年来,随着黄精需求量的不断增加,野生资源锐减,已不能满足市场需求,因此各地开始对黄精进行人工栽培,目前主要采用块茎和种子进行繁殖。块茎繁殖应用较多,但其繁殖系数低,且存在多代繁殖后品质严重退化的问题[3];种子繁殖具有繁殖系数高的优点,但其种子休眠周期长、成苗率低,严重影响了多花黄精种子育苗产业发展。研究多花黄精种子层积过程的生理变化,从而了解多花黄精种子萌发调控,对多花黄精产业发展具有重要意义。【前人研究进展】已有研究表明多花黄精种子休眠由种皮[4]、胚[5]、 胚乳[6]、内源抑制物[7]等因素共同作用所致,户外自然变温沙藏或4 ℃低温层积4—5月基本能打破休眠[8-9],王占红等[10]研究认为去果皮户外沙藏效果更好,陈松树等[11]认为从育苗质量和管理成本考虑,建议多花黄精果实采摘搓洗后的种子和湿沙混匀放在室外贮藏,待次年2月底播种较好。【本研究切入点】陈怡等[9,12]研究表明黄精 在4 ℃湿沙层积和28 ℃催芽萌发条件下的内源激素吲哚-3-乙酸(IAA)、反式玉米素核苷(tZR)、赤霉素A3(GA3)、脱落酸(ABA),淀粉酶、抗氧化酶、葡萄糖-6-6磷酸脱氢酶(G-6-PDH)等酶活性,可溶性糖、可溶性蛋白、淀粉等贮藏物质的变化。成京晋等[13]研究表明黄精在20℃、4 ℃和20 ℃与4 ℃交替等3种温度模式下湿沙层积70 d的内源激素IAA、CTK、GA3、ABA的变化,在自然变温条件下湿沙层积至种子大量萌发过程的生理变化、多花黄精层积过程中茉莉酸类、水杨酸类及乙烯类内源激素含量变化左究鲜见报道。【拟解决的关键问题】本研究采用湿沙层积的方法,探究在自然变温条件下多花黄精种子从采后到大量萌发5个月间的主要贮藏物质含量及酶活性变化,并采用超高效液相色谱-三重四极杆离子阱质谱联用(UHPLC-QTRAP-MS/MS)技术,测定7类共17种内源激素含量变化,研究自然变温条件下多花黄精萌发过程的生理变化,为缩短多花黄精种子萌发时间、提高萌发率的技术提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 仪器 UV-1780分光光度计(日本SHIMADZU公司);SCIEX 6500 QTRAP+三重四极杆质谱仪(美国SCIEX公司);ExionLC System超高效液相色谱仪(美国SCIEX公司);2.1 mm×150 mm, 1.7 μm Acquity UPLC CSH C18色谱柱(美国Waters公司);JXFSTPRP-24研磨仪(上海净信科技有限公司);YM-080S超声仪(深圳市方奥微电子有限公司);12 position固相萃取仪(德国 CNW Technologies公司);Oasis®PRiME HLB 1cc(30 mg)SPE固相萃取小柱(美国Waters公司)。
1.1.2 试剂 植物淀粉含量试剂盒、植物纤维素含量试剂盒、可溶性糖含量试剂盒、BCA法可溶性蛋白含量试剂盒、超氧化物歧化酶(SOD)活性试剂盒、过氧化物酶(POD) 活性试剂盒、过氧化氢酶(CAT)活性试剂盒、α-淀粉酶试剂盒、β-淀粉酶试剂盒、6-磷酸葡萄糖脱氢酶(6-PGDH) 试剂盒、烟酰胺腺嘌呤二核苷酸激酶(NADK)活性试剂盒(苏州科铭生物技术有限公司);3-吲哚丁酸(批号G162446,德国DR.E公司);顺式玉米素(批号001-0321,捷克Olchemim公司);3-吲哚乙酸、水杨酸(美国Merck-SIGMA公司);3-吲哚甲醛(梯希爱上海化成工业发展有限公司);吲哚-3-乙酸甲酯、异戊烯基腺苷、反式玉米素核苷、反式-玉米素、激动素、赤霉素A1、赤霉素A4、赤霉素A7、(±)-茉莉酸(+)-脱落酸(加拿大TRC公司);二氢茉莉酸、N6-异戊烯基腺嘌呤(上海安谱实验科技股份有限公司);二氢玉米素、(±)-茉莉酸-异亮氨酸、茉莉酮酸甲酯、水杨酸甲酯、1-氨基环丙烷羧酸(上海甄准生物科技有限公司,试剂纯度均大于98%);赤霉素 A3(捷克Olchemim公司,纯度>90%);试验用水为超纯水;甲醇、乙腈、甲酸均为色谱纯(德国CNW Technologies公司),其余试剂均为分析纯。
1.1.3 种子材料 试验材料(自然成熟的果实)于2019年10月15日采自福建省邵武市和平镇多花黄精种植基地,经福建省农业科学院陈菁瑛研究员鉴定为多花黄精Polygonatum cyrtonemaHua。
1.2 试验方法
1.2.1 多花黄精种子处理及取样 果实发酵1周后,揉搓去掉果皮、果肉,漂洗干净,拌5倍体积细河沙层积,细河沙湿度约30%左右、以手握成团一触即散为度。层积处理的种子放置于室外避雨处,定时少量补水以维持沙子的湿度,每隔1个月取样15 g,平均分成6份,每份2.5 g,液氮速冻后-80 ℃保存备用,样品信息见表1,层积期间气温变化见图1。

表1 样品信息Table 1 Information on specimens
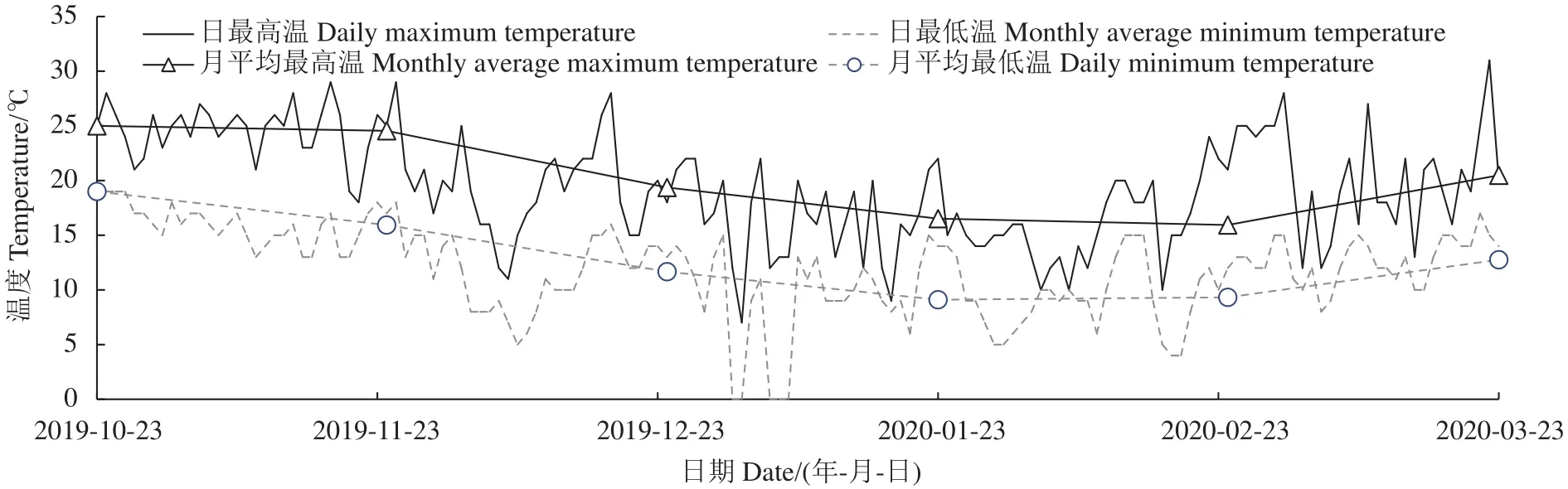
图1 多花黄精种子层积期间气温变化Fig.1 Temperature changes during P.cyrtonema seeds stratification
1.2.2 贮藏物含量及酶活力变化测定 取每阶段多花黄精种子-80 ℃冻存鲜样3份,研磨粉碎后称取适量测定淀粉、纤维素、可溶性糖(SS)、可溶性蛋白(SP)含量,以及超氧化物歧化酶(SOD)、过氧化物酶 (POD)、过氧化氢酶(CAT)、α-淀粉酶、β-淀粉酶,6-磷酸葡萄糖脱氢酶(6-PGDH)、烟酰胺腺嘌呤二核苷酸激酶(NADK)活性,按照对应试剂盒说明书进行操作。
1.2.3 内源激素提取 取每阶段多花黄精种子-80 ℃冻存鲜样3份,加入液氮采用研磨仪60 Hz研磨60 s后,精密称取25 mg粉碎后的样品,加入1 000 μL-40 ℃预冷的含同位素内标混合物50%乙腈水溶液,涡旋30 s,冰水浴超声5 min;40 Hz研磨4 min,冰水浴超声5 min,重复2次;10 000 r·min-14 ℃离心15 min;采用固相萃取小柱纯化收集洗脱液并氮气吹干,用100 μL 10%乙腈水溶液复溶,60 Hz匀浆 4 min,冰水浴超声 5 min;12 000 r·min-14 ℃ 离心10 min,取上清液过0.22 μm微孔滤膜,即得供试品溶液。
1.2.4 内源激素测定 使用EXIONLC System超高效液相色谱仪,液相色谱柱为Acquity UPLC CSH C18(150 mm× 2.1 mm,1.7 μm);流动相水(含0.01%甲酸)(A)-乙腈(含0.01%甲酸)(B)进行梯度洗脱(0~2.0 min,95% A;2.0~11.0 min,95%~43%A;11.0~11.1 min,43%~1% A;11.1~12.5 min,1% A;12.5~12.6 min,1%~95% A;12.6~15.0 min 95% A);柱温 50°C,流速 0.4 mL·min-1,样品盘设为4°C,进样量为 5 μL。使用装备 IonDrive Turbo V ESI离子源的SCIEX 6500 QTRAP+三重四极杆质谱仪,以多反应监测(MRM)模式进行质谱分析。离子源参数:离子化电压=±4 500 V,离子源温度475 ℃,气帘气压力:40 psi,喷雾气:30 psi,辅助加热气:30 psi。将目标化合物标准溶液引入质谱中,针对每个目标化合物,选取信号强度最高的数个母离子-子离子对(transition),对其MRM参数进行优化,并选取其中响应最好的离子对用于定量分析,具体参数见表2,使用SCIEX Analyst Work Station Software(Version 1.6.3)和Sciex MultiQuant™ 3.0.3进行质谱数据采集及目标化合物定量分析。
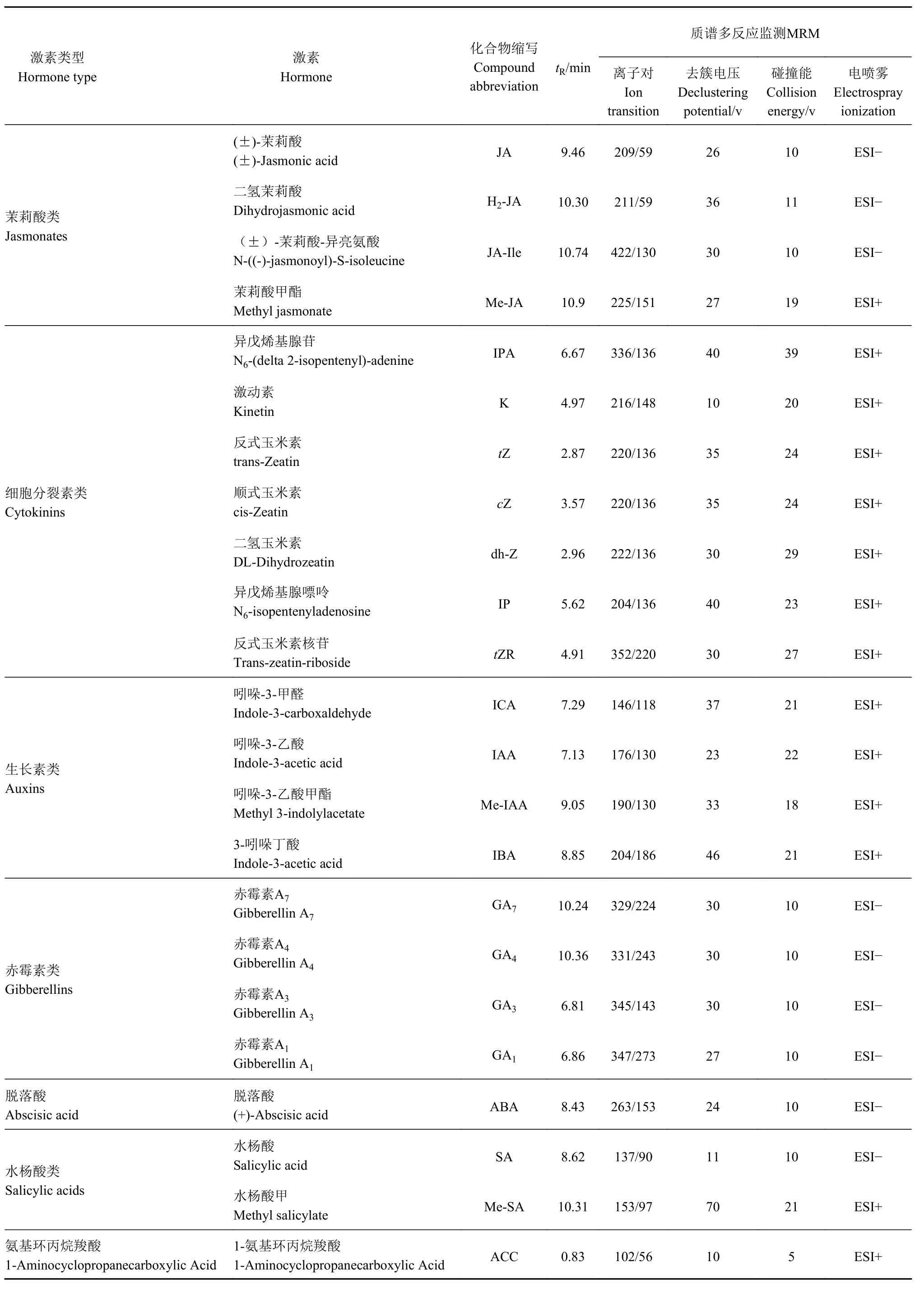
表2 23种目标成分测定中优化的质谱条件参数Table 2 Optimized MS/MS parameters on 23 components
1.2.5 内源激素方法学考察 参考Šimura等[14]的方法,结果表明,色谱峰峰面积与化合物浓度间呈良好的定量关系,相关系数(r)均大于0.996。精密度、重复性、稳定性的方法学考察的标准相对偏差(RSD)值均小于3.03%;平均回收率为96.78%~113.82%,RSD值均小于10.28%,该方法能够准确可靠地检测出样品中的目标激素含量。
1.3 数据统计与分析
采用Excel 2010 软件进行数据整理、绘图,应用SPSS 19.0软件进行多重比较和双变量相关性分析,差异显著性检验采用Duncan’s法,相关性采用Pearson相关系数表示。
2 结果与分析
2.1 贮藏物质含量变化
2.1.1 淀粉含量变化 淀粉含量变化是种子代谢状况的重要指标。层积过程多花黄精种子的淀粉含量呈连续下降的趋势(图2-A),2019-10-23含量为85.4 mg·g-1,2020-03-23 降至 57.5 mg·g-1,较层积初始下降了32.7%,表明层积阶段多花黄精种子淀粉持续分解,为贮藏和萌发提供能量。
2.1.2 纤维素含量变化 纤维素是植物细胞壁的主要结构成分。层积过程多花黄精种子的纤维素含量呈持续下降的趋势(图2-B)。层积第一个月下降较快,2019-10-23 时含量为 263.5 mg·g-1,2020-11-23 降至225.2 mg·g-1,下降了14.55%,之后降幅不显著,2020-03-23较层积初始下降了19.8%,表明层积阶段多花黄精细胞壁发生降解弱化,并为贮藏和萌发提供能量。
2.1.3 可溶性糖含量变化 SS在种子萌发过程中可作为直接能量来源,同时又参与渗透调节,与抗寒性相关[15]。层积过程多花黄精种子的SS含量呈降-升-降-升的趋势(图2-C),2019-11-23降至18.8 mg·g-1,可能是层积过程呼吸作用消耗所致;之后受环境低温影响缓慢上升,2020-01-23升至28.8 mg·g-1;2020-02-23小幅下降;萌发后由于贮藏的淀粉大量分解,SS含量迅速上升至35.1 mg·g-1,较最低值提高了86.14%,表明SS含量变化与抗寒和萌发物质动员有关。
2.1.4 可溶性蛋白含量变化 SP多数是参与各种代谢的酶类,也是重要的渗透调节物质和营养物质,SP的积累有利于抗寒性的提高[16]。层积过程多花黄精种子的SP含量呈下降-上升-下降的趋势(图2-D),2019-11-23较2019-10-23下降了13.8%,可能是由于层积过程部分SP转化成贮藏蛋白;之后缓慢上升,2020-01-23 达到最高值,为 47.9 mg·g-1,2020-01-23至2020-02-23受环境低温影响维持在较高水平;萌发后迅速降至24.1 mg·g-1,较最高值降低了49.8%,这主要是新组织形成和分化的消耗造成,表明SP含量变化与抗寒和萌发物质动员有关。
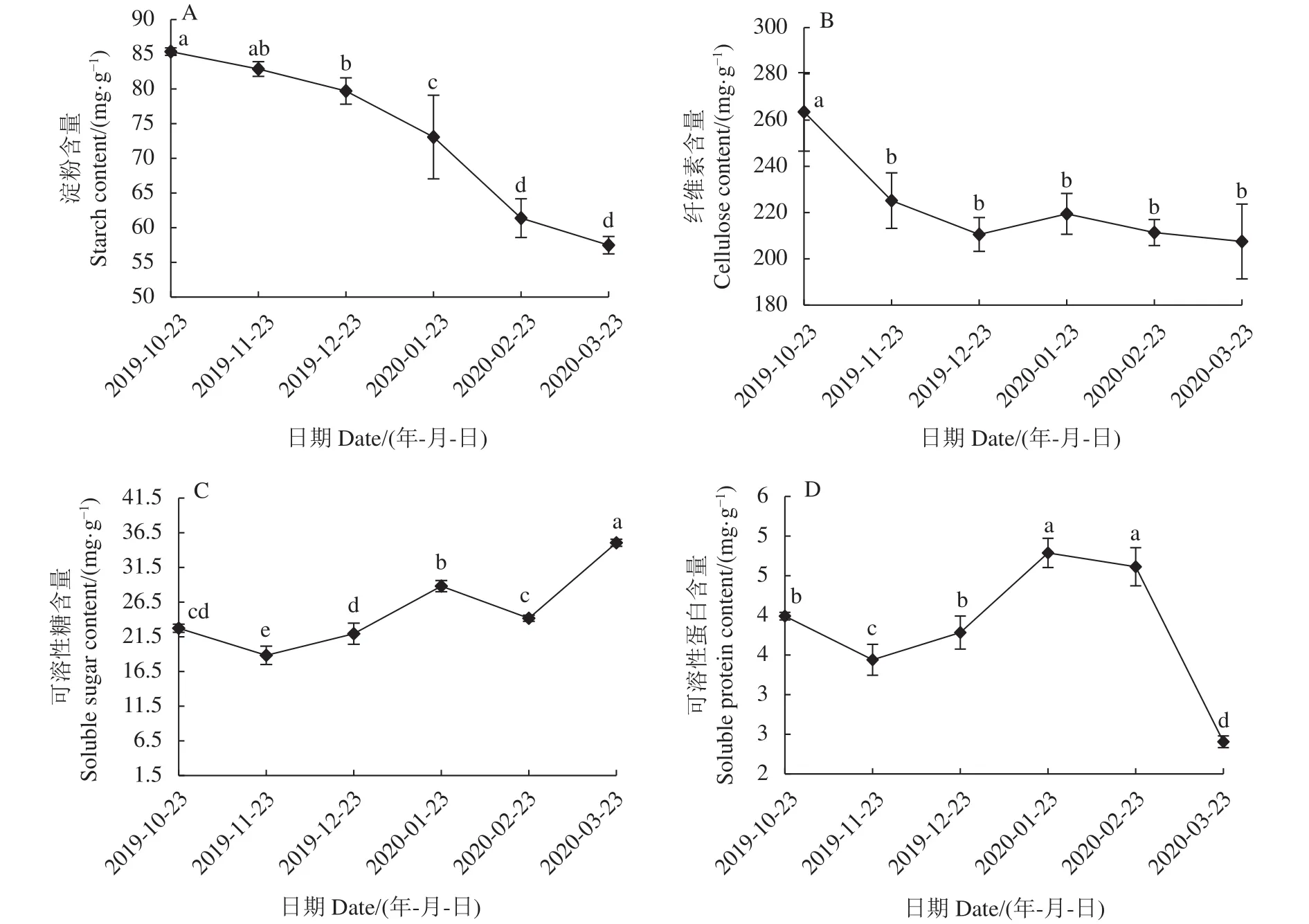
图2 多花黄精种子层积过程贮藏物质含量变化Fig.2 Changes on accumulated substances in P.cyrtonema seeds during stratification
2.2 酶活力变化
2.2.1 保护酶活性变化 SOD、POD、CAT是植物细胞内较为重要的保护酶,它们协调作用,防止细胞内活性氧水平过高,低温胁迫可诱发酶活性上升[16]。层积过程多花黄精种子的SOD、POD活性变化趋势均为降-升-降,CAT活性变化趋势为先升后降(图3-A、B、C)。2019-11-23时,SOD、POD酶活性较2020-10-23显著下降,CAT酶活性较2020-10-23略有上升但不显著,之后3个保护酶活性持续上升,2020-01-23达到最大值后持续下降。2020-01-23时3个保护酶活性升高至峰值,很可能受到环境低温的影响。
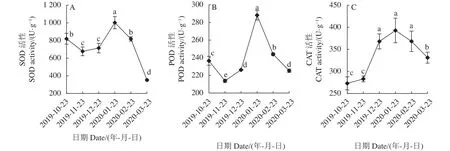
图3 多花黄精种子层积过程期SOD、POD、CAT活性变化Fig.3 Changes on SOD, POD, and CAT activities in P.cyrtonema seeds during stratification
2.2.2 淀粉酶活性变化 淀粉酶根据作用的方式可分为α-淀粉酶与β-淀粉酶,二者共同将淀粉分解成麦芽糖、葡萄糖、糊精等可溶性糖类物质。后熟过程多花黄精种子的α-淀粉酶活性变化趋势为降-升-降-升变化,β-淀粉酶活性呈升-降-升变化,二者均在2020-01-23和2020-03-23活性显著提高,与SS含量的变化趋势相同,表明SS含量变化与淀粉酶作用密切相关。(图4-A、B)。

图4 多花黄精种子层积过程α-淀粉酶、β-淀粉酶活性变化Fig.4 Changes on α- amylase and β-amylase activities in P.cyrtonema seeds during stratification
2.2.3 6-PGDH和NADK活性变化 许多休眠种子的休眠解除都检测到与磷酸戊糖途径(PPP)有关[17],6-PGDH是PPP的关键限速酶,能够催化6-磷酸葡萄糖脱氢,形成6-磷酸葡糖酸,同时将NADP+还原为NADPH,用于脂肪酸等的还原性生物合成。后熟过程多花黄精种子6-PGDH活性变化趋势为升-降-升(图5-A),2019-11-23活性较2019-10-23显著升高,表明采后1个月种子内部仍在进行较强的还原性生物合成;2019-11-23至2020-02-23活性持续下降,2020-02-23降至最低,表明萌发前物质合成作用不断减弱;2020-03-23的升高则表明萌发后随着新组织形成,生物成合成作用再次加强。NADK能催化NAD+磷酸化,生成NADP+,其活性增加有利于抑制电子传递,降低呼吸作用[18]。多花黄精种子NADK活性变化趋势为降-升-降(图5-B),2019-10-23至2020-01-23变化较为平缓;2020-02-23迅速升高后大幅下降,表明萌发前的呼吸代谢受到明显的抑制;萌发后NAD激酶活性大幅下降,表明萌发后电子传递活跃,呼吸作用增强。

图5 多花黄精种子层积过程6-PGDH、NADK酶活性变化Fig.5 Changes on 6-PGDH and NADK activities in P.cyrtonema seeds during stratification
2.3 营养物质与酶活力含量相关性
由表3可知,纤维素含量与淀粉含量呈显著正相关;SS含量与α-淀粉酶、β-淀粉酶活性之间均呈极显著正相关;淀粉含量与SS含量、α-淀粉酶、β-淀粉酶活性呈显著或极显著负相关;SP含量与SOD、POD酶活性呈极显著正相关,与β-淀粉酶、6-PGDH酶活性呈显著负相关;SOD与POD、NADK酶活性呈极显著正相关;POD和CAT酶活性呈极显著正相关;NADK酶活性与SS含量、α-淀粉酶、β-淀粉酶活性呈显著或极显著负相关,与SP含量呈极显著正相关;6-PGDH与NADK酶活性呈显著负相关。表明纤维素和淀粉的变化趋势相同,淀粉在淀粉酶的作用下转化为SS,淀粉酶活性增强分解成SS表明呼吸作用加强,与NADK酶活性的作用相反,3个保护酶之间的变化有一定的正相关性。
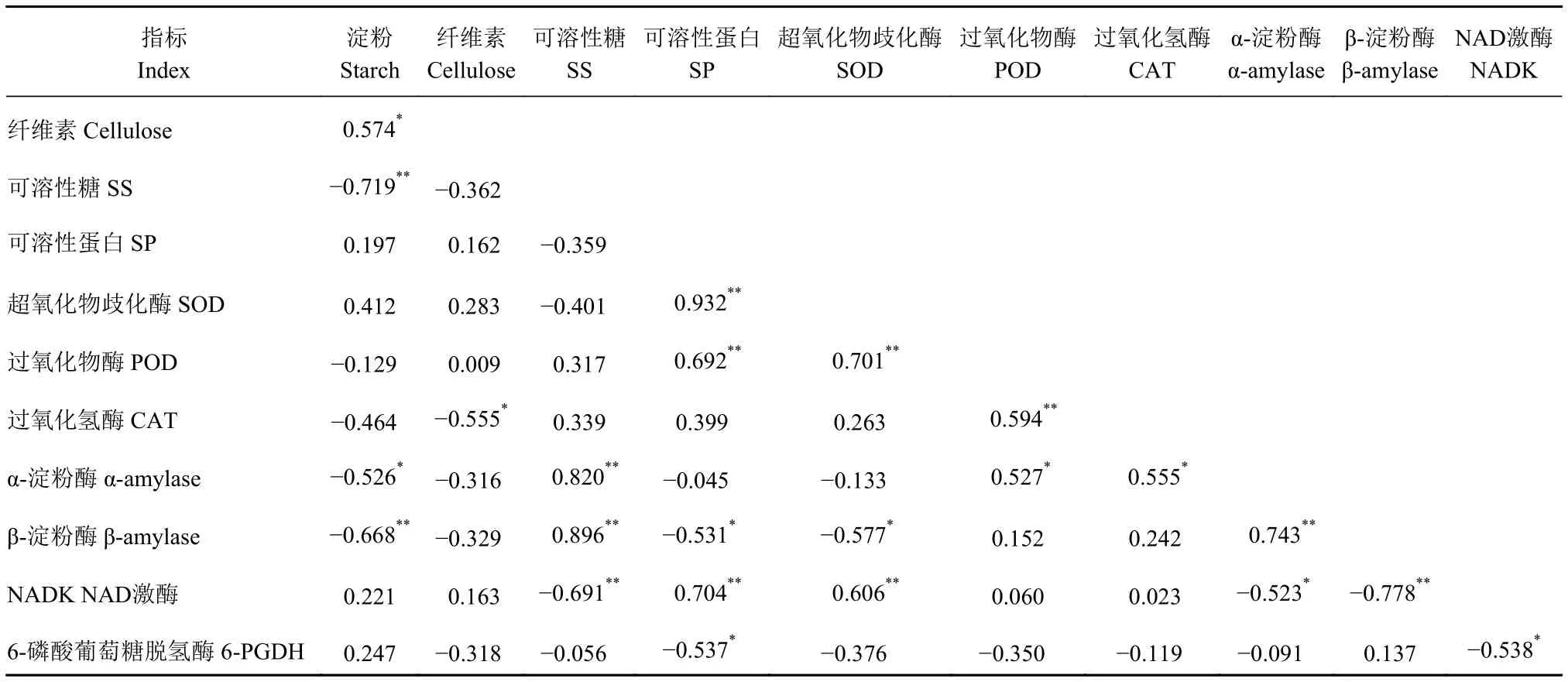
表3 多花黄精种子层积过程贮藏物质与酶的相关性Table 3 Correlation between accumulated substances and enzymes of P.cyrtonema seeds during stratification
2.4 17种内源激素含量变化
基于UHPLC-QTRAP-MS/MS技术测定了多花黄精种子层积过程中6个不同时期的7大类23种内源激素含量,共测出17种内源激素,包括3种茉莉酸类、7种细胞分裂素类、3种生长素类,以及GA7、ABA、SA、ACC,结果见图6~9。
2.4.1 茉莉酸类物质含量变化 茉莉酸类物质是参与调控种子萌发的一个重要内部因素,其与脱落酸(ABA)协同抑制种子的萌发[19]。由图6可知,层积过程多花黄精种子的JA、JA-Ile含量变化均为先显著升高后降低,且分别在2019-12-23和2020-01-23含量达到最高,较层积初始分别提高了6.0倍和9.6倍,H2-JA含量在前、中期较高,后逐渐下降。至萌发后 JA、JA-Ile已无法测出,仅能测出H2-JA。表明茉莉酸类物质通过在层积的前中期交替升高来维持种子的休眠状态。
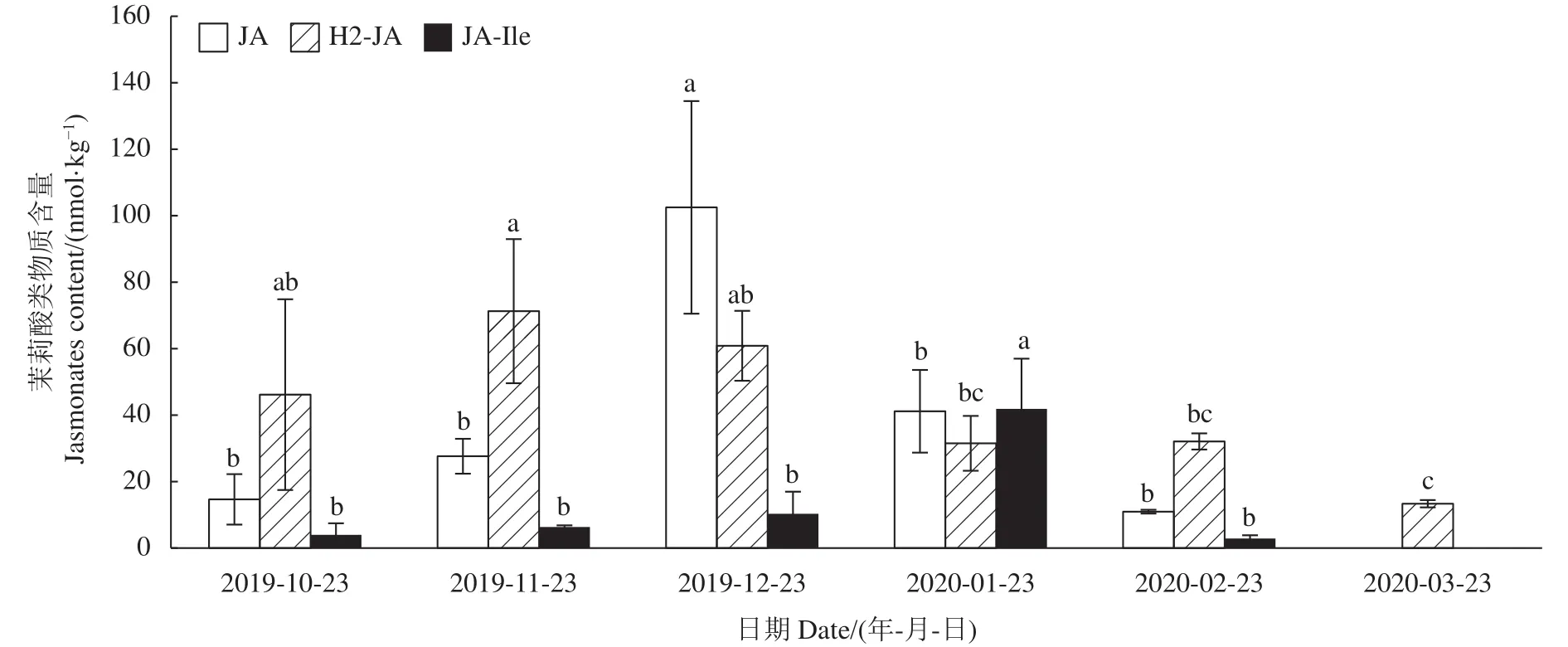
图6 多花黄精种子层积过程茉莉酸类物质含量变化Fig.6 Changes on jasmonates content in P.cyrtonema seeds during stratification
2.4.2 细胞分裂素类物质含量变化 细胞分裂素(CTK)能通过与乙烯、ABA、生长素、赤霉素(GAS)等相互作用影响种子的萌发和幼苗早期发育[20-21]。由图7可知,层积过程多花黄精种子的IPA、K、tZ、cZ、dh-Z含量均呈连续下降的趋势,IP、tZR含量在 2019-10-23分别为 10.3、10.9 nmol·kg-1,之后连续缓慢下降,2020-02-23分别降至2.6、3.7 nmol·kg-1,萌发后分别快速升高至 21.3、8.6 nmol·kg-1,分别较2020-02-23上升了7.3、1.3倍,表明IP、tZR促进萌发。
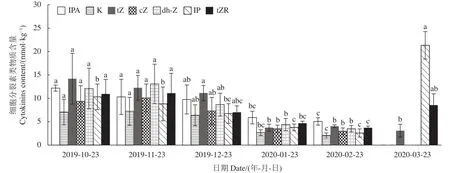
图7 多花黄精种子层积过程细胞分裂素类物质含量变化Fig.7 Changes on cytokinins content in P.cyrtonema seeds during stratification
2.4.3 生长素类物质含量变化 由图8可知,多花黄精种子的IAA含量在层积一个月后从1 775.4 nmol·kg-1急剧下降至 263.1 nmol·kg-1,较层积初始下降了85.18%,至萌发前变化较为平缓;ICA、ME-IAA在采收后同样呈下降趋势,表明生长素类含量在层积过程中降低。萌发后由于胚的生长,IAA显著升高至1 211.4 nmol·kg-1,较 2020-02-23 上升了 5.3 倍; ICA显著升高至 148.4 nmol·kg-1,较 2020-02-23 上升了2.6倍,表明ICA、IAA促进萌发。
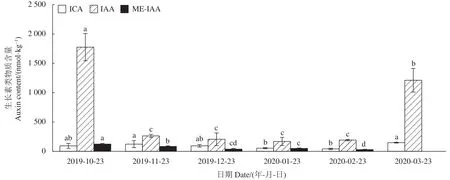
图8 多花黄精种子层积过程生长素类物质含量变化Fig.8 Changes on auxins content in P.cyrtonema seeds during stratification
2.4.4 GA7含量变化 GA在种子萌发过程中起到增加胚的生长势和弱化包围胚根的屏障组织作用[22]。本研究测定了GA1, GA3, GA4和 GA7,仅测出GA7含量。由图9-A可知,层积过程多花黄精种子的GA7含量呈上升趋势。2019-10-23时含量仅为6.0 nmol·kg-1,2020-02-23升至231.7 nmol·kg-1,较层积初始上升了37.4倍,刚萌发时升至1 897.1 nmol·kg-1,较2020-02-23提高了7.2倍,表明GA7促进休眠解除和萌发。
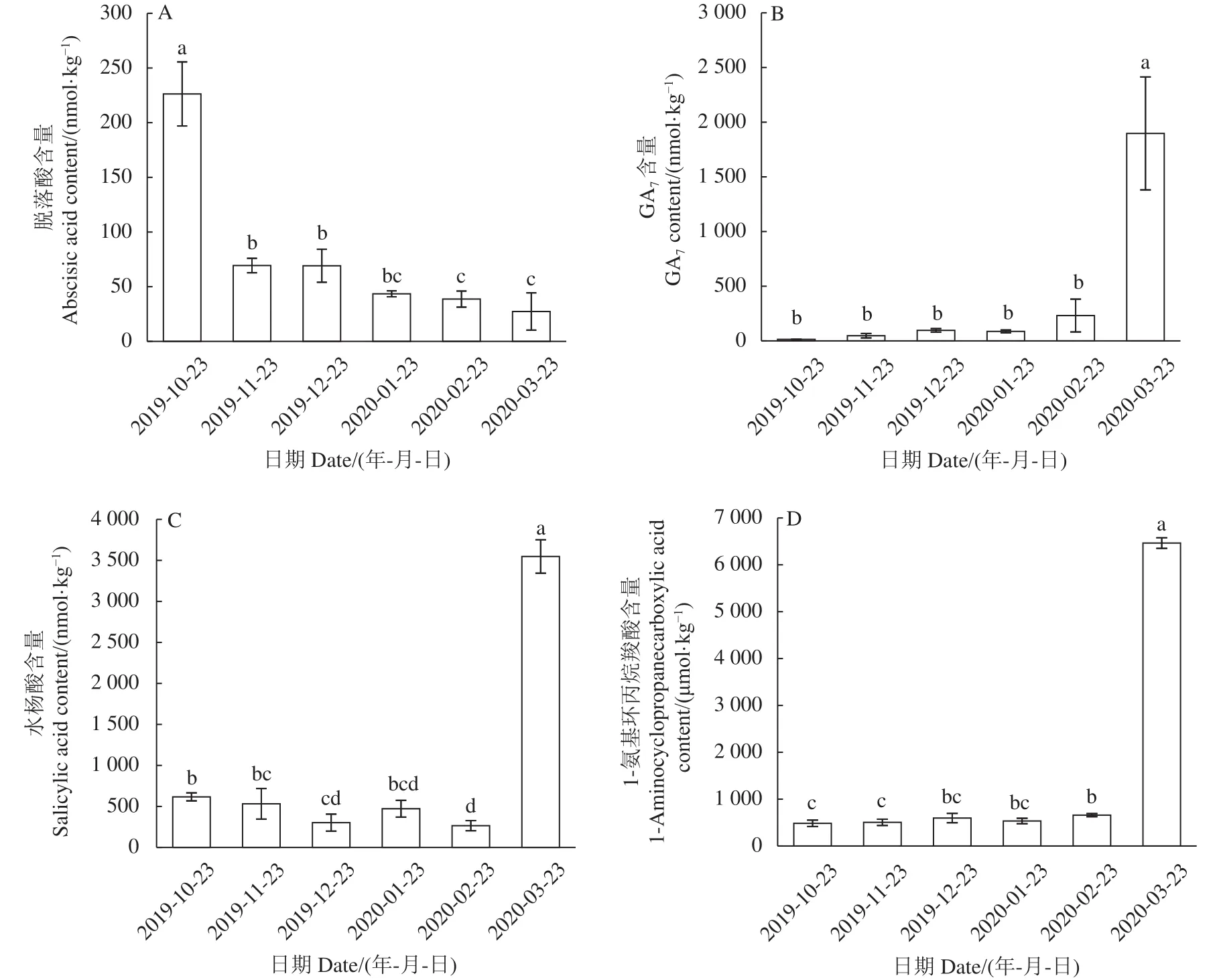
图9 多花黄精种子层积过程赤霉素A7、脱落酸、水杨酸、1-氨基环丙烷羧酸含量变化Fig.9 Changes on GA7, ABA, SA, and ACC contents in P.cyrtonema seeds during stratification
2.4.5 ABA含量变化 ABA是种子休眠诱导和维持的正调控因子,萌发的负调控因子[23]。由图9-B可知,层积过程多花黄精种子的ABA含量呈连续下降趋势。层积第一个月ABA含量从226.3 nmol·kg-1下降至69.4 nmol·kg-1,较层积初始下降了69.3%,刚萌发时降至27.3 nmol·kg-1,较层积初始下降了87.9%,表明ABA含量下降促进休眠解除和萌发。
2.4.6 SA含量变化 SA是一种酚类激素,不仅可以诱导植物抗逆反应,还具有促进种子萌发和幼苗生长的作用[24]。由图9-C可知,的SA含量在萌发前呈小幅波动趋势,萌发后急剧上升,较2/23未萌发时上升了12.4倍,表明SA促进萌发。
2.4.7 ACC含量变化 ACC为高等植物内源乙烯的前体物质,在氧化酶的作用下转化为乙烯[25]。由图9-D可知,层积过程多花黄精种子的ACC含量呈连续上升趋势。2019-10-23 时含量为 484.2 μmol·kg-1,2020-02-23 升至 658.3 μmol·kg-1,较层积初始上升了36.0%,刚萌发时急剧上升至 6 464.0 μmol·kg-1,较2020-02-23提高了8.8倍,表明ACC促进休眠解除和萌发。
3 讨论与结论
3.1 层积对多花黄精种子贮藏物质含量与酶活性的影响
陈怡[12]测得刚采摘的多花黄精种子淀粉含量为42.12%,认为其种子为淀粉性种子,而本研究测得多花黄精种子淀粉、纤维素含量最高值分别为8.5%和26.4%,纤维素含量为淀粉的3倍以上。对于多花黄精同属植物黄精(Polygonatum sibiricumRed.)的淀粉测定也有类似差异,张玉翠[26]测得黄精鲜种子的淀粉含量为30%~40%,而程秋香[27]测得鲜黄精种子的淀粉8.50%,纤维素含量高达32.10%,且认为纤维素等是胚乳的主要代谢物质。本研究测得多花黄精种子初始层积至萌发期间,淀粉和纤维素含量分别下降了32.7%和19.8%,认为二者均为种子的主要代谢物质。陈怡[12]测得的酶活性及贮藏物质的变化趋势与本研究有较大不同,可能是层积温度不同导致,本研究中SS、SP以及3种保护酶和淀粉酶含量均在2020-01-23的取样中显著提高,很可能是植物对低温天气的适应性生理反应,2019-12-23至2020-01-23期间的最低温达到了0 ℃,为全年最低。冷害胁迫可导致植物活性氧的增加[28],而活性氧在种子萌发和休眠解除方面发挥着重要的信号作用[29],活性氧参与生长组织的细胞壁松弛,分解细胞壁多糖、调节激素在细胞生长中的作用[30],推测低温处理有助于多花黄精种子的休眠解除。
3.2 层积对多花黄精种子内源激素含量的影响
成京晋等[13]测定了层积前70 d的种子IAA、GA3、CTK和ABA的含量变化,测定结果多为波动变化,无明显变化规律。陈怡等[9]采用HPLC-MS的检测方法,测定了多花黄精种子萌发过程的IAA、GA3、tZR和ABA含量变化,其中在层积至刚萌发阶段,ABA含量呈连续下降趋势与本研究相同,IAA、tZR含量变化趋势为层积中期达到最高值与本研究不同,GA3含量的变化规律与本研究测得的GA7变化规律相同,但本研究未测得GA3含量,可能的主要原因是层积温度以及测定方式的不同,其在种子洗去外种皮后有一个晾干水分备用的过程,且采用4 ℃低温层积,而本研究在洗去外种皮后立即采用自然变温沙藏,且本研究由于同时测定多个指标,具有一定的侧重性和偏向性,无法测得含量相对较低的个别指标,但仍可表明多花黄精种子层积至萌发过程中GA7含量高于GA3含量。
多花黄精种子萌发过程中的茉莉酸类物质含量变化尚未见报道。茉莉酸可被甲基化为其挥发性对应物Me-JA,或与各种糖和氨基酸结合,其中以JAIle含量最为丰富[31]。Pan等[32]发现一种JA-Ile的结构类似物能显著增强ABA对种子萌发的抑制效应,并揭示了拟南芥种子萌发过程中茉莉酸盐对脱落酸信号协同作用的分子机制。Wang等[33]研究发现ABA促进JA的生物合成,协同抑制水稻种子发芽。本研究测得的H2-JA、JA、JA-Ile分别在ABA含量大幅下降后陆续提高,在萌发前降至较低值,表明茉莉酸类物质同样协同ABA抑制多花黄精种子萌发。有报道,Me-JA能抑制玉米种子[34]、黄色羽扇豆[35]等种子的萌发,但本研究并未测得Me-JA,表明Me-JA不是多花黄精种子休眠中的主要调控物质。
高等植物中的CTK以IP、tZ、cZ、dh-Z、K,以及tZ和IP型糖的结合物tZR和IPA较为常见,它们在不同植物和组织发育阶段的分布和作用不同,其中tZ型具有普遍的生物活性,cZ型活性较弱,但二者在植物界中广泛存在,且cZ型是植物生长受限条件下CTK应答的精细调节因子[36-37]。本研究测得以上常见的7种CTK在多花黄精种子休眠阶段含量均呈下降趋势,萌发时仅IP和tZR含量显著升高,表明IP和tZR为主要促进萌发的CTK。
植物生长素主要由吲哚类化合物组成,包括IAA、ICA、ME-IAA、IBA等,其中IAA为最主要的代表性成分。在拟南芥中,IAA在休眠过程中起正向调控作用,是第二类促进种子休眠的激素[38]。本研究发现,层积过程多花黄精种子的生长素类物质含量不断下降,至萌发时再次上升,表明在多花黄精种子中生长素同样有促进休眠的作用。
GA是一个四环二萜类的植物激素家族,目前已鉴定出136种GA结构,其中大多数GA是无生物活性的,主要的生物活性GA包括GA1,GA3,GA4和GA7
[22]。马焕普等[39]发现,苹果种子内不同种类GA的发生器官不同,子叶中以GA3为主,胚轴中以GA7为主, GA7可能通过促进胚轴中的合成代谢而直接参与胚轴休眠的解除,而GA3的变化受温度影响较大,低温处理后显著升高。因此,陈怡[9]测得GA3可能与4 ℃低温层积处理有关。此外,多花黄精种子萌发前胚呈棒状[5],并未分化出子叶结构,因此推测在萌发前起主要活性作用的GA可能是GA7。在美洲商陆种子萌发中也发现,外源GA7的刺激作用强于GA3[40],表明不同赤霉素对萌发的促进效果不同。已有研究多采用GA3来促进多花黄精种子萌发[8],而本研究测得层积过程内源GA7含量相对较高,推测外源施用GA7对多花黄精种子萌发有更好的促进效果。ABA和GAs拮抗调节种子休眠和萌发已被多项研究报道[41-42],本研究发现多花黄精层积过程ABA含量下降,GA7含量上升,表明二者同样起拮抗作用。
外源SA浸种处理能提高种子萌发后对寒冷、盐、重金属等非生物胁迫的耐受性[43-45]。本研究中SA含量在未萌发时变化较小,萌发后含量显著升高,与葛娜等[46]对三七种子的研究结果相同。有报道在植物体内SA能大量转变为Me-SA,二者在一定剂量下对拟南芥的萌发和初期生长有促进作用[47]。但本研究并未测得Me-SA,表明Me-SA可能在多花黄精种子的萌发过程中不是主要调控物质。
种子的萌发能力与乙烯的产生有关,ACC为乙烯前体物质,外源施用能明显促进种子乙烯的生成及萌发[48-49],因此,本研究中内源ACC含量的升高很可能伴随着乙烯形成的增加,对休眠解除和萌发有促进作用。有研究表明ACC类似物乙烯利对打破黄精属种子的休眠有一定效果[50]。
综上,自然变温层积期间,淀粉和纤维素均为多花黄精种子的主要代谢物质,保护酶、淀粉酶及SS、SP含量不断变化,以适应温度等环境变化、完成萌发所需的物质储备,GA7、ACC含量不断增加,ABA、茉莉酸类、生长素类等萌发抑制物含量下降。3月中下旬气温回升,多花黄精种子休眠解除开始大量萌发,内源激素GA7和ACC促进休眠解除和萌发;生长素ICA、IAA,细胞分裂素IP、tZR以及水杨酸促进萌发。因此,在多花黄精种子收获后可采用洗去种皮果肉,室外保湿沙藏至2月底进行催芽,可采用ACC或GA7进行催芽,以加速打破休眠,萌发后根据生长情况采用生长素、细胞分裂素、水杨酸等物质进行组合调控,具体效果有待进一步研究。
