黄芪甲苷对慢性间歇性缺氧诱导血管内皮功能障碍的保护作用
2022-12-04王洪新鲁美丽
赵 芳, 王洪新, 鲁美丽, 孟 岩
(锦州医科大学心脑血管药物研究重点实验室,辽宁 锦州 121001)
阻塞性睡眠呼吸暂停是指在睡眠过程中上气道部分或完全堵塞[1],导致间歇性缺氧、复氧,这些病理生理改变通过引发氧化应激、内皮功能障碍,进而促进心血管疾病的发展[2-4]。内皮功能障碍的主要特征是一氧化氮(nitric oxide,NO)的生成或生物利用度降低及血管张力改变[5],内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)是一种组成性表达的酶,调控着血管系统中NO生成。Calpain-1作为calpain家族中的主要研究对象,是一种Ca2+依赖性半胱氨酸蛋白酶,在内皮细胞中表达,其过度激活参与多种疾病的生物过程,并被证明影响NO的生成[6]。研究已表明,抑制calpain可减轻心血管疾病的内皮功能障碍[7]。
黄芪甲苷是从黄芪中提取纯化的天然小分子化合物,具有抗炎、抗纤维化、抗氧化应激、抗糖尿病等多种药理活性[8]。课题组前期研究发现,黄芪甲苷对高糖诱导内皮损伤具有保护作用[9],也有研究报道,其能抑制阻塞性睡眠呼吸暂停导致的心肌损害及炎症[10-11],但在血管内皮功能方面的研究尚不明确。因此,本实验主要探讨黄芪甲苷对阻塞性睡眠呼吸暂停引起的血管内皮功能障碍的影响,并研究其可能的机制。
1 材料与方法
1.1 试剂与药物 黄芪甲苷(纯度≥98.0%, 批号JZ2018011017,南京景竹生物科技有限公司)。超氧化物阴离子荧光探针(dihydroethidium,DHE)、总超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、总谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(批号S0063、S0101S、S0131S、S0056,上海碧云天生物技术有限公司);calpain-1兔多克隆抗体(批号10538-1-AP,武汉三鹰生物技术有限公司);eNOS兔多克隆抗体、β-actin兔单克隆抗体(批号A1548、AC026,武汉爱博泰克生物科技有限公司);L-NAME(批号S2877,上海蓝木化工有限公司);苏木素-伊红(HE)染料、NO试剂盒(批号D006-1-3、A012-1-2,南京建成生物工程研究所);肾上腺素(phenylephrine,PE)、乙酰胆碱(acetylcholine,ACh)[批号P1240000、A6625,西格玛奥德里奇(上海)贸易有限公司]。
1.2 动物 健康雄性C57BL/6小鼠40只,10~12周龄,体质量(25±5)g,由辽宁长生生物技术股份有限公司提供,动物生产许可证号SCXK(辽)2020-0001。
1.3 仪器 ProOx-100型编程式间歇氧浓度实验系统(上海塔望智能科技有限公司);DMT720M型离体微血管张力测定仪(丹麦Myotechnology公司);高速台式大容量离心机(德国Hermle公司);电泳系统、半干转转膜仪、化学发光成像仪(美国Bio-Rad公司);NM-9602G 型酶标分析仪(美国Thermo Fisher Scientific公司);DMI3000B型显微镜(德国Leica公司);SIM-F140AY65-PC型制冰机(日本大阪松下电器产业株式会社)。
1.4 分组及给药 将小鼠随机分为空白组、模型组和黄芪甲苷低、高剂量(40、80 mg/kg)组,每组10只,适应饲养3 d后,将模型组和黄芪甲苷各剂量组小鼠放入间歇氧浓度实验系统动物舱,交替给予90 s低氧(5% O2)及常氧(21% O2),每天重复8 h,共4周[10],空白组小鼠置于正常氧浓度的同等条件动物舱中。于造模第1天开始,黄芪甲苷各剂量组小鼠灌胃给予黄芪甲苷(溶于0.5%羧甲基纤维素钠中),空白组和模型组小鼠灌胃给予等体积0.5%羧甲基纤维素钠,连续4周。
1.5 样本采集 小鼠使用20%乌拉坦(7 mL/kg)进行麻醉,摘眼球取血,3 600 r/min离心5 min,取血清,保存待测。再取出胸主动脉组织,部分用于HE、DHE染色,部分进行离体血管环实验,部分置于-80 ℃冰箱中保存。
1.6 小鼠离体血管环实验 将收集的胸主动脉置入提前预冷的PSS营养液[NaCl(130 mmol/L)、KCl(4.7 mmol/L)、KH2PO4(1.18 mmol/L)、MgSO4(1.17 mmol/L)、CaCl2(1.16 mmol/L)、NaHCO3(14.9 mmol/L)、EDTA(0.026 mmol/L)、glucose(11.1 mmol/L)]中,在显微镜下去除周围脂肪及结缔组织,并切割成约2 mm长的血管环,采用离体微血管张力测定仪测量记录各血管环张力变化。在正式实验前,使用K-PSS(PSS溶液中加入60 mmol/L KCl)激活血管环,如果2次收缩幅度差小于10%,则认为血管收缩相对稳定,可用于后续实验。再用1.0×10-5mol/L PE预收缩血管环,待曲线达到平台期后加入累积浓度(1.0×10-8、3.0×10-8、1.0×10-7、3.0×10-7、1.0×10-6、3.0×10-6、1.0×10-5mol/L)ACh,绘制剂量依赖曲线。为确定NO对血管舒张的影响,各组血管环加入eNOS抑制剂L-NAME(100 μmol/L),并于预收缩前孵育30 min。
1.7 小鼠胸主动脉HE染色 胸主动脉固定于4%多聚甲醛中,24 h后包埋于石蜡中,切片后HE染色,观察主动脉细胞排列状态,测量中膜厚度。
1.8 小鼠胸主动脉ROS水平检测 DHE染色用于检测胸主动脉中活性氧(reactive oxygen species,ROS)生成情况。将各组胸主动脉组织进行冰冻切片,厚度为5 μm,然后滴加DHE染色液(5 μmol/L),在37 ℃下孵育30 min,PBS洗涤3次,每次5 min,再对细胞核进行染色,在荧光显微镜下观察,通过Image J软件进行分析。
1.9 小鼠血清GSH-Px、SOD活性和MDA、NO水平检测 采用相应试剂盒,按照说明书步骤分别检测血清GSH-Px、SOD活性和MDA、NO水平。
1.10 Western blot法检测小鼠胸主动脉中calpain-1、eNOS蛋白表达 取100 mg胸主动脉组织于1 mL裂解缓冲液(RIPA+1% PMSF)中裂解、均匀化,冰上超声30 s后,4 ℃、12 000 r/min离心20 min,取上清液用BCA法检测蛋白浓度,加入适量5×SDS上样缓冲液,100 ℃煮沸4 min,将样品置于8%~10% SDS-PAGE胶中,电泳槽中85 V电泳2 h,再置于转膜仪器中使其转移至PVDF膜上,加入1% BSA,室温摇床封闭1.5 h,随后加入calpain-1(1∶1 000)、eNOS(1∶1 000)、β-actin(1∶100 000)一抗,4 ℃孵育过夜,TBST洗涤3次,加入二抗,室温摇床孵育2 h,最后通过Image J软件分析各条带的灰度值。
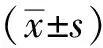
2 结果
2.1 黄芪甲苷对慢性间歇性缺氧小鼠胸主动脉形态学的影响 与空白组比较,模型组小鼠胸主动脉内皮细胞及血管平滑肌细胞的排列稍紊乱,中膜厚度增加(P<0.01);与模型组比较,黄芪甲苷各剂量组小鼠胸主动脉内皮细胞及血管平滑肌细胞排列较整齐,中膜厚度降低(P<0.01),见图1。
2.2 黄芪甲苷对慢性间歇性缺氧小鼠血管内皮依赖性舒张的影响 与空白组比较,模型组小鼠血管内皮依赖性舒张功能降低(P<0.01);与模型组比较,黄芪甲苷各剂量组小鼠血管内皮依赖性舒张功能提高(P<0.01),见图2。
2.3 eNOS抑制剂对黄芪甲苷保护慢性间歇性缺氧小鼠血管舒张的影响 为了证明黄芪甲苷对慢性间歇性缺氧小鼠的血管舒张的保护机制,各组血管环中加入eNOS抑制剂(L-NAME)预孵育30 min,结果如图3所示,各组小鼠的血管环对ACh均无舒张作用,表明L-NAME抵消了黄芪甲苷对间歇性缺氧小鼠血管舒张的保护作用,其动脉对ACh的舒张反应呈NO依赖性。
2.4 黄芪甲苷对慢性间歇性缺氧小鼠胸主动脉组织中ROS及血清NO水平的影响 与空白组比较,模型组小鼠胸主动脉组织中ROS水平升高(P<0.01),血清中NO水平降低(P<0.01);与模型组比较,黄芪甲苷各剂量组小鼠胸主动脉组织中ROS水平降低(P<0.01),血清中NO水平升高(P<0.05),见图4。
2.5 黄芪甲苷对慢性间歇性缺氧小鼠氧化应激的影响 与空白组比较,模型组小鼠血清中SOD、GSH-Px活性降低(P<0.01),MDA水平升高(P<0.01);与模型组比较,黄芪甲苷各剂量组小鼠血清中SOD、GSH-Px活性升高(P<0.01),MDA水平降低(P<0.01),见图5。
2.6 黄芪甲苷对慢性间歇性缺氧小鼠胸主动脉组织中calpain-1、eNOS蛋白表达的影响 与空白组比较,模型组小鼠胸主动脉组织中calpain-1蛋白表达升高(P<0.01),eNOS蛋白表达降低(P<0.01);与模型组比较,黄芪甲苷各剂量组小鼠胸主动脉组织中calpain-1蛋白表达降低(P<0.01),eNOS蛋白表达升高(P<0.01),见图6。
3 讨论
流行病学数据表明阻塞性睡眠呼吸暂停与心血管疾病有关[12-13],内皮功能障碍、氧化应激在其中发挥着重要作用[14]。持续正压通气作为阻塞性睡眠呼吸暂停患者的一线治疗方案,由于依从率低、对心血管事件的预防效果欠佳[15-16],故而迫切需要新的药物方法来提高患者的生活质量,并对心血管并发症进行预防。本实验结果表明,经过黄芪甲苷治疗后,小鼠动脉细胞排列状态及中膜厚度改善,说明黄芪甲苷对慢性间歇性缺氧小鼠动脉形态学改变具有保护作用;小鼠动脉组织ROS水平和血清MDA水平降低,SOD、GSH-Px活性均增加,说明黄芪甲苷能减轻慢性间歇性缺氧小鼠氧化应激;通过离体微血管张力检测,ACh诱导的血管舒张得到改善,且血清NO水平提升,说明黄芪甲苷改善了慢性间歇性缺氧小鼠内皮功能障碍。
calpain-1作为calpain家族的亚型之一,存在于内皮细胞中,其过度激活与NO介导的糖尿病、动脉粥样硬化的内皮功能障碍有着密切联系[17-19]。eNOS是一种组成性表达的酶,调控NO的生成,NO通过内皮细胞膜,扩散到邻近的平滑肌细胞中,从而促进血管舒张和血管张力降低[20]。据报道,eNOS是一种高度敏感的calpain底物,calpain介导后广泛降解,并抑制NO的产生[6]。因此,本课题组推断黄芪甲苷可能通过calpain-1/NO改善慢性间歇性缺氧诱导的内皮功能障碍。实验结果表明,eNOS抑制剂抵消了黄芪甲苷对慢性间歇性缺氧小鼠血管内皮依赖性舒张的保护作用,说明黄芪甲苷对慢性间歇性缺氧小鼠血管舒张功能障碍的保护作用是通过NO介导的,通过检测小鼠动脉组织calpain-1和eNOS蛋白表达,黄芪甲苷能降低慢性间歇性缺氧小鼠calpain-1蛋白表达,并增加eNOS蛋白表达,说明其能通过calpain-1/NO信号通路改善间歇性缺氧诱导的血管内皮功能障碍。
综上所述,黄芪甲苷能改善慢性间歇性缺氧诱导的血管内皮功能障碍和氧化应激,可能与calpain-1/NO信号通路有关,这可为黄芪甲苷治疗阻塞性睡眠呼吸暂停提供了新的理论基础和依据。
