苦豆子提取物对多重耐药大肠杆菌的体外抑菌作用
2022-12-03李志君崔生玲张宝锁张为民
李志君,崔生玲,张 雯,张宝锁,邵 倩,杨 奇*,张为民*
(1.西北农林科技大学动物医学院,陕西杨凌 712100,2.宁夏回族自治区兽药饲料监察所,宁夏银川 750004,3.宁夏顺宝现代农业股份有限公司,宁夏吴忠 751600)
近年来,随着抗生素在畜牧业和疾病治疗中长期应用和滥用,临床分离出的大肠杆菌多呈现多重耐药(Multiple drug resistance,MDR)现状。根据欧洲抗生素耐药性监测网络的数据显示,大肠杆菌对头孢菌素类药物的耐药性在欧洲显著增加,且喹诺酮类和氨基糖苷类联用对大肠杆菌的治疗效果也显著下降[1]。耐药细菌的出现和传播,对多数国家都造成了严重的经济负担。据报道,美国每年的财政负担约增加3.8%用于控制MDR细菌感染,增加了约1.2万亿美元[2]。我国各地分离的大肠杆菌不仅耐药的种类、范围有所扩大,并且多重耐药、交叉耐药现象也在加剧。梁少姗等研究发现从湛江地区分离的90株大肠杆菌均为多重耐药,21%的菌株耐9种抗菌药物[3],廖智慧等对分离自河北衡水地区的大肠杆菌药敏检测,结果表明分离菌株对磺胺异恶唑、链霉素和阿米西林的耐药率高达80%以上[4]。耐药细菌的出现,不仅对畜禽健康产生严重危害,可通过动物粪便进入土壤环境,从而在人类、动物、食物以及环境之间逐渐相互传播,进而对人类健康产生潜在的威胁。因此,为了解决耐药菌株引起的威胁,科学家们正在迫切探索新型抗生素和解决耐药性问题的新方法[5]。
研究发现,中草药或中草药中提取出的某些成分对耐药菌具有良好的抑菌作用,有望成为目前有效解决细菌耐药性问题的策略之一。如蜂蜜和芦荟提取物可抑制粪肠球菌和大肠杆菌生长[6]。苦豆子(SophoraalopecuroidesL.)是豆科,槐属的一种多年生草本或亚灌木植物,来源丰富,其根、茎、叶和种子均可入药,具有重要的药用价值[7]。研究发现,苦豆子提取成分中含有多种生物碱和黄酮类化合物[8],不仅对多种细菌具有抑菌作用,并能增强耐药菌对抗菌药物的敏感性[9]。因此,本研究选用了天然中草药苦豆子作为研究对象,探讨了其对临床分离的多重耐药大肠杆菌的抑菌活性,为探索控制耐药细菌的抗菌药物资源开发提供了前期研究数据和理论基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 试验所用试剂胰蛋白胨大豆琼脂、MH肉汤培养基、LB肉汤(青岛海博生物技术有限公司)、注射用氨苄西林钠(河北远征药业有限公司)、氟苯尼考标准品(北京索莱宝有限公司)、大观霉素和头孢噻呋(中国兽医药品监察所)、结晶紫(北京化工厂)、生物安全柜A2型(赛默飞世尔仪器有限公司)、电热恒温培养箱SHX350II(上海树立仪器仪表有限公司)、电子天平BCE622-1CCN(赛多利斯科学仪器有限公司)、比浊仪CBZ-1(北京潮声公司)、酶标仪Multiskan FC(赛默飞世尔科技Thermo)、立式压力蒸汽灭菌锅STIK IMJ-78A(上海朗银压力容器有限公司)。
1.1.2 药材和菌株 苦豆子(SophoraalopecuroidesL.)提取物(10:1,水提取于苦豆草的种子及地上部分),购自陕西沐菲生物科技有限公司。1株多重耐药大肠杆菌(MDRE.coli)由宁夏回族自治区兽药饲料监察从蛋鸡粪便样本中分离得到,对氨苄西林、庆大霉素、大观霉素、四环素、氟苯尼考、磺胺异恶唑、复方新诺明、头孢噻呋、恩诺沙星等抗菌药物耐药,同时携带blaTEM、blaCTX-M、aacC2、aac(3′)-Ⅱ、sul2和sul3 6种耐药基因。标准大肠杆菌ATCC25922由中国兽医药品监察所提供。
1.2 方法
1.2.1 供试菌液制备 在超净工作台内,将试验菌株接种于LB琼脂培养基,37 ℃培养24 h,用一次性接种环挑取单菌落接种于3 mL无菌的LB肉汤中,37 ℃恒温过夜培养,用无菌生理盐水调节菌液浓度至1×108CFU/mL,用LB肉汤稀释成1×106CFU/mL,备用。
1.2.2 药液制备 将苦豆子提取物溶于蒸馏水中,煮沸,配制成浓度为1 g/mL的药液,置于4 ℃保存,备用。
1.2.3 最小抑菌浓度测定 采用微量肉汤二倍稀释法测定苦豆子提取物、氨苄西林钠、大观霉素、氟苯尼考、恩诺沙星和头孢噻呋对MDRE.coli的最小抑菌浓度。在96孔板中每孔加入100 μL的MH肉汤,然后加入等量配制好的药液与MH肉汤进行二倍稀释混合,每孔接种100 μL菌液,使得每孔菌液终浓度为5×105CFU/mL,设置阴性和阳性对照。读取结果前2 h,在每反应孔内加入5 μL 0.05%的TTC作为生长指示剂,继续培养,观察每个孔中的颜色变化,以未变红的最后一孔的浓度视为MIC[10]。
1.2.4 联合应用的抑菌效果测定 采用棋盘稀释法测定苦豆子提取物和氨苄西林钠、大观霉素、氟苯尼考、恩诺沙星和头孢噻呋5种抗菌药物联合应用的抑菌效果[11]。
1.2.5 生长曲线的测定 将LB肉汤和苦豆子提取物混合,使培养基中的药物浓度分别为MIC、1/2MIC、0,然后将调整好的菌液1000倍稀释后加入含药培养基内,所有分组按照37 ℃、180 r/min条件下恒温培养。各组从0 h开始,每隔2 h取等量菌液使用酶标仪在630 nm处测定吸光值。以各时间点为横坐标,OD630nm为纵坐标做生长曲线图。
1.2.6 生物被膜形成能力的测定 在96孔板中分别加入20 μL 0.5麦氏浊度的E.coli悬浮液和180 μL不同浓度的苦豆子提取物(MIC、1/2MIC和1/4MIC),不加药物组作为对照,置于37 ℃条件下恒温培养24 h后,弃上清,无菌PBS(pH 7.2)轻轻洗涤3次,甲醇固定15 min,倒出液体并风干,然后向每孔中加入1%的结晶紫,并在37 ℃下孵育15 min,以使结晶紫渗透到生物被膜结构中,将96孔板用水洗涤并风干,加入200 μL 33%的冰醋酸中,孵育30 min,用以溶解染色的生物被膜,使用酶标仪在570 nm波长处测量OD值[12]。生物被膜形成的相对百分比=(OD药物处理组/OD阴性对照组)×100[13]。
1.2.7 生物被膜清除作用测定 将E.coli菌悬液和LB肉汤在96孔板中进行24 h培养,然后去除上清液,向每孔加入200 μL的不同浓度苦豆子提取物,阴性对照组加入200 μL LB肉汤,37 ℃培养24 h后,按照1.2.6方法,弃去上清,无菌PBS洗涤3次后,甲醇固定15 min,用水洗涤风干,然后加入200 μL 33%的冰醋酸孵育30 min,使用酶标仪在570 nm波长处测量OD值。生物被膜清除百分比=(OD阴性对照组-OD药物处理组)/ OD阴性对照组×100。
1.2.8 运动能力的测定 在半固体培养基上研究E.coli群集运动性。LB培养基添加0.5%葡萄糖和0.5% 琼脂用于群集运动试验。苦豆子提取物以1/4 MIC至MIC的终浓度添加到LB培养基中。吸取5 μL菌液置于培养平板的中心,并在37 ℃下正置培养24 h,测量菌落直径,未经苦豆子提取物处理的E.coli作为阳性对照,试验平行3次。
2 结果与分析
2.1 苦豆子提取物和抗菌药物的MIC测定结果 苦豆子提取物和5种抗菌药物对MDRE.coli的MIC测定结果见表1。由表可知,苦豆子提取物对试验菌株的MIC值为125 mg/mL。

表1 苦豆子提取物和抗菌药物的MIC测定结果
2.2 苦豆子提取物与抗菌药物联用抑菌效果 由表2可知,苦豆子提取物与氨苄西林钠、大观霉素和恩诺沙星联合应用对试验菌株表现为无关作用;与氟苯尼考表现为相加作用,与头孢噻呋表现为协同作用。

表2 苦豆子提取物与抗菌药物联用的抑菌效果
2.3 苦豆子提取物对试验菌株生长曲线的影响 0~4 h期间,试验组E.coli无明显生长,4 h之后1/2MIC组E.coli生长进入快速繁殖阶段,12 h之后生长趋于平缓,菌株进入平稳生长期,但E.coli总量明显低于对照组。MIC试验组的E.coli生长明显受到抑制,表明苦豆子提取物可抑制E.coli的生长(图1)。
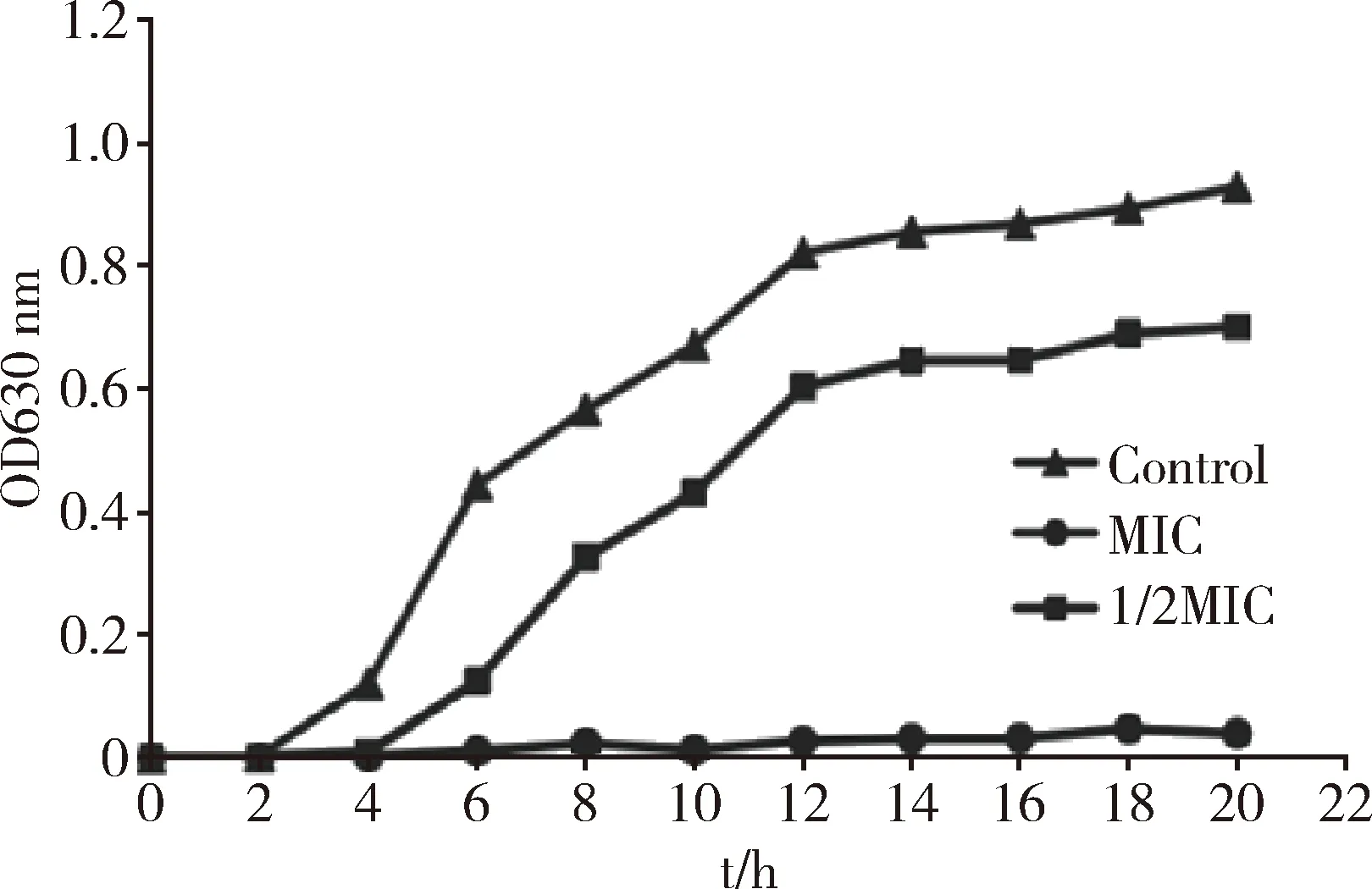
图1 苦豆子提取物对MDR E.coli生长曲线的影响
2.4 苦豆子提取物对试验菌株生物被膜抑制和清除的作用 苦豆子提取物对试验菌株生物被膜的形成和清除作用见图2。不同浓度苦豆子提取物(MIC、1/2MIC和1/4MIC)对试验菌株生物被膜均具有良好的抑制活性,抑制率分别为54%、48%和29%,并呈现一定的剂量依赖性。不同浓度的苦豆子提取物对试验菌株生物被膜清除率为11%~27%。

图2 不同浓度的苦豆子提取物对MDR E.coli生物被膜抑制和清除的作用
2.5 苦豆子提取物对试验菌株群集运动测定 由图3可知,MIC和1/2MIC可极显著减少试验菌株的群集运动扩散直径(P<0.01),并随着苦豆子提取物浓度增加,试验菌株的群集运动能力逐渐下降。
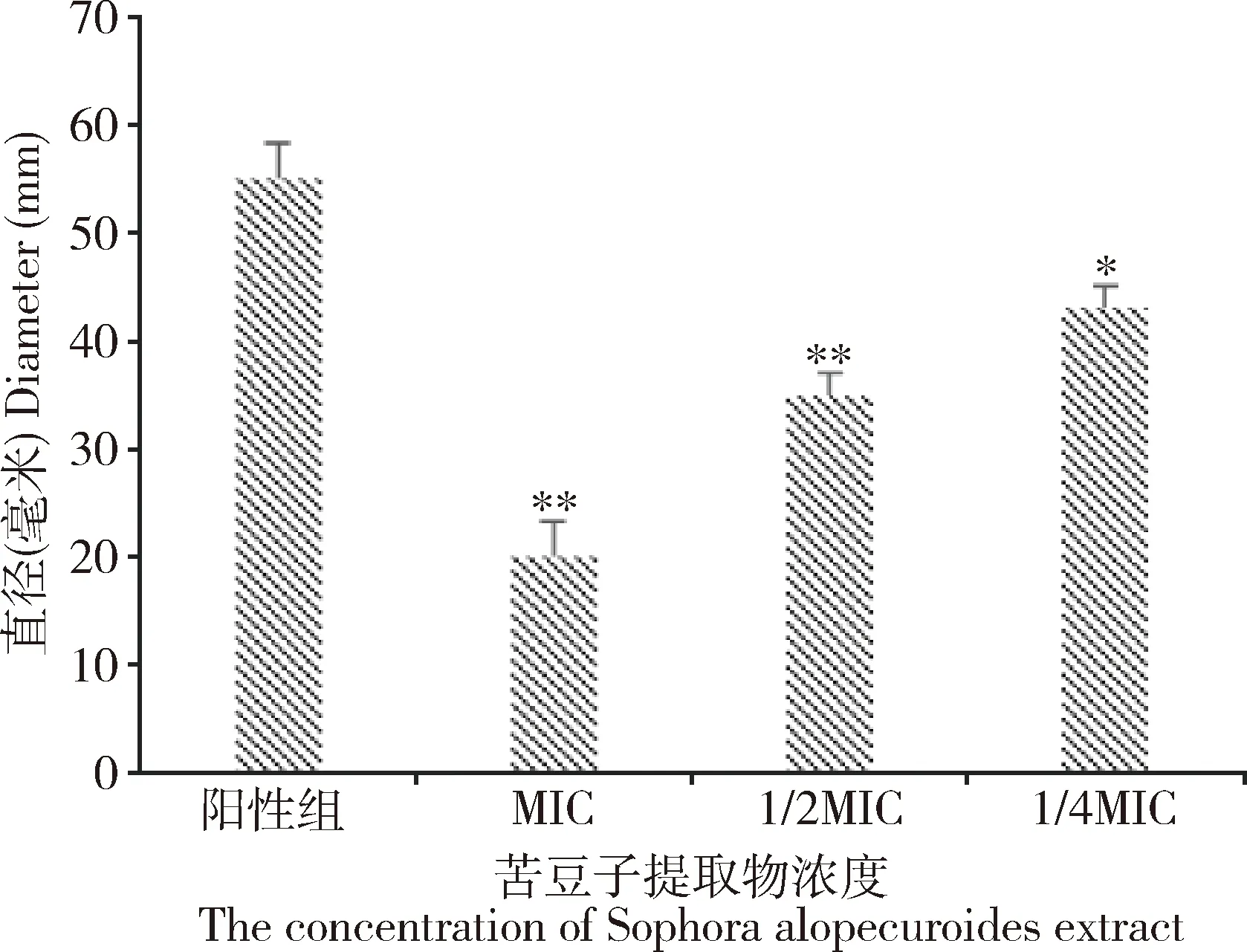
图3 不同浓度的苦豆子提取物对MDR E.coli群集运动的影响
3 讨 论
细菌获得抗生素耐药性已成为世界范围的主要问题,被世界卫生组织列为全球医疗保健威胁[14],严重影响临床疗效和动物健康,中草药因来源广泛、安全性高、成本低等特点,其抗菌效果的研究已成为近几年学者研究的热点之一。研究发现,中草药及其化学成分不仅对耐药菌具有良好的抑菌作用,且在一定程度可以消减细菌的耐药性,对如今应对细菌耐药性日益严重的现状具有重大意义[15]。
本研究测得苦豆子提取物对分离E.coli的MIC值为125 mg/mL,与其它中药相比,其抑菌能力处于中等水平,为进一步验证苦豆子提取物的抑菌作用,测定了其对E.coli生长曲线的影响。结果表明,不同浓度的苦豆子提取物均可以抑制E.coli的正常生长,短时间内可以延缓菌株从迟缓期进入对数生长期,且MIC组比1/2MIC组抑制效果更强,表明苦豆子提取物对E.coli具有抑菌作用,且抑制效果呈浓度依赖性。张子越为探究马齿苋水煎液对E.coli的抑菌活性绘制了生长曲线,结果显示在不同浓度马齿苋水煎液作用下,E.coli生长受到抑制,并随着药物浓度增加,对E.coli的抑制作用增强,这与本试验研究的结果相符合[16]。
研究显示,某些抗微生物的天然药物能够增强抗菌药物的抑菌效果,或恢复药物对细菌的敏感性,如Hossain等通过棋盘法测定了新型酚类化合物与传统抗菌药物联合应用对E.coli的抑制作用,结果表明没食子酸与甲砜霉素联用、金缕梅单宁与红霉素或甲砜霉素联用对E.coli表现为协同作用,FICI分别为0.281、0.375 和 0.50[17]。黄柏水提取物与氟苯尼考和阿莫西林联用对临床分离产ESBLs大肠杆菌分别表现为协同、相加作用[18]。因此,中药与抗菌药物联合使用可以有效促进抗菌药物对病原菌的靶向作用,可能成为减少细菌耐药性的一种有效途径。本研究选择了苦豆子提取物与5种抗菌药物进行联合作用效果测定,结果表明,苦豆子提取物与氟苯尼考联合应用为相加作用,与头孢噻呋联用呈现协同作用。可见,中药具有抗菌增效的作用,但一种中药提取物与不同抗菌药物联用对菌株的作用效果可能有所差异,其原因可能是与菌株特异性或存在其他耐药机制有关。
细菌在抗菌药物的持续作用下,为了生存会通过各种方式来对抗抗菌药物,因此,细菌针对不同抗菌药物产生了相对应的耐药机制,目前大肠杆菌耐药机制主要涉及产生钝化酶或水解酶、药物渗透屏障、药物作用靶位点改变和生物被膜形成等几个方面。据报道,80%的临床感染性疾病与细菌的生物被膜有关[19],说明生物被膜是细菌产生耐药性的重要原因之一,而群集运动可促进生物被膜的形成,增强细菌耐药性。因此,本研究通过半固体琼脂法探讨了苦豆子提取物对E.coli群集运动的影响,结果表明,1/2MIC和MIC苦豆子提取物可极显著降低E.coli的群集运动能力,并呈剂量依赖性。Ruan等评估了白藜芦醇对禽致病性大肠杆菌(APEC)游泳和群集运动的影响,发现随着白藜芦醇浓度的增加,APEC的运动能力逐渐下降,抑制作用呈现剂量依赖式[20],与本研究结果相似。同时采用了结晶紫染色法检测苦豆子提取物对试验菌株生物被膜形成和清除的抑制作用,结果发现,苦豆子提取物可抑制29%~54%的生物被膜形成,MIC浓度的苦豆子提取物可清除27%的生物被膜,破坏生物被膜的完整性。说明苦豆子提取物对细菌生物被膜具有抑制作用,但针对其它抑菌机制有待进一步研究。
4 结 论
本研究对苦豆子的抑菌作用进行了初步探讨,苦豆子提取物具有一定的体外抑菌和消除耐药性的作用,对防控耐药大肠杆菌感染具有重要意义。但研究结果显示,苦豆子提取物的作用浓度较高,因此使其临床的应用价值较低。现代研究表明,中药主要是通过其某些活性成分来起到抑菌杀菌的作用[21],因此对于苦豆子提取物中的具体有效活性成分还有待进一步的研究,以期为兽医临床应用苦豆子防治细菌性感染疾病提供理论数据。
