鸡源肺炎克雷伯菌的分离鉴定和耐药性分析
2022-12-03王雅丽张宝锁崔生玲卿素珠张为民
王雅丽,张宝锁,张 雯,崔生玲,卿素珠,杨 奇*,张为民*
(1.西北农林科技大学动物医学院,陕西杨凌 712100,2.宁夏回族自治区兽药饲料监察所,宁夏银川 7500011,3.宁夏顺宝现代农业股份有限公司,宁夏吴忠 751600)
肺炎克雷伯氏菌(Klebsiellapneumoniae)是一种常见的革兰氏阴性条件致病杆菌,为肠杆菌科(Enterobacteriaceae)克雷伯氏菌属(Klebsiella)成员,多存在于动物黏膜表面或自然环境(如水、土壤等)中[1],能够引起动物肺炎、肠炎、脑膜炎和败血症等严重疾病,也是一种重要的人兽共患病原菌。肺炎克雷伯菌具有多种质粒和可移动遗传元件,基于此特点该菌可以携带多种抗性基因或从环境中获得并积累抗性基因,或将耐药基因传递给敏感菌株,从而可能导致多重耐药或者超级耐药细菌的出现[2-3]。肺炎克雷伯菌是引起医院临床感染的主要细菌之一[4],2020年中国细菌耐药监测报告显示,肺炎克雷伯菌分离率在医源革兰氏阴性菌位居第二位,仅次于大肠埃希菌,且耐药率也呈现明显上升趋势[5]。
近年来,由于肺炎克雷伯菌对蛋鸡的危害增大和耐药性严重,常引起禽类肺炎、眼炎、肝脓肿、肠炎、败血症和生殖系统疾病等。基于此,本试验从蛋鸡粪便中分离鉴定肺炎克雷伯菌,并对分离菌株的耐药表型、耐药基因和毒力基因进行检测,以了解肺炎克雷伯菌的耐药现状和毒力基因流行情况,为动物临床用药提供基础数据。
1 材料与方法
1.1 材料
1.1.1 样本采集 选择宁夏回族自治区某规模化蛋鸡场为采样点,在鸡舍内随即选取临床健康雏鸡(n=36)和产蛋鸡(n=24),用无菌棉签蘸取其排泄的新鲜粪便(扒开粪便表皮,蘸取内部粪便),置于无菌采样袋,共60份。
1.1.2 标准菌株 大肠埃希菌(ATCC25922)和肺炎克雷伯菌(ATCC13883)由宁夏回族自治区兽药饲料监察所提供。
1.1.3 主要试剂和仪器 麦康凯肌醇阿东醇羧苄青霉素琼脂(MIAC)购自青岛海博生物技术有限公司;VITEK 2革兰氏阴性细菌鉴定卡购自生物梅里埃有限公司;革兰氏阴性细菌药敏板(动物源)购自上海星佰生物技术公司;全自动微生物鉴定仪(VITEK2)购自梅里埃诊断产品有限公司;PCR仪购自德国耶拿分析仪器有限公司。
1.2 方法
1.2.1 细菌分离培养 将粪便稀释于蛋白胨缓冲液中增菌培养30 min,滤液添加至麦康凯肉汤孵育18~24 h。将菌液划线接种于MIAC培养基,37 ℃培养18~24 h。挑取培养基上单个、圆形、呈粉红色至紫红色且带沉淀环的菌落,再次划线接种使其纯化,直至平板上菌落形态一致且符合肺炎克雷伯菌菌落特征。每次传代培养均设置肺炎克雷伯菌标准菌株ATCC13883为阳性对照,未接种培养基为阴性对照,并同条件培养。
1.2.2 PCR鉴定 采用煮沸法提取待测菌株模板DNA。参考文献[6]合成肺炎克雷伯菌的特异性基因溶血酵素khe基因,上游引物5′-TGATTGCATTCGCCACTGG-3′,下游引物5′-GGTCAACCCAACGATCCTG-3′,目的基因片段大小为428 bp。PCR扩增体系(20 μL):2×DreamTaq Green Mix 8 μL,上下游引物(10 μmol/L)各1 μL,DNA模板2 μL和ddH2O 8 μL。扩增程序:95 ℃预变性3 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸5 min,4 ℃保存。扩增产物用1.25%琼脂糖凝胶进行电泳检测。
1.2.3 VITEK2 Compact全自动微生物系统鉴定 用无菌棉拭子挑取适量形态相似的菌落混悬于0.45%的无菌生理盐水中,使其终浓度为0.5~0.63麦氏浊度。将菌液管和革兰氏阴性鉴定卡放入卡架中,装入梅里埃VITEK 2 Compact全自动细菌鉴定系统中自动鉴定。
1.2.4 药敏试验 参照美国临床实验室标准化委员会CLSI相关标准进行操作和结果判定。采用革兰氏阴性细菌药敏板对分离株进行14种常用抗菌药物的敏感性检测,包括氨苄西林(AMP)、奥格门丁(A/C)、庆大霉素(GEM)、大观霉素(SPT)、四环素(TET)、氟苯尼考(FFC)、磺胺异噁唑(SF)、复方新诺明(甲氧卞定/磺胺甲恶唑,SXT)、头孢噻呋(CEF)、头孢他啶(CAZ)、恩诺沙星(ENR)、氧氟沙星(OFL)、美罗培南(MEM)和黏菌素(CL)。大肠埃希菌ATCC25922为质控菌株。
1.2.5 耐药基因和毒力基因检测 依据参考文献[7-16]设计耐药基因和毒力基因引物,由西安擎科新业生物技术有限公司合成。具体引物信息见表1和表2,包括β-内酰胺类耐药基因blaNDM、blaKPC、blaCTX和blaTEM,氨基糖苷类aac(6')-Ib-cr、aadA1和rmtB、四环素类tetA和tetB,喹诺酮类qnrA、oqxA、oqxB、qnrB和gyrA以及粘菌素类mcr-1,共15种耐药基因。毒力基因包括荚膜多糖基因rmpA,脂多糖合成相关基因wabG和uge,铁捕获能力kfuBC和Aerobactin以及铁载体entB和icuA。除退火温度外,反应体系与反应程序同1.2.2。

表1 肺炎克雷伯菌耐药基因序列

表2 肺炎克雷伯菌毒力基因引物序列
2 结 果
2.1 肺炎克雷伯菌株的菌落特征 肺炎克雷伯菌在MIAC培养基上形成边缘光滑湿润、中间凸起的紫红色菌落,菌落周围有沉淀环(图1)。

图1 肺炎克雷伯菌在MIAC培养基上的菌落形态
2.2 分离株PCR鉴定 肺炎克雷伯菌特异性基因khe的扩增产物大小为428 bp。以标准菌株ATCC13883为阳性对照,对分离株进行基因扩增、核酸凝胶电泳鉴定,60份样本中有48株菌株出现预期目的条带,与标准菌株结果一致(图2)。
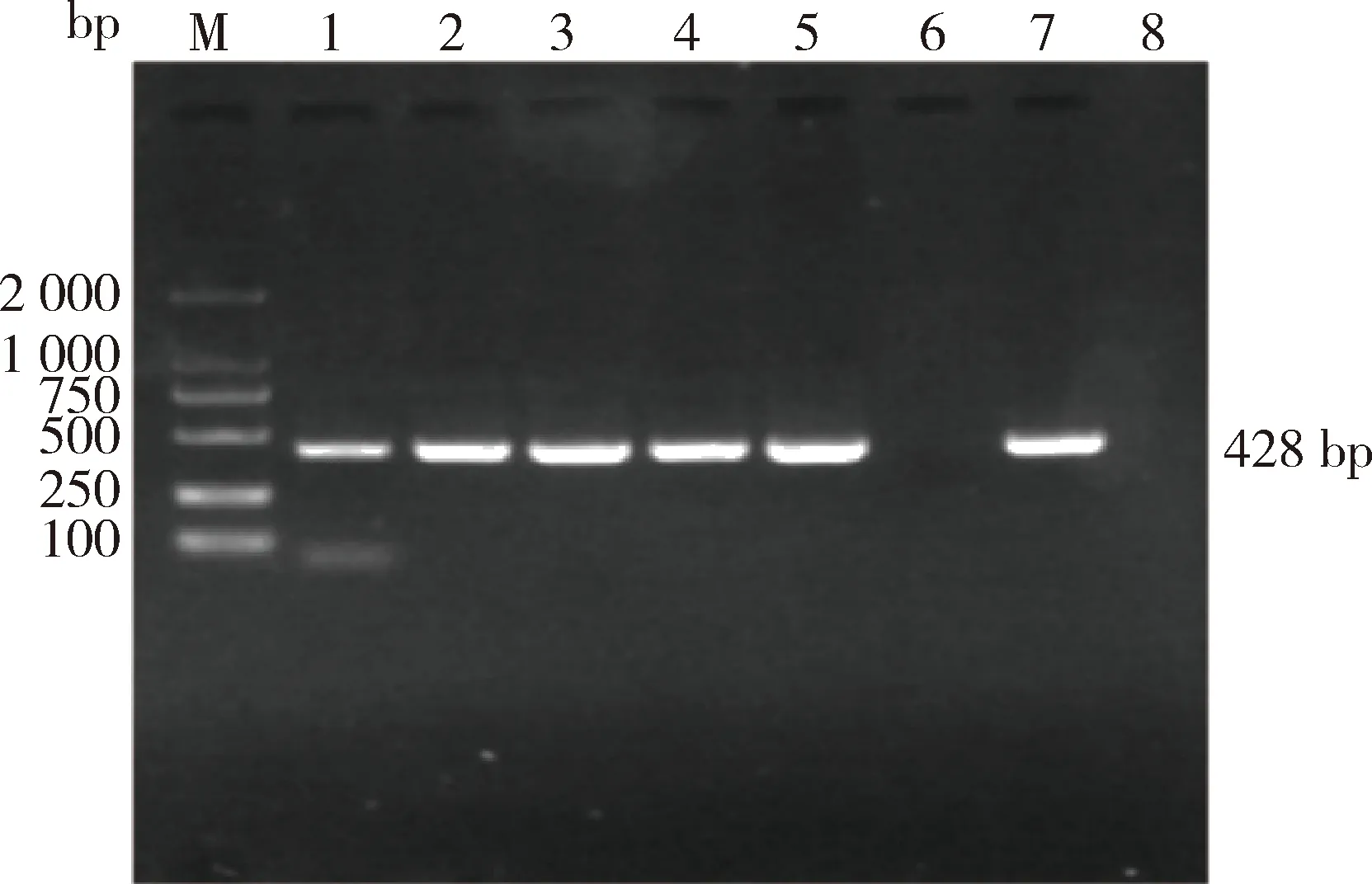
图2 部分菌株khe基因扩增电泳鉴定结果
2.3 生化仪鉴定 VITEK2 Compact鉴定是在细菌生化反应的基础上,比对分析待检细菌的生化反应谱与对数期菌株的生物学特征来鉴定菌种。结果显示,48株PCR阳性的分离株均为肺炎克雷伯菌,可信度均在90.00%以上,分离率为80.00%(48/60),其中雏鸡粪便中肺炎克雷伯菌的分离率(36/36)高于产蛋鸡(12/24)。
2.4 药敏检测结果
2.4.1 分离菌株对14种抗菌药物敏感性检测结果 药敏检测结果显示:质控菌株药敏结果在规定范围内,分离菌株对氨苄西林、大观霉素、四环素、氟苯尼考、磺胺异噁唑和复方新诺明的耐药率分别为100.00%、79.17%、81.25%、50.00%、72.91%和72.91%,呈现出高度抗药性。对奥格门丁、庆大霉素、头孢类和喹诺酮类药物耐药程度较低,耐药率为14.58%~27.08%,未检测出对美罗培南和黏菌素耐药的菌株(表2)。

表3 肺炎克雷伯菌分离株对14种抗菌药物药敏检测结果
2.4.2 雏鸡和产蛋鸡肺炎克雷伯菌分离株耐药率统计 对雏鸡和产蛋鸡粪便分离到的肺炎克雷伯菌的药敏结果进行分析比较(图3)。结果显示各生长阶段分离菌株对氨苄西林均耐药,对美罗培南和黏菌素均敏感,此外雏鸡源分离菌株对大观霉素、四环素、磺胺异噁唑和复方新诺明耐药率均高于90.00%,且对其他11种抗菌药的耐药率均高于产蛋鸡。

图3 不同生长阶段肺炎克雷伯菌分离株耐药率统计
2.4.3 分离菌株多重耐药分析 对分离株的耐药谱进行统计分析。结果显示,12.50%菌株表现双重耐药,75.02%分离株表现为多重耐药(≥3类抗菌药),其中5重耐药的菌株占比最高,为22.92%,最高为8重耐药,占10.42%(图4)。

图4 肺炎克雷伯菌分离株多重耐药率统计
2.5 耐药基因和毒力基因检测 48株肺炎克雷伯菌的耐药基因和毒力基因检测结果见表4可知,共检出6种耐药基因,分别是blaTEM、aadA1、tetA、qnrB、oqxA和oqxB,以及uge、wabG、kfuBC和entB4种毒力基因,其他耐药基因和毒力基因未检出。

表4 肺炎克雷伯菌分离株耐药基因和毒力基因检出情况(%)
2.6 耐药基因与耐药表型比较分析 对48株肺炎克雷伯菌的耐药表型和耐药基因进行比较分析,结果见表5。氨基糖苷类和四环素类耐药表型阳性率与aadA1和tetA基因的检出情况基本符合,其耐药表型高于基因型。在全部耐β-内酰胺类药物的分离菌株和1株中介程度的菌株中均检测出了blaTEM基因。喹诺酮类药物方面,中介菌株qnrB基因阳性率高于耐药菌株,oqxA和oqxB基因在其耐药、中介和敏感菌株中均有检出。

表5 肺炎克雷伯菌耐药表型与基因型的比对情况
3 讨论与结论
近年来,从雏鸡、奶牛、貂和犬等多种患病动物均分离出高致病性、多重耐药肺炎克雷伯菌[17-20]。本研究从60份健康蛋鸡的粪便中分离到48株肺炎克雷伯菌,分离率为80.00%。药敏试验结果显示,分离菌株对氨苄西林、大观霉素、四环素、氟苯尼考、磺胺异噁唑和复方新诺明均表现出高度耐药性,其中对氨苄西林属于固有耐药[21],对奥格门丁、庆大霉素、头孢类和喹诺酮类药物耐药程度较低,而对黏菌素和美罗培南敏感。多重耐药情况较为严重,75.02%的分离菌株表现出多重耐药性,其中以5重(22.92%)和7重耐药菌(18.75%)为主,最高表现为8重耐药菌(10.42%)。有研究表明,河南省鸡源肺炎克雷伯菌(来自鸡场环境、病死鸡和市售鸡肉)对环丙沙星(71.70%)和四环素(66.04%)表现出高度耐药,49.06%的分离菌株表现为多重耐药[19],低于本研究分离菌株的耐药水平;河北省乳房炎奶牛源分离到的肺炎克雷伯菌对庆大霉素和头孢喹肟表现中度耐药,耐药率为48.90%和55.60%,高于本试验结果[18],可见不同地区畜禽肺炎克雷伯菌耐药性有差异,可能是临床常用药物存在差异导致。
本研究中雏鸡源分离菌株对大观霉素、四环素、磺胺异噁唑和复方新诺明耐药率均高于90%,且对除氨苄西林、美罗培南和黏菌素外的11种抗菌药物耐药率均高于产蛋鸡。需要注意的是,1株雏鸡源肺炎克雷伯菌对12种抗菌药物表现出耐药性,以及2株产蛋鸡源肺炎克雷伯菌表现出多重耐药性。对该蛋鸡养殖场抗菌药使用记录调查发现,采集样本的鸡舍并未存在不规范或大量使用抗菌药情况,且鸡入舍以来仅使用过头孢类药物,因此可能是养殖场内部环境消毒不彻底,存在细菌耐药性的积累或蛋雏鸡亲代种群垂直传播而导致的高度耐药性。
肺炎克雷伯菌具有多种质粒和可移动的遗传元件,是耐药基因的主要传播载体[3]。从48株肺炎克雷伯菌分离菌株中检出6种耐药基因,其中oqxA和oqxB检出率最高,几乎在所有分离菌中检出,与陈强[22]研究一致。研究显示,oqxA和oqxB参与编码肺炎克雷伯菌外排泵,除介导喹诺酮类耐药外,还能够降低菌株对替加环素和呋喃妥因的敏感性[23]。blaTEM基因的阳性率与β-内酰胺类耐药表型相符率较高,而aadA1、tetA和qnrB在耐氨基糖苷类、四环素类和喹诺酮类的菌株检出率较低,存在其他耐药基因未检出的可能性。
本研究对分离的鸡源肺炎克雷伯菌荚膜、脂多糖和铁源摄取系统共7种毒力基因进行了检测,其中entB、wabG、uge检出率较高,kfuBC检出率较低,而rmpA、Aerobactin和icuA基因未检出。肠杆菌素生物合成铁载体(entB)是一种由菌体细胞分泌的、能够高度亲和Fe3+的特异性铁螯合剂,以帮助细菌摄取铁源,在菌株毒力中起关键作用[24],wabG基因能够调控肺炎克雷伯菌脂多糖的合成,以及荚膜形成,帮助菌株躲避细胞的吞噬作用,并增强菌株的粘附能力[8,25]。uge基因参与肺炎克雷伯菌核心脂多糖的生物合成,人为构建的uge基因突变体能够显著降低菌株的毒力和感染宿主的能力[26]。据报道,贡嘎等[27]从患呼吸道疾病的牦牛中分离到的8株肺炎克雷伯菌均携带mrkD、fimH和wabG;张传美等[20]从患肺炎的水貂中分离的10株肺炎克雷伯菌,均携带uge、ureA、wabG和iucB基因,与本试验中uge和wabG毒力基因检出率相似。
研究结果表明,鸡场肺炎克雷伯菌分离率较高,且分离菌株对常见抗菌药物耐药程度较为严重,可为该地区耐药性监测和疾病防控提供参考依据。
