板栗壳提取物对SD大鼠的致畸毒性研究
2022-12-02伍淑文陈志元孙代华樊柏林
江 丹,伍淑文,陈志元,*,田 辉,孙代华,樊柏林
(1.劲牌持正堂药业有限公司,湖北 黄石 435100;2.阳新县疾病预防控制中心,湖北 黄石 435200;3.湖北省疾病预防控制中心应用毒理湖北省重点实验室,湖北 武汉 430079)
板栗壳药性甘、涩、平,主要富含黄酮(或皂苷)类、酚类[1]、多糖(或苷)类和有机酸类等多种化合物[2-4]。从板栗壳中可提取出来天然的棕色素,主要为黄酮类化合物[5-7],对清除自由基、抑菌和抗氧化均有较强的作用,还可以防止油脂氧化变质[8-9],虽然板栗壳棕色素的功效研究报道不少,但未见板栗壳棕色素的致畸作用和相关的毒理学研究报道,因此本文报道了采用经济发展与合作组织(Organisation for Economic Co-operation and Develpment,OECD)和食品安全国家标准[10]规定的方法对板栗壳提取物开展的致畸作用研究结果,为板栗壳提取物作为天然色素的开发利用提供安全性评价依据。
1 材料与方法
1.1 材料
板栗壳提取物(20倍量,40%乙醇75℃下提取-陶瓷膜过滤-酸沉-离心-碱溶-浓缩干燥制备而成,总黄酮含量≥45%,总多糖含量≥20%),由劲牌持正堂药业有限公司提供,为棕褐色粉末,易溶于水,主要成分为黄酮类化合物,干燥、防潮、避光保存;阴性对照组为蒸馏水;阳性对照组给予含维生素A的食用植物油。
SPF级SD大鼠210只,其中雌性140只,体质量240~330 g;雄性70只,体质量360~500 g。由湖北省实验动物研究中心提供,生产许可证号为SCXK(鄂)2015-0018。大鼠饲养于SPF级动物实验室中,使用许可证号为SYXK(鄂)2017-0065,环境温度20~26℃,湿度40%~70%。饲料为颗粒饲料,饲料许可证号为SCXK(鄂)2016-0011,大鼠经检疫3 d无异常后用于实验。本实验经湖北省预防医学科学院湖北省疾病预防控制中心实验动物管理与使用委员会审查通过(201921346)。
1.2 仪器与试剂
本研究使用的主要仪器包括:CX41型生物显微镜(日本奥林巴斯株式会社);Motic SMZ168-BL型体视显微镜(中国厦门市麦克奥迪实业集团有限公司)。主要试剂包括:甲醛、2,4,6-三硝基苯酚、氢氧化钾、冰乙酸、丙三醇、茜素红、水合氯醇,均为分析纯,购于国药集团化学试剂有限公司。
1.3 实验方法
1.3.1 剂量设计参考《食品安全国家标准 致畸试验》中的剂量设置[10],我们的前期研究结果显示,板栗壳提取物对小鼠急性经口LD50>15 g/kg,对雌性大鼠90天经口毒性试验未观察到有害作用剂量(no observed adverse effect level,NOAEL)为3.33 g/kg。将此剂量设置为高剂量,采用等比组间设置,等比系数为3倍,设中、低剂量分别为1.11和0.37 g/kg。分别称取板栗壳提取物3.70、11.10、33.30 g,溶于100 mL蒸馏水,混合均匀,配制低、中、高剂量组受试物;阴性对照组按10 mL/kg的体积灌胃给予蒸馏水;阳性对照组给予13 mg/kg维生素A,准确量取125万IU的维生素A内容物(每1万IU维生素A相当于3 000μg结晶视黄醇),用适量植物油充分混匀并定容至115 mL。
1.3.2 动物分组及体质量测定雌雄大鼠按2∶1的比例同笼交配,每天清晨阴道涂片检查雌性大鼠,以发现精子确认为妊娠的第0天,并称量体质量,将检出的孕鼠随机分为5组,即低、中、高3个剂量组,阴性对照组和阳性对照组,每组孕鼠数不少于16只。在妊娠的第6~15天,低、中、高剂量板栗壳提取物组和阳性对照组分别灌胃给予受试物,阴性对照组灌胃给予同等体积的蒸馏水,阳性对照组给予13 mg/kg维生素A,连续10 d。3个剂量组及阴性对照组按10 mL/kg,阳性对照组按4 mL/kg计算灌胃体积,并在妊娠第0、6、9、12、15、20天称量孕鼠体质量[8]。
1.3.3 观察指标于妊娠第20天对孕鼠进行颈椎脱臼处死,迅速取出子宫,称量子宫连胎质量,计算妊娠大鼠的体质量增量,记录黄体数、活胎数、死胎数、吸收胎数和着床数,并逐个记录胎鼠的性别、体质量、身长,检查胎鼠有无外观异常。将一半胎鼠放于Bouins液中固定2周后,进行内脏检查,另一半胎鼠,放入95%乙醇固定,流水冲洗后放入15 g/L的氢氧化钾溶液内,透明后放入茜素红应用液染色,再放入透明液A及透明液B中,待骨骼染红而软组织退色后检查骨骼发育情况。胎鼠内脏检查:脑室发育异常、眼缺失及大小不一、腭裂、肾积水或单肾缺失、吐舌等;胎鼠骨骼检查:头顶间骨及后头骨、胸骨缺失和钙化不全、肋骨异常、脊柱骨异常等的检查。
1.4 统计分析
采用SPSS 18.0软件进行统计分析,孕鼠体质量、体质量增量、子宫连胎质量、着床数、黄体数、胎仔体质量、身长、吸收胎数、活胎数、死胎数、胎仔各畸形数等多组间计量资料用单因素方差分析的最小显著性差异法检验,两组之间计数资料采用χ2检验[9]。胎仔的数据以窝为单位进行统计,P<0.05为差异有统计学意义。
结果应能得出受试物是否有母体毒性和胚胎毒性、致畸性,最好能得出最小致畸剂量。按下式计算致畸指数和致畸危害指数,致畸指数10以下为不致畸,10~100为致畸,100以上为强致畸。致畸危害指数大于300说明该受试物对人危害小,100~300危害中等,小于100对人危害大。
致畸指数=雌鼠LD50/最小致畸剂量
致畸危害指数=最大不致畸剂量/最大可能摄入量
2 结果
2.1 板栗壳提取物对孕鼠一般状况及其体质量的影响
实验期间各组大鼠饮水进食正常,行动灵活,反应敏捷,眼鼻口无分泌物,生长发育良好,均未见流产及其他明显中毒症状,无死亡。试验期间板栗壳提取物各剂量组孕鼠体质量与阴性对照组比较,差异无统计学意义(P>0.05);与阴性对照组比较,阳性对照组孕鼠第9~20天体质量、体质量增量明显降低,差异具有统计学意义(P<0.05或P<0.01),结果如图1。

图1 板栗壳提取物对孕鼠体质量的影响
2.2 板栗壳提取物对孕鼠胚胎形成的影响
各组孕鼠胚胎形成情况见表1。与阴性对照组比较,0.37、1.11、3.33 g/kg板栗壳提取物组大鼠黄体数、着床数、活胎数、死胎数、死胎百分率、吸收胎数,吸收胎百分率差异均无统计学意义(P>0.05)。与阴性对照组比较,阳性对照组大鼠黄体数、着床数、活胎数、死胎数、死胎百分率、吸收胎数,吸收胎百分率差异均无统计学意义(P>0.05)。

表1 各组孕鼠胚胎形成情况
2.3 板栗壳提取物对胎鼠外观和发育的影响
各组胎鼠外观和发育指标见表2。与阴性对照组比较,0.37、1.11、3.33 g/kg板栗壳提取物组胎鼠体质量、母鼠子宫连胎质量、身长、外观畸形数、外观畸形窝数率的差异均无统计学意义(P>0.05);阳性对照组与阴性对照组比较,阳性组母鼠子宫连胎质量差异无统计学意义(P>0.05),阳性组的胎仔体质量、身长降低、外观畸形率、外观畸形窝率升高,差异均有统计学意义(P<0.05或P<0.01)。
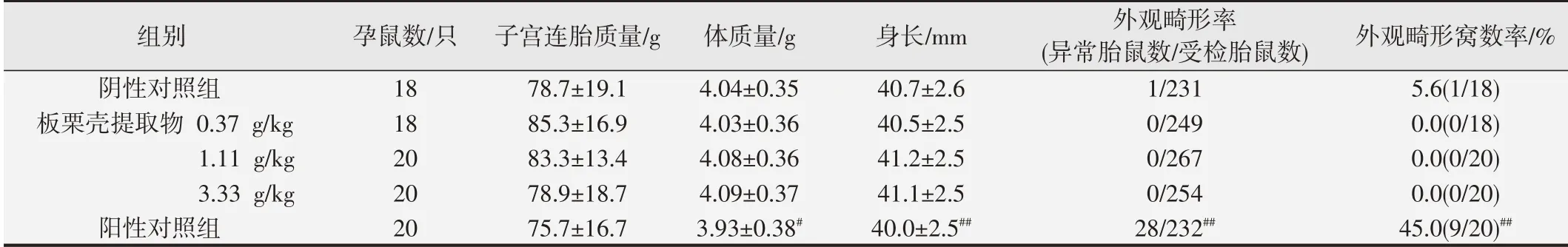
表2 胎鼠外观和发育指标
2.4 板栗壳提取物对胎鼠内脏的影响
各组胎鼠内脏指标见表3。与阴性对照组比较,0.37、1.11、3.33 g/kg板栗壳提取物组胎鼠组内脏异常例数和异常窝数率差异无统计学意义(P>0.05),胎鼠内脏畸形主要表现为肾积水。阳性对照组胎鼠内脏畸形主要脑室异常、眼睑缺失、肾积水。阳性对照组与阴性对照组比较,胎仔只数和胎仔窝数内脏畸形率升高,差异均有统计学意义(均为P<0.01)。
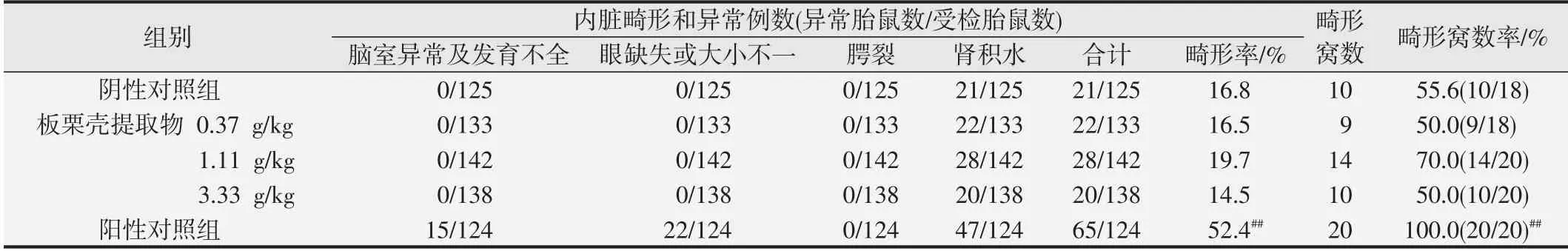
表3 板栗壳提取物对胎鼠内脏的影响
2.5 板栗壳提取物对胎鼠骨胳发育的影响
胎鼠骨骼畸形主要表现为头顶间骨及后头骨缺失、第五和第六胸骨缺失及肋骨异常等。各组胎鼠骨骼发育指标见表4,与阴性对照组比较,0.37、1.11、3.33 g/kg板栗壳提取物组的骨骼畸形率、骨骼畸形窝率差异均无统计学意义(P>0.05),阳性对照组与阴性对照组比较,阳性组的骨骼畸形率、骨骼畸形窝数率升高,差异均有统计学意义(均为P<0.01)。

表4 板栗壳提取物对胎鼠骨骼发育的影响
3 讨论
在致畸试验中,经常存在母体毒性和胎儿毒性两项观察指标。母体毒性是指外源性理化因素对孕母体产生的损害作用,包括体质量减轻、中毒症状和体征甚至死亡;胚胎毒性通常指外源性理化因素造成孕体着床前后直到器官形成期结束所有的毒性[11]。
本实验采用SD大鼠,设置0.37、1.11、3.33 g/kg共3个剂量组,同时设立阴性对照和维生素A阳性对照组,于妊娠的第6~15天连续给予受试物或对照品。结果表明阳性对照物维生素A可导致孕鼠体质量、体质量增量降低,胎鼠体质量降低、身长偏短,胎鼠外观、内脏和骨骼发育异常,畸形胎仔窝数增加,具有对大鼠明显的致畸作用,与文献报道是一致的,也表明本实验体系的可靠性。板栗壳提取物高剂量为可灌胃给予的样品配制最高浓度和最高灌胃体积,在该剂量条件下,板栗壳提取物对孕鼠一般状况及体质量、子宫连胎质量等无明显影响(P>0.05),对母鼠生殖能力包括黄体数、着床数、活胎总数、吸收胎数、吸收胎率、死胎数、死胎率等指标均无明显影响(P>0.05),对胎鼠外观和发育,以及内脏和骨骼发育均无影响,未观察到畸形发生。因此,可以认为在本试验条件下,板栗壳提取物对大鼠母体、母鼠的生殖及胎鼠发育均未观察到有害作用,NOAEL大于3.33 g/kg,未观察到致畸性,本研究为板栗壳提取物作为食品用色素提供了生殖毒性方面的安全依据。
