逍遥制剂药品标准制法与制成量问题的研究
2022-12-02张海燕宋浩伟宋民宪
张海燕, 王 萍, 宋浩伟, 宋民宪*
[1. 江西中医药大学现代中药制剂教育部重点实验室,江西 南昌 330004;2.北京东卫(成都)律师事务所,四川 成都 610065]
中成药药品标准将制法纳入标准项目是一种惯例,但是制法中参数表述不一,对其规定的意义和价值难以准确把握,导致基本原则缺失,使得药品标准制法项规定的制成量、规格项规定的重量,即制剂制成量总重难以执行,成为长期困扰药品监管部门和生产企业的难题,甚至影响到相应药品标准的严谨性。中成药中胶囊剂、片剂、颗粒剂品种数为5 019个,占中成药品种总数的51.26%,其中绝大部分制法中涉及上述问题。本文以处方药味均来源于植物的逍遥颗粒、胶囊、片为对象,探讨药品标准制法与制成量、规格等中成药存在的共性问题。
1 制法
逍遥制剂为传统经典处方,现有水丸、蜜丸、浓缩丸、口服液、合剂、颗粒、胶囊、片剂8种剂型[1-2],其中颗粒、胶囊、片剂中所有药味均需要提取,而且制法中工艺表述相同,故本文以三者为研究对象,讨论药品标准制法及其共性存在问题,具有普遍意义。
1.1 提取物固体物总量 逍遥颗粒、胶囊、片为2020年版《中国药典》一部收载品种,由柴胡、当归、白芍、炒白术、茯苓、炙甘草、薄荷、生姜8味饮片组成,制法中的提取工艺均为薄荷提取挥发油,蒸馏后的水溶液备用,药渣与其余柴胡等7味加水煎煮2次,第1次2 h,第2次1 h,煎液过滤,滤液与上述蒸馏后的水溶液合并浓缩[3]。在逍遥颗粒、胶囊、片的药品标准制法中,提取物固体物总量收得率应一致,具体见表1。
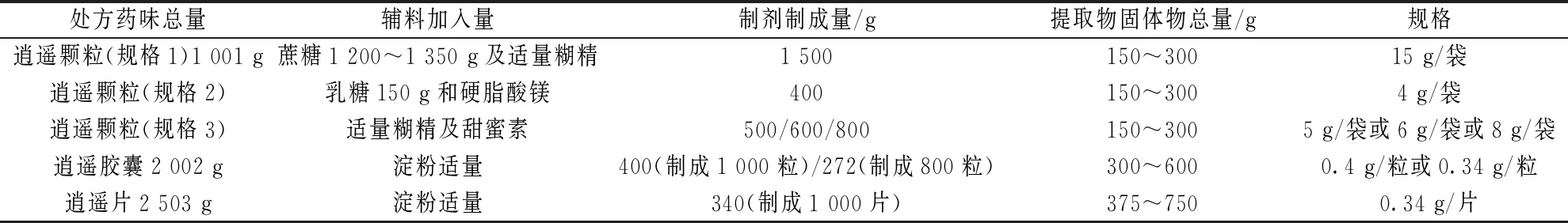
表1 逍遥颗粒、胶囊、片提取物固体物总量
1.2 处理和成型 在提取条件相同的情况下,同一处方不同剂型提取物固体物质收得率应相同,并不会因不同浓缩终点控制和剂型成型方法降低制剂中浸膏固体物总量,逍遥颗粒、胶囊、片提取液处理和成型方法见表2,可知三者不会因浓缩、成型方法不同而引起其提取物固体物质的减损。
提取物固体物总量不会因浓缩终点不同而变化,提取液浓缩终点的相对密度与剂型、干燥方法、辅料种类及量、设备有关,作为参数列入药品标准的必要性值得探讨[4]。同一批药材提取液所含物质均有差异,以同一相对密度作为终点控制时,其物质和制剂性能亦不相同,故将相对密度列入浓缩终点没有必要,逍遥颗粒在制法中“浓缩至适量”更为合理。因此,可将制法中的表述予以分类,一类为强制性规定,如煎煮溶剂、煎煮次数等必须执行的;另一类为指导性表述,由药品生产企业根据药材浸出物率、设备等情况在具体生产中确定加入溶剂量、煎煮时间、浓缩终点等。
1.3 药材或饮片浸出物是影响提取物固体物总量的重要因素 2020年版《中国药典》药材(源于植物,下同)标准项下大多未规定水溶性浸出物限度,部分品种规定了醇溶性浸出物限度;《香港中药材标准》[5]标准项下大多并列规定了药材的水溶性、醇溶性浸出物限度,逍遥制剂处方药味见表3。因该方为水提取,故以水溶性浸出物为参考进行计算,其中逍遥颗粒处方药材水溶性浸出物最低固体物理论总量为222 g,而实际总量为150~300 g,即水溶性浸出物收得率为理论总量的67%~135%,可认为浸出物波动范围±30%属于正常,其原因在于水溶性浸出物与药材浸出物实际煎煮条件不同,导致固体物质收得率存在差异。若通过检测水溶性提物或乙醇浸出物含量建立与制剂出膏率关系,则可根据浸出物测得值预估出膏量。
国家药典委员会《有关中药配方颗粒药品标准制定的通知》附件要求,中药配方颗粒提起出膏率应参考标准汤剂研究,在出膏率均值±30%范围内,制成量统一为1 000 g,出膏率范围上限不得超制成量,下限应注意与辅料的配比[6]。以中药配方颗粒标准计,逍遥颗粒、胶囊、片中各药味出膏量见表4,可知与逍遥颗粒标准出膏量、制成量较接近,相对而言,颗粒剂具有较大的辅料调整空间,制法规定能够执行,而胶囊剂、片剂干膏量大幅度超过标准规定的制剂制成量总量。

表4 逍遥颗粒单味药干膏(以中药配方颗粒标准计)
1.4 当归、白术、白芍浸出物分析 以逍遥制剂处方药味、被2020年版《中国药典》收载含有醇或水溶性浸出物项目的当归、白术、白芍为对象,调查某中药饮片生产企业在2020年生产过程中所用以上药材浸出物检测情况,结果见表5。

表5 主要药味浸出物实测值与2020年版《中国药典》规定限度比较
由此可知,当归、白术醇溶性浸出物分别为药典规定的109%~134%、100%~194%,白芍水溶性浸出物为药典规定的114%~150%。50%批次药材浸出物含量依次为当归49.2%~55.7%、白术35.1%~37.9%、白芍22.8%~26.6%,提示可选择符合药品标准规定、浸出物收得率较低的药材作为生产逍遥胶囊、片的药材,以降低提取物固体含量,缩小提取物固体物较大波动而影响制成量,并能控制波动。假定当归、白术水溶性浸出物实测值与理论值和醇溶性为相似波动范围,则逍遥胶囊中以上药味分别降低提取物固体物总量为13、85、19 g,共117 g。如果对所有药味均建立水溶性浸出物控制限度,则可使收膏量满足药品标准和加入辅料符合生产要求,制成制剂量和规格符合药品标准规定成为可能。
2 制成量波动在中成药生产中具有普遍性
在2020年版《中国药典》中,部分大蜜丸、颗粒剂制成量也存在波动,表明制成量波动在中成药生产中具有普遍性。大蜜丸炼蜜添加量大多不固定,由于其品种存在差异,导致相关标准有规格项规定,但制法项无制成量规定,提示药品标准允许大蜜丸制成量波动的范围。对药典收载的六味地黄丸、麦味地黄丸、附子理中丸、逍遥丸制成量[10]进行比较,结果见表6,可知最高波动范围可以达到16%,同时大蜜丸未经提取,提取物应有更大波动。另外,颗粒剂还存在制成量不确定的情形,如药典收载的九味羌活颗粒、小儿感冒颗粒、正柴胡饮颗粒[11]实际存在制成量“有多少算多少”的情形,见表7。
3 讨论
本研究揭示了行业内普遍存在的以符合药品标准规定的药材投料,经提取后,其制成量难以与药品标准规定的规格、制成总量一致,而且大多表现为超出或大幅度超出标准规定数量。长期以来,中成药制法研究中未将与工艺相关联的药材浸出物收得率纳入研究范围,以相同工艺制得相同的制剂的习惯思维不符合中药实际,忽略了中药材浸出物限度控制对制剂制成量影响的研究,应在药品标准的基础上,制定生产品种相关制法相适应的药材浸出物收得率,作为内控指标。
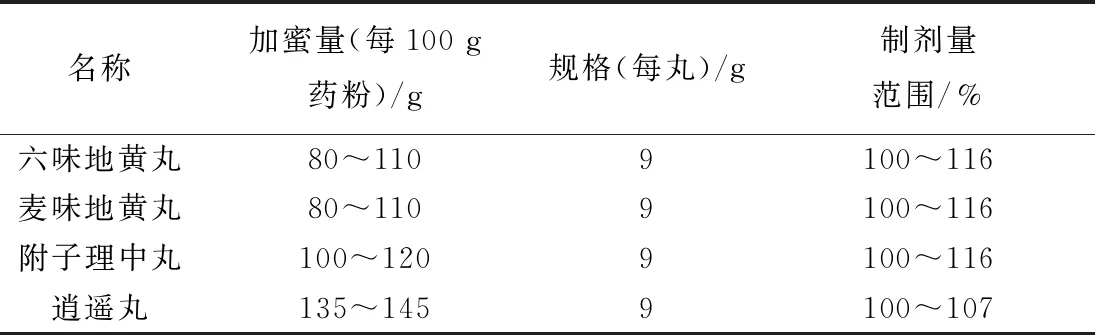
表6 大蜜丸制成量比较

表7 颗粒剂制成量比较
3.1 药材或饮片标准并非为满足生产中成药所需要制定 逍遥颗粒剂、胶囊剂、片剂制法均为水提取,但《中国药典》仅对处方中白芍作了水溶性浸出物限度规定,白术作了醇溶性浸出物限度规定,其余4味药材均无限度规定,而一般药品生产企业对逍遥处方其他药味均不作水溶性或醇溶性浸出物测定,仅按药典规定检测,导致逍遥胶囊剂、片剂制剂制成总量“失控”。白芍水溶性浸出物限度规定仅为低限规定,数据显示它可超出规定的50%,意味着在相同提取条件下提取物可能会在标准限度规定的基础上增加50%的重量。文献[12]对广西10个产地对叶百部水溶性浸出物进行测定,结果为53.41%~80.48%,平均69.61%,均超过《中国药典》不得低于50.0%的限度规定。另外,中成药煎煮时间、温度均高于水溶性浸出物测定条件,理论上收膏量很可能高于《中国药典》规定的水溶性限度。
然而,即使药品标准中对药材作出水溶性浸出物限度规定,也不能直接用于具体中成药品种制成量的推定。水溶性浸出物测定是在规定条件下对结果的限度规定,而具体中成药品种加水量、煎煮时间等因素均与其不同,需要根据具体中成药品种所使用的饮片建立限度规定,例如在逍遥胶囊剂、片剂中,使用白芍水溶性浸出物时应当取低限为宜。
3.2 中成药制剂规格或应予重新研究 以逍遥颗粒剂收膏量推定,逍遥胶囊、片剂提取物固体物已经超出标准制成量规定,为使其符合制成量、规格的规定,药品生产企业可采取“微小”变更的措施,如增大饮片规格、减少加水量、降低煎煮“火力”、增加滤过次数等以降低提取物固体量。另外,将片剂片重作为标准规格项下的合理性值得研究,如允许根据收膏量以及加入辅料量制成规定片数,片重不作特别规定,其差异按平均值作为基数计,例如日本在上个世纪即对颗粒剂重量差异采取,取20袋计算其平均重量,规定各袋与其差异不超过10%,如有则不得超过2袋,同时均不得超过25%,作为合格标准[13]。
3.3 中成药制法中工艺规定的合理表述 逍遥散源于《太平惠民和剂局方》,记载为每服6 g,水一大盏,烧生姜一块切破,薄荷少许,同煎至七分,去滓热服,不拘时候[14],但在逍遥颗粒剂、胶囊剂、片剂中的煎煮时间达3 h,是否等同于煎至七分尚无定论。临床汤剂每次煎煮时间不超过30 min,煎煮2次不会超过1 h,但中成药制法中煎煮时间普遍过长,其原因在于缺乏研究原则,或因上市时间较早,药学研究存在缺陷。逍遥颗粒收载于1998年版《卫生部药品标准》(中药成方制剂第十五册)[15],逍遥胶囊、逍遥片均为在提取方法不改变下的改剂型品种。经历三十余年,制药设备已经全面更新,但新型或不同提取设备仍执行煎煮2次,共3 h的工艺,其物质保持不变不合理。
推广到一般中成药颗粒剂、胶囊剂、片剂制法中工艺表述时,应根据具体品种制法,建立以制剂的水溶性浸出物、醇溶性浸出物作为药材和中间体质量控制指标,取消煎煮时间规定及其他参数(如浓缩终点的相对密度、滤过,醇沉浓度等),同时上清液、静置等表述应当淘汰,药品生产企业应根据品种和药材特点、生产设备等来进行确定、验证和备案。
3.4 中成药胶囊剂、片剂制法制成总量的具体执行 化药标准一般规定,单位制剂成分应为标示量的90.0%~110.0%,也有部分标准规定应为80.0%~120.0%。在保持中成药药品标准制剂规格项中制剂重量不变的前提下,在《中国药典》制剂通则中明确中成药胶囊剂、片剂等制成量在标准规定理论制成量的80.0%~120.0%为允许范围时,比较符合实际。
4 结论
中成药颗粒剂、胶囊剂、片剂标准制法表述应当更为原则、统一,可参考中药配方颗粒制法的表述方法,一般只规定提取溶剂、次数、醇沉(具体浓缩不作规定)、制成量,其他具体规定应当研究予以取消,由药品生产企业验证后备案或提出补充申请。中成药胶囊剂、片剂制成量应当明确允许波动的范围,药品生产企业应当建立和控制生产中成药所用药材浸出物控制标准,以控制提取物收得率,并结合成分转移率、特征图谱变化等一并进行研究,作为参数确定依据。
中成药药品标准制法与制成量存在工艺参数规定过多、过细的问题,归纳为缺乏统一的原则或理论支撑,造成表述不一、难以实施等现状,反映了既往中成药标准制法提取、浓缩等表述缺乏中医药理论和客观依据的现象,需引起药品生产企业和药品标准管理部门的重视。由此建议,可采用不同批次饮片均一化处理后投料,以提高不同批次药品质量的稳定均一,也应成为已批准上市的中成药工艺变更研究的指导原则。
