天麻素调节cAMP/PKA/GRK2信号通路对脑胶质瘤细胞增殖、凋亡的影响*
2022-12-01滑祥廷洪文明张超勇
滑祥廷, 洪文明, 张超勇, 王 斌△
1安徽医科大学第一附属医院神经外科,合肥 230022 2安徽省太和县人民医院神经外科,阜阳 236600
胶质母细胞瘤是颅内原发恶性肿瘤,侵袭性强,占原发性颅脑肿瘤的16%。其主要治疗方式为手术与放化疗,但效果不理想,易复发,患者预后较差,寻找有效的治疗胶质瘤药物对于改善患者预后具有重要意义[1-2]。环磷酸腺苷/蛋白激酶A(cAMP/PKA)信号通路与神经系统疾病和肿瘤的发生发展密切相关,PKA的激活可增强G蛋白偶联受体激酶2(GRK2)的磷酸化水平,参与调控肿瘤的增殖与侵袭。在胶质瘤中,抑制cAMP信号通路的激活,可促进胶质瘤细胞的增殖与迁移[3-4]。天麻素(Gastrodin)是中药天麻的主要有效成分,具有镇静、镇痛、抗炎和神经保护的作用[5],天麻素还具有抗肿瘤活性,研究显示,天麻素可以通过调节自噬水平,抑制细胞增殖,促进胶质瘤细胞凋亡[6],但天麻素对胶质瘤的作用机制尚不清楚,本研究旨在研究天麻素对人脑胶质瘤细胞增殖、凋亡及cAMP/PKA/GRK2通路的影响,探索其可能的作用机制。
1 材料与方法
1.1 主要材料
人脑胶质瘤细胞U87购于中科院上海细胞库;天麻素(XG-R10574,纯度≥98%)、MTT(M2128)购自Sigma公司;胎牛血清(FBS,16141061)、DMEM培养液(12100046)购自美国Gibco公司;cAMP/PKA信号通路抑制剂H-89(S1643)、Cyclin D1(AF1183)、p21(AF5252)、Bax(AF1270)、Bcl-2(AF0060)、Caspase-3(AF1213)抗体购自碧云天生物科技有限公司;BCA试剂(M07270)、Annexin Ⅴ-FITC/PI双染法细胞凋亡检测试剂盒(A005-1)购自北京百奥莱博科技有限公司;cAMP试剂盒(ab65355)及p-PKA(ab75991)、PKA(ab32514)、p-GRK2(ab229645)、GRK2(ab228705)抗体购自Abcam公司。
1.2 实验方法
1.2.1 细胞增殖实验 取对数生长期的U87细胞,调整细胞密度为1×105个/mL,以每孔200 μL接种于96孔板中,使用浓度为0、2.5、5、10、20、40、80 μmol/L的天麻素分别处理24、48、72 h后,每孔加入20 μL的MTT溶液,孵育4 h,检测酶标仪490nm处吸光度值(A490nm),按公式:细胞活力=(实验组A490nm-空白组A490nm)/(对照组A490nm-空白组A490nm)计算细胞存活率。
1.2.2 细胞处理及分组 将处于对数生长期的U87细胞分为5组:对照组(Control组)、天麻素低、中、高浓度组(Gastrodin-L、Gastrodin-M、Gastrodin-H组)、天麻素+cAMP/PKA信号通路抑制剂组(Gastrodin+H-89组),天麻素低、中、高浓度组分别使用浓度为5、10、20 μmol/L的天麻素处理细胞,Gastrodin+H-89组使用浓度为20 μmol/L的天麻素与10 μmol/L的H-89(cAMP/PKA信号通路抑制剂)共同处理细胞24 h。
1.2.3 平板克隆形成实验 处理后的各组U87细胞,按照约500~1000个/孔接种于6孔板中,培养2周后,弃去多余培养液,10%多聚甲醛固定,室温下用0.2%结晶紫染色2 h,在光学显微镜下拍照,并应用Image J软件对细胞集落数量进行统计。
1.2.4 流式细胞术检测细胞周期与细胞凋亡 收集各组处理的U87细胞,1000 r/min离心5 min收集细胞,PBS洗涤,加入无水乙醇4℃条件下固定30 min,PBS洗涤,加入PI染液和RNaseA,避光孵育20 min,流式细胞仪分析细胞周期分布。
另取各组U87细胞,分别加入10 μL Annexin Ⅴ和PI,避光孵育30 min,流式细胞仪检测细胞凋亡。
1.2.5 ELISA法检测U87细胞cAMP浓度 各组处理的U87细胞培养48 h后,收集上清液,3000 r/min离心20 min,上清-20℃保存,采用ELISA法检测cAMP水平。
1.2.6 Western blot法检测蛋白表达 各组处理的U87细胞培养48 h后,离心收集细胞,加入RIPA裂解液提取总蛋白,BCA法检测蛋白浓度,取适量蛋白进行SDS-PAGE电泳并转膜,50 g/L脱脂奶粉室温封闭2 h,分别加入Cyclin D1(1∶500)、p21(1∶1000)、Bax(1∶1000)、Bcl-2(1∶500)、Caspase-3(1∶1000)、p-PKA(1∶500)、PKA(1∶500)、p-GRK2(1∶500)、GRK2(1∶500)抗体稀释液,4℃孵育过夜,TBST洗PVDF膜3次,再加入鼠抗兔二抗(1∶2000)室温孵育2 h,滴加发光液显色,应用Image J软件测定蛋白条带灰度值。
1.3 统计学方法
2 结果
2.1 天麻素对U87细胞增殖的影响
使用不同浓度的天麻素(2.5、5、10、20、40、80 μmol/L)分别处理U87细胞24、48、72 h后,与对照组(0 μmol/L天麻素)比较,不同浓度的天麻素处理后U87细胞存活率显著下降(均P<0.05),其中,20 μmol/L的天麻素处理U87细胞的细胞活力约下降50%,见图1。故选择5、10、20 μmol/L的天麻素进行后续实验。
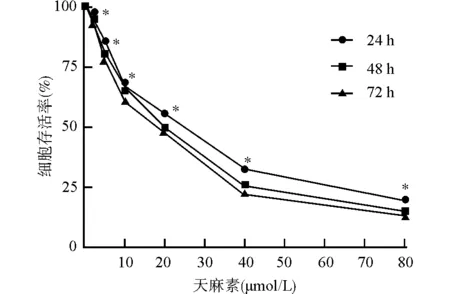
与0 μmol/L组比较,*P<0.05图1 不同浓度的天麻素对U87细胞增殖的影响Fig.1 Effects of different concentrations of gastrodin on proliferation of U87 cells
2.2 天麻素对U87细胞周期分布及相关蛋白表达水平的影响
与Control组比较,Gastrodin-L、Gastrodin-M、Gastrodin-H组G0/G1期细胞比例、p21蛋白表达水平显著升高,S期与G2/M期细胞比例显著降低,Cyclin D1蛋白表达水平显著降低(均P<0.05),且上述作用呈药物浓度依赖性;与Gastrodin-H组比较,Gastrodin+H-89组G0/G1期细胞比例、p21蛋白表达水平显著降低,S期与G2/M期比例、Cyclin D1表达水平显著升高(均P<0.05),见图2与表1。
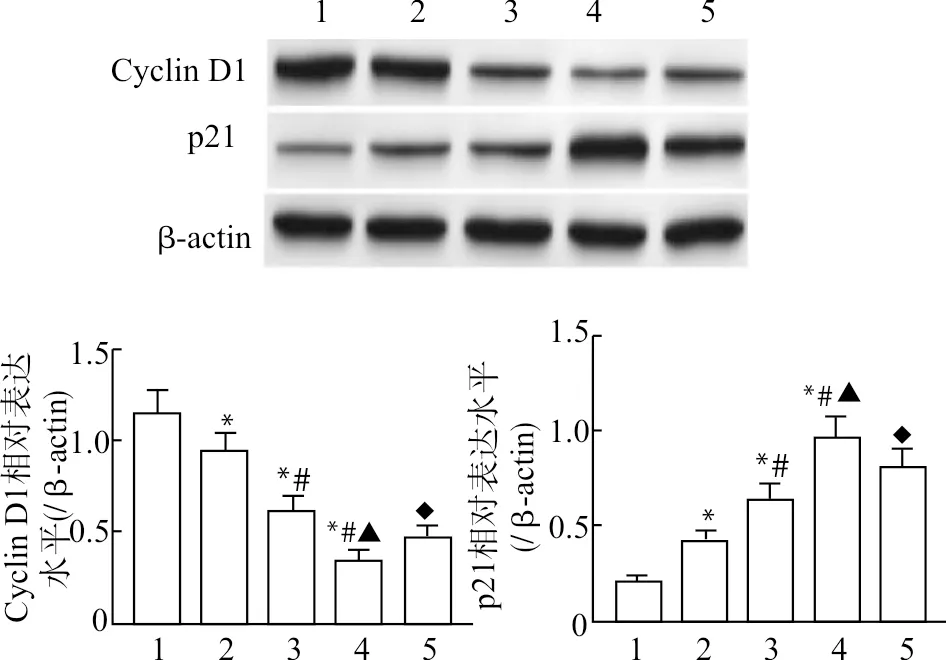
1:Control组;2:Gastrodin-L组;3:Gastrodin-M组;4:Gastrodin-H组;5:Gastrodin+H-89组;与Control组比较,*P<0.05;与Gastrodin-L组比较,#P<0.05;与Gastrodin-M组比较,▲P<0.05;与Gastrodin-H组比较,◆P<0.05图2 天麻素对U87细胞Cyclin D1、p21蛋白表达的影响Fig.2 The effect of gastrodin on the expression of Cyclin D1 and p21 proteins in U87 cells

2.3 天麻素对U87细胞集落形成的影响
与Control组比较,Gastrodin-L、Gastrodin-M、Gastrodin-H组集落形成数显著减少,且呈药物浓度依赖性(P<0.05);与Gastrodin-H组比较,Gastrodin+H-89组集落形成数显著增加(P<0.05)。见图3。
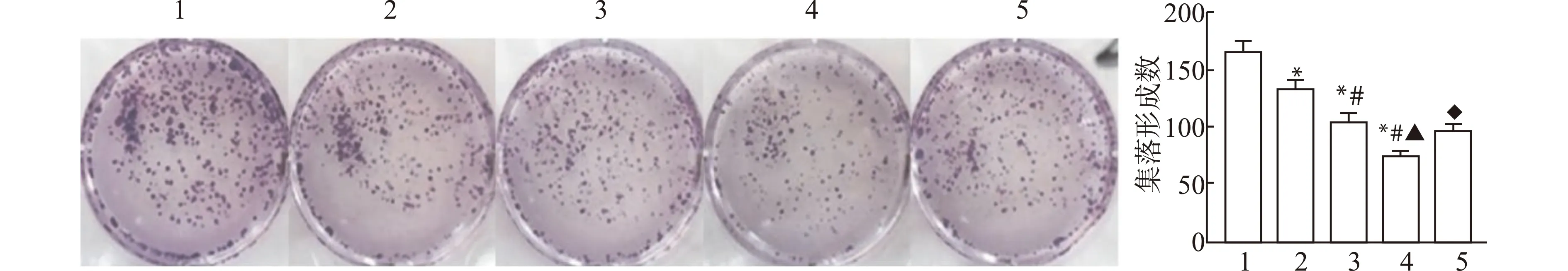
1:Control组;2:Gastrodin-L组;3:Gastrodin-M组;4:Gastrodin-H组;5:Gastrodin+H-89组;与Control组比较,*P<0.05;与Gastrodin-L组比较,#P<0.05;与Gastrodin-M组比较,▲P<0.05;与Gastrodin-H组比较,◆P<0.05图3 平板克隆形成实验检测天麻素对U87细胞增殖的影响Fig.3 Effect of gastrodin on proliferation of U87 cells detected by plate colony formation assay
2.4 天麻素对U87细胞凋亡的影响
与Control组比较,Gastrodin-L、Gastrodin-M、Gastrodin-H组细胞凋亡率与Bax、Caspase-3蛋白表达水平显著升高(均P<0.05),Bcl-2表达水平降低(均P<0.05),且变化呈药物浓度依赖性;与Gastrodin-H组比较,Gastrodin+H-89组细胞凋亡率与Bax、Caspase-3蛋白表达水平显著降低(均P<0.05),Bcl-2表达水平明显升高(均P<0.05)。见图4、图5。
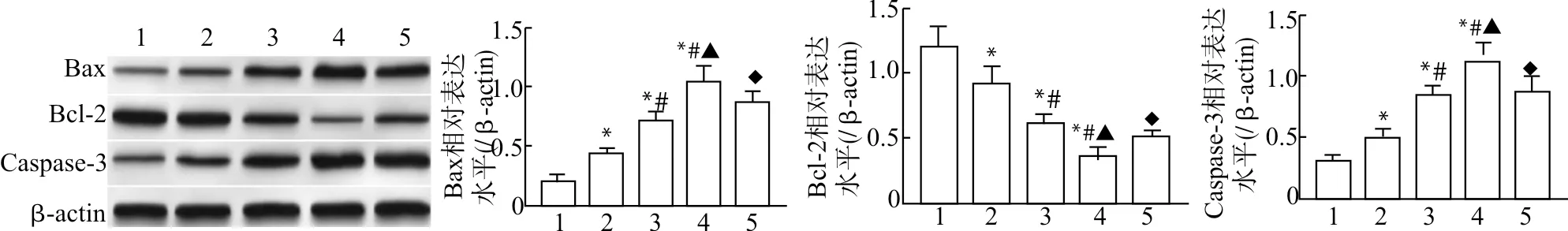
1:Control组;2:Gastrodin-L组;3:Gastrodin-M组;4:Gastrodin-H组;5:Gastrodin+H-89组;与Control组比较,*P<0.05;与Gastrodin-L组比较,#P<0.05;与Gastrodin-M组比较,▲P<0.05;与Gastrodin-H组比较,◆P<0.05图4 天麻素对U87细胞Bax、Bcl-2、Caspase-3蛋白表达的影响Fig.4 Effect of gastrodin on expression of Bax,Bcl-2 and Caspase-3 in U87 cells

1:Control组;2:Gastrodin-L组;3:Gastrodin-M组;4:Gastrodin-H组;5:Gastrodin+H-89组;与Control组比较,*P<0.05;与Gastrodin-L组比较,#P<0.05;与Gastrodin-M组比较,▲P<0.05;与Gastrodin-H组比较,◆P<0.05图5 流式细胞仪检测天麻素对U87细胞凋亡的影响Fig.5 Effect of gastrodin on apoptosis of U87 cells detected by flow cytometry
2.5 天麻素对U87细胞cAMP/PKA/GRK2通路相关蛋白表达的影响
与Control组比较,Gastrodin-L、Gastrodin-M、Gastrodin-H组U87细胞cAMP水平及PKA、GRK2蛋白磷酸化水平显著升高(均P<0.05),且呈药物浓度依赖性;与Gastrodin-H组比较,Gastrodin+H-89组U87细胞cAMP水平及PKA、GRK2蛋白磷酸化水平显著降低(均P<0.05),见图6。
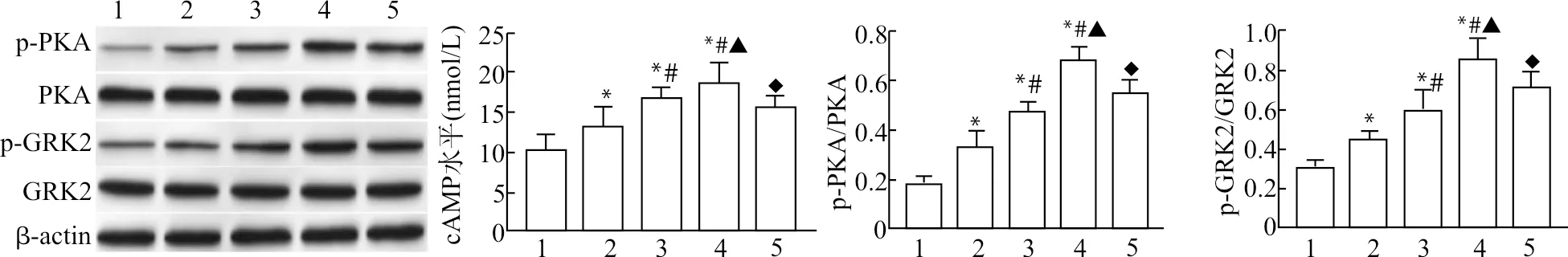
1:Control组;2:Gastrodin-L组;3:Gastrodin-M组;4:Gastrodin-H组;5:Gastrodin+H-89组;与Control组比较,*P<0.05;与Gastrodin-L组比较,#P<0.05;与Gastrodin-M组比较,▲P<0.05;与Gastrodin-H组比较,◆P<0.05图6 天麻素对U87细胞cAMP水平及PKA、GRK2蛋白磷酸化的影响Fig.6 Effects of gastrodin on cAMP levels and phosphorylation of p-PKA and p-GRK2 in U87 cells
3 讨论
胶质母细胞瘤是Ⅳ级胶质瘤,侵袭性强,恶性程度高,患者发病率与死亡率高,患者表现为颅内压升高、癫痫发作、认知功能障碍等,有效的治疗手段对于改善患者病情具有重要意义[7]。
天麻素具有抗眩晕、抗惊厥、抗癫痫、抗氧化损伤、保护神经损伤与心肌损伤等多种药理活性[8],还具有抗肿瘤活性,对肝癌、胃癌细胞的增殖均有一定的抑制作用[9-10]。有研究报道,天麻素可通过抗氧化作用抑制过氧化氢诱导的大鼠胶质瘤细胞系的铁死亡[11]。为研究天麻素对脑胶质瘤的作用机制,本研究使用不同浓度的天麻素分别处理人脑胶质瘤U87细胞,结果发现U87细胞存活率显著下降,表明天麻素可抑制U87细胞增殖。本研究使用浓度为5、10、20 μmol/L的天麻素处理U87细胞,细胞凋亡率显著升高,细胞集落形成数显著降低,且呈药物浓度依赖性,表明天麻素对脑胶质瘤表现出抗肿瘤性,与先前报道结果类似。有研究提示,天麻素联合异钩藤碱可抑制1-甲基-4-苯基吡啶离子诱导的PC12细胞细胞周期阻滞,使G0/G1期细胞比例减少[12]。本研究中,天麻素可阻滞U87细胞周期在G0/G1期,抑制U87细胞增殖。可能在不同的细胞中其受药物浓度的影响,作用机制也不相同。另有研究显示,天麻素与化疗药长春新碱合用可显著增强对乳腺癌移植瘤大鼠的抑瘤活性[13],提示天麻素在临床上可用于肿瘤的辅助治疗。
cAMP/PKA通路在调控细胞增殖、分化中发挥重要作用。cAMP可激活PKA,通过磷酸化下游转录因子,如cAMP反应元件结合蛋白(CREB),调节基因的表达,参与细胞代谢与增殖,参与调节神经细胞与肿瘤细胞的作用[14-15]。cAMP/PKA通路的激活可抑制恶性胶质瘤细胞增殖,促进细胞凋亡。研究提示,天麻素可通过上调cAMP/PKA/CREB信号通路,上调脑源性神经营养因子(BDNF)的表达,保护甲基苯丙胺诱导的皮质神经元凋亡[16]。GRK2属于G蛋白偶联受体激酶家族,参与调节肿瘤血管生成与炎症反应,PKA能够调节GRK2的活性及其在膜上的靶向定位,且GRK2依赖的CREB激活,可调节PC12神经元分化,发挥神经保护作用[17-18]。本研究使用不同浓度天麻素处理U87细胞后,细胞cAMP水平,PKA、GRK2蛋白磷酸化水平显著升高,且呈药物浓度依赖性,提示天麻素具有激活cAMP/PKA/GRK2通路的作用。另外,本研究还显示,使用cAMP/PKA抑制剂H-89与天麻素共同处理U87细胞后,可部分逆转天麻素对U87细胞增殖的抑制作用,证实天麻素可能通过上调cAMP/PKA/GRK2通路抑制脑胶质瘤细胞增殖,诱导细胞凋亡。
本研究在细胞水平证实了天麻素对脑胶质瘤细胞的增殖抑制作用,并对相关通路蛋白进行了初步探讨,后续还需结合动物实验进行进一步的研究。
