综合创新实验“电催化还原二氧化碳”的教学探索*
2022-12-01张鲁华丁晓墅于丰收
张鲁华,丁晓墅,于丰收
(河北工业大学化工学院,天津 300401)
1 该实验进入课程教学的重要性和价值
近年“生态优先、绿色发展”的新理念对化工行业发展提出了新要求,绿色低碳化工也成为适应时代要求的化工生产基本趋势。电化学合成方法因其反应条件温和、环境污染小、原子经济性好等优点[1],已成为绿色化工典范,在氯碱工业、霍尔-埃鲁法合成铝工业及其他有机物合成中得到广泛应用[2]。众所周知,人才是技术、经济发展的首要资源,这就要求化工类专业教育应与化工产业发展紧密联系、互相支撑。目前电化学专业相关的学生通过前期专业导论课、专业基础课、专业实验等课程的学习,已经掌握了电化学合成的基本原理,具备了文献检索和总结归纳的能力[3-4]。但是面对工业生产中的工艺路线或者科学研究中电化学相关的测试评价装置时,学生又很难将所学的电化学理论知识融会贯通地与实际操作进行有机衔接[5]。因此,如何通过设计实验,增强学生的工程实践能力,帮助学生树立绿色化工理念,成为专业教育需要解决的问题。
气候、能源问题已成为全社会关注的焦点问题,当代大学生对此也颇感兴趣。2020年9月,习近平主席在第75届联合国大会上承诺中国将2030年前实现碳达峰,2060年实现碳中[6]。在此背景下,以电能为驱动力,在温和条件下将CO2直接转化为高附加值化学品的电催化还原CO2方法,同时实现了CO2资源化利用和洁净电能的有效存储,有望成为CO2规模化利用技术之一[7]。目前电催化还原CO2作为前沿的科研问题,仅是研究生的课题,相关实验方法在本科生教学中仍鲜有报道。本文设计了一个综合创新实验,以国内外前沿的电化学相关课题:电催化还原CO2为基础,通过设计合理电化学实验,将目前的研究现状、研究成果以及实验方法融入到本科生的课堂教学中,希望在加深学生对电化学基本原理认识的同时,不断提高学生的动手能力和工程实践能力,牢固树立绿色化工的理念。
2 实验设计思路
如图1所示,实验设计环节遵循“学习-实践-再学习”原则,充分考虑到对学生的知识运用和能力培养。完整的实验方案,可促进多方面知识融合,使学生多方面能力得到锻炼。

图1 实验设计环节与知识运用、能力培养对应关系
3 教学过程设计
该实验项目将通过24学时完成,教学过程分为以下4部分:
(1)理论课讲授。通过2学时的课上讲授,让学生了解该实验的目的、基本的实验原理、催化剂的设计思路、性能评价方法等。
(2)制定实验方案。学生通过查阅文献,提出实验方案;教师审核学生的实验设计,与学生讨论互动,确定最终合理的实验方法;教师根据学生的方案,进行实验前的相关准备。
(3)开展实验。实验部分通过22学时完成:1)实验前安全教育教育必不可少,包括实验室基本安全规范、药品的安全使用、以及实验设备的正确操作,共计4学时;2)催化剂制备2个学时,性能测试8个学时,催化剂循环性能测试8个学时,各环节可以交叉进行。实验涉及步骤较多,可将学生按每组3-5人分组,确保每位学生都能体验每项操作。
(4)总结实验和撰写报告。实验结束后,要求学生按照科技论文写作要求,撰写论文。
4 实验的完整示例
4.1 实验目的
(1)掌握电化学性能表征的基本手段及催化剂性能的评价方法;
(2)熟悉实验室常规仪器的操作规范和使用方法;
(3)练习文献检索能力,实验总结能力,提高论文写作水平。
4.2 实验原理
当电解质溶液不含底物CO2和其他可以被电活化的小分子例如O2时,质子还原反应(hydrogen evolution reaction, HER)是工作电极表面唯一可能发生的反应。当溶液中存在CO2时,除了HER,电极表面还会发生CO2还原反应(carbon oxide reduction reaction,CO2RR)。与HER类似,CO2还原反应同样始于CO2分子在催化剂表面吸附。然后,经过多步质子耦合电子转移过程,最终生成还原产物,如CO、HCOOH、CH4、C2H4等[8-9]。无论是HER还是CO2还原反应,都需要源源不断地得到电子。这意味着,需要在对电极发生氧化反应,以补偿还原反应消耗的电子。通常以水氧化反应(oxygen evolution reaction, OER)作为对电极补偿反应,为工作电极还原过程提供电子。
4.3 实验方法
由于催化剂的制备和表征过程涉及多种实验室仪器设备,而且合成过程耗时较长。因此,催化剂由商业化的Ag片替代。接下来的实验分为电解池组装和电化学性能测试两部分。
4.3.1 电解池组装
本实验采用的H-型电解池分为工作电极和对电极两室,两个腔室中的电解质通过Nafion膜分离(见图2a)。测试过程中采用银片作为催化剂(工作电极),以Ag/AgCl作为参比电极、铂丝作为对电极。采用密封测试系统进行测试,需要保证电解池的气密性。电解池组装过程如图2b所示:每组取一个H-电解池,将尺寸合适的Nafion 117质子膜放于电解池中间,用夹子加紧;工作电极室装入工作电极和参比电极,对电极室装入对电极;向两个电极室分别加入35 mL的0.1 M KHCO3电解液,并通入N2保持20 min。
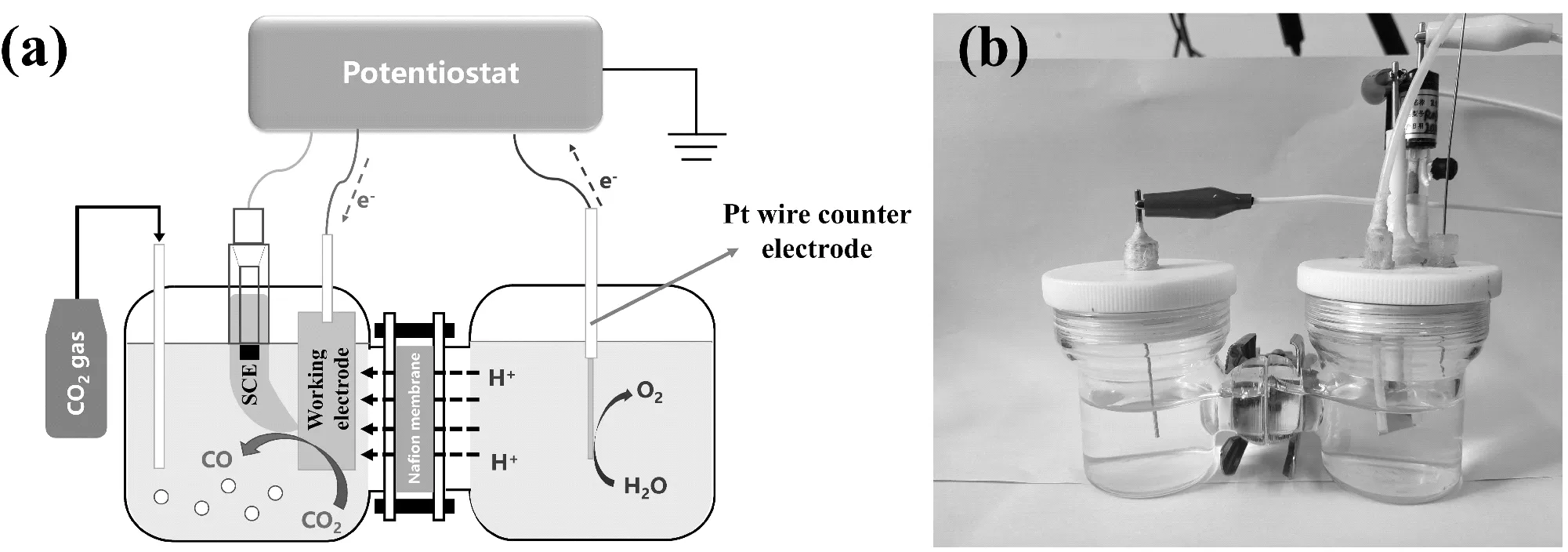
图2 电化学还原CO2装置示意图(a)及其H-型电解池(b)
4.3.2 电化学性能测试
利用电化学工作站测试CO2还原性能,包括以下测试方法:
(1)线性扫描伏安曲线(LSV)测试
打开电化学工作站软件,选择LSV模式,设置起始电位与终止电位,扫速为0.05 V/s,并将三电极与电解池对应连接,测试得到N2氛围下的LSV曲线;通入CO2并保持20 min使电解液达到饱和,重复上述步骤,得到CO2氛围下的LSV曲线;对比N2与CO2氛围下的LSV曲线,从而确定恒电位电解电位区间(见图3a)。
(2)恒电位电解测法拉第效率(FE)
如3a图所示,CO2氛围下的电流密度在-0.4 Vvs. RHE明显高于N2氛围下的电流,说明在该电位下Ag电极开始活化CO2。从-0.4 Vvs. RHE开始,每隔0.1 V取6~8个电位,进行恒电位电解实验。选择电化学工作站软件的i-t模式,设置相应的电解电压,电解时间20 min(图3b)。电解实验结束后收集电解产物,利用气相色谱定量分析产量,根据公式1计算不同电位下产物法拉第效率,得到图3c。
计算不同电压下各还原产物的FE。还原产物CO或H2的FE计算公式如下:
(1)
式中:Q是总电荷数,C;VCO2是密闭电解池中空腔体积,mL;C是气体产品浓度,ppm;n是生成还原产物转移的电子数;t是电解时间,s。
(3)催化剂稳定性评价
除了电化学CO2还原活性外,电化学稳定性也是评价电催化剂的重要指标。如图3d所示,Ag电极在-0.7 Vvs. RHE电位下电解8 h,CO的法拉第效率仍能保持在90%以上。
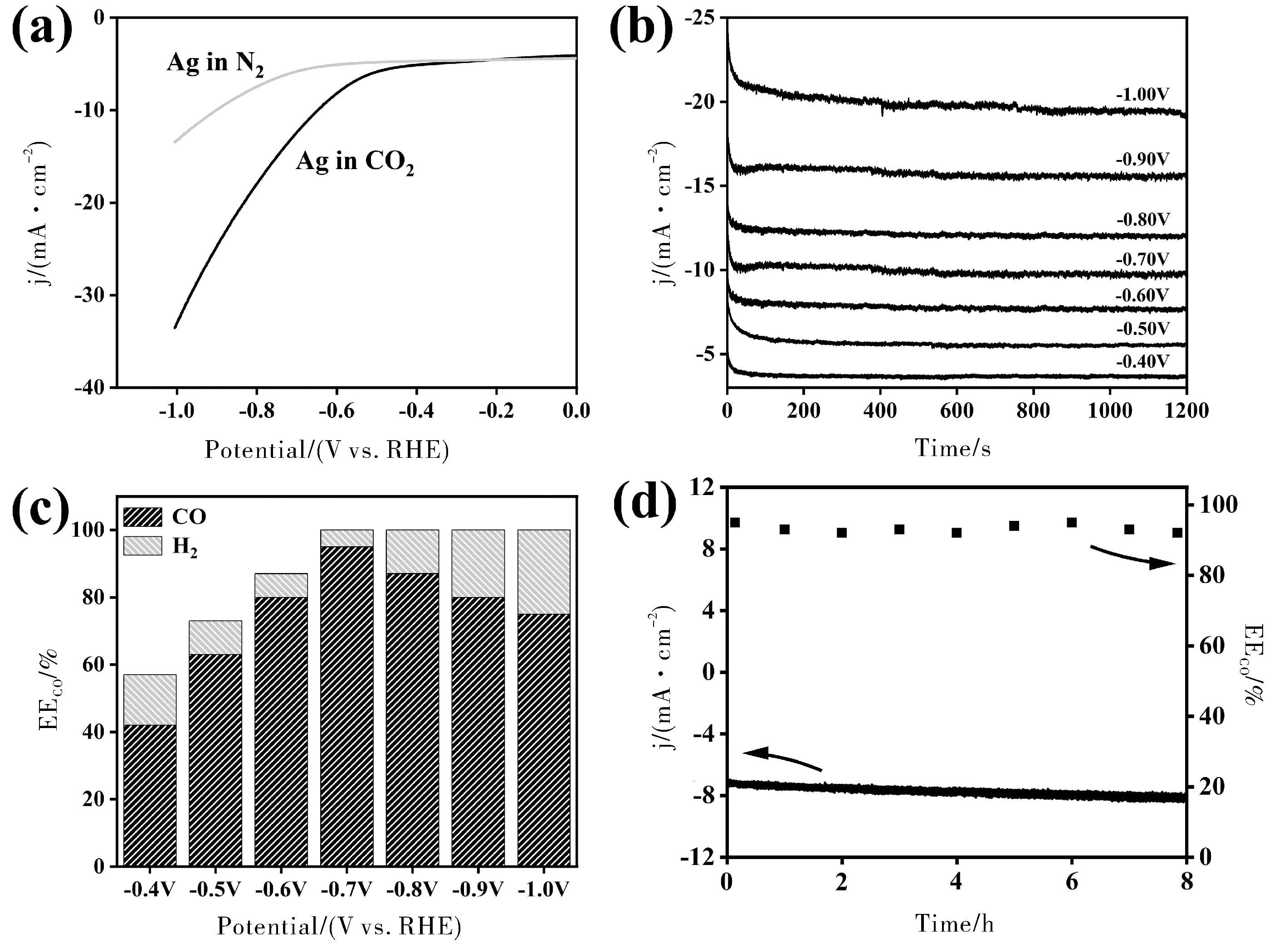
图3 Ag电极(a)LSV曲线;(b)i-t曲线;(c)法拉第效率;(d)稳定性测试
5 结 语
本文将科学研究前沿课题:电化学还原CO2,引入本科生教学实验中,介绍了电解池设计基本方法,催化剂性能评价方法等,改变了以往课程理论性强、知识点抽象、学生听课效率低的不足,激发了学生的学习兴趣。通过调整课程内容、优化作业及考核方式等对课程教学提出教学探索,力图搭建应用化学课程由理论到实践的桥梁,以及激发工科学生的创造力,响应“产教融合”教学改革,为国家培养专业性人才有一定的指导意义。将来会继续遴选易于操作的前沿课题,凝练成综合实验,给予学生更多选择,以开阔创新思维、提升创新能力。
