新生儿B组溶血性链球菌败血症或合并脑膜炎9例临床分析
2022-11-30李玉蕊张雪峰
李玉蕊,张雪峰
B组溶血性链球菌 ( group B streptococcus,GBS) 是一种需氧革兰氏阳性球菌,是导致新生儿脓毒症和脑膜炎最常见的细菌,严重时可导致新生儿死亡。孕产妇生殖道感染是目前新生儿GBS感染的主要途径,妊娠期GBS普遍筛查和产时抗生素预防( intrapartum antibiotic prophylaxis, IAP) 应用,可显著降低新生儿早发型( early-onset disease,EOD) GBS感染的风险,但仍需进一步改善和加强[1],在产科IAP的背景下,EOD-GBS败血症的总体发病率较低,但如果未行产前GBS筛查,或因检测本身局限性,筛查结果阴性孕母所生新生儿也存在GBS败血症发病风险。国内不少专家已对孕期GBS筛查有所重视,但尚无依据我国国情的孕期GBS筛查诊疗规范,尤其孕母GBS筛查阴性新生儿发生GBS败血症的报道尚较少见。本文就我院收治的9例新生儿GBS败血症做临床回顾性分析,旨在总结经验,指导临床。
1对象与方法
1.1 对象 2017-2020年入住我院的新生儿GBS败血症9例及其母亲的病历资料,包括其母亲的检查情况与合并症,新生儿的发病时间、一般情况、临床表现、辅助检查、抗菌药物治疗方案及随访情况等;入院后即刻完善血常规及CRP和或降钙素等化验,抗生素应用之前取静脉血完善血培养。
1.2 方法 回顾分析2017年至2020年入住我院新生儿GBS败血症9例的临床资料及其孕期情况。
1.3 诊断标准 新生儿GBS败血症合并脑膜炎诊断标准参照第5版《实用新生儿学》[2]:(1)具有败血症和化脓性脑膜炎脑脊液改变;(2)具有败血症和化脓性脑膜炎的临床表现;(3)双份血培养和(或)脑脊液培养出无乳链球菌。早发型通常是指3 d内的感染(0~3 d),>3 d者为晚发型[3]。

2结 果
2.1 一般资料及临床情况分析 (1)基本情况:同期住院的9例GBS败血症患儿中,男3例,女6例;足月儿8例,早产儿1例(31周早产儿),平均胎龄(38.38±2.89)周;5例顺产,4例剖宫产;其中3例出生在我院产科,余均出生在外院产科,2例晚发性GBS败血症在院外发病。(2)母孕期情况:1例患儿其母分娩前筛查GBS阳性,并给予青霉素预防治疗,本患儿病情相对轻,疗程短;6例患儿母亲孕期筛查GBS阴性,2例未筛查GBS(其中1例为31周早产儿);羊水污染者1例;早破水者2例,均大于18 h;分娩前均无宫内窘迫;母亲产前发热者3例,最高达39 ℃;母亲患梅毒者1例;孕期伴有甲状腺功能减退者、糖尿病者各1例,同时患甲状腺功能减退及孕期糖尿病者1例;其母患绒毛膜羊膜炎者1例(表1)。(3)发病情况:9例患儿中早发性败血症7例,晚发性败血症2例,均第3天血培养结果阳性,均伴有C反应蛋白(CRP)明显升高,平均(77.49±52.91)mg/L,1例PCT正常,余均有升高,白细胞(WBC)平均为(14.91±13.26)×109/L,其中3例患儿白细胞明显低于正常;出现病理性黄疸者6例;肺炎起病者3例,其中1例入院后给予有创呼吸机辅助通气,1例无创呼吸机辅助通气,1例鼻导管吸氧;发热起病者6例,最低体温37.5 ℃,最高体温39 ℃,平均温度在38.2 ℃,发热伴有惊厥者3例。(4)治疗情况:9例患儿中GBS脑膜炎者5例,其中脑脊液培养出GBS者4例,头颅核磁异常者3例,1例因死亡未完善头颅核磁。治愈出院者4例,好转出院4例,死亡1例。8例均采用青霉素联合头孢他啶或头孢曲松或美罗培南治疗,1例采用头孢曲松单独用药。9例患儿发病时间及具体实验室检查见表2。
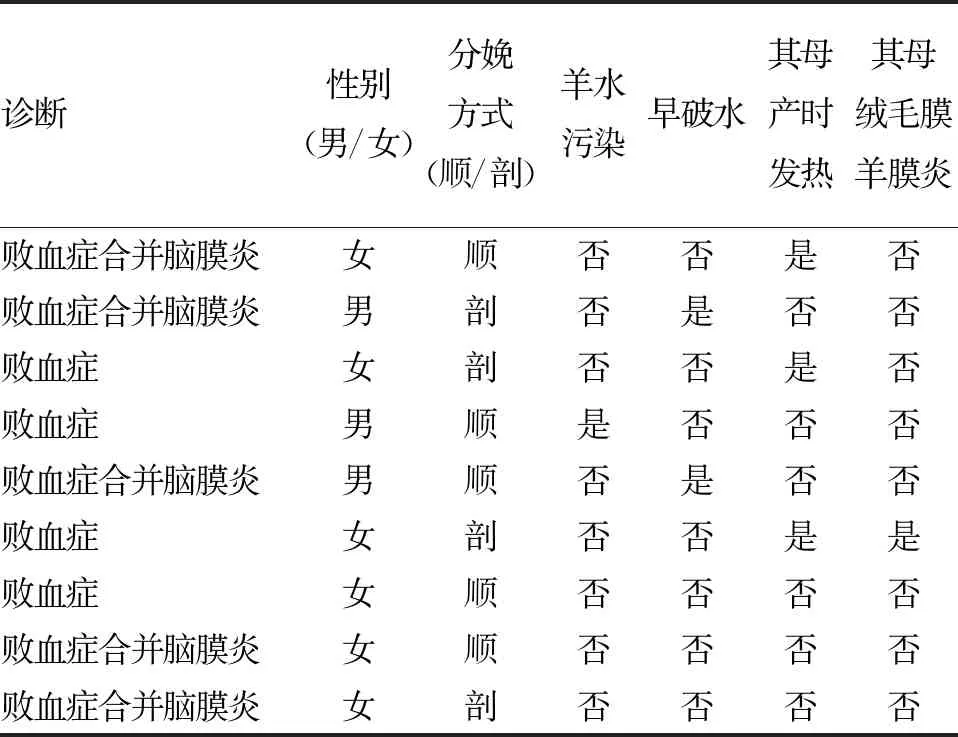
表1 9例GBS败血症患儿母亲产前高危因素情况

表2 9例GBS败血症患儿发病时间、实验室检查结果
2.2 GBS血培养药敏结果 药敏实验检出的9株GBS对青霉素、氨苄西林、利奈唑胺、万古霉素、呋喃妥因均敏感;对克林霉素均耐药;1株对头孢曲松耐药;2株对四环素敏感(表3)。9例中1例采用头孢曲松治疗,余均应用青霉素联合用药。
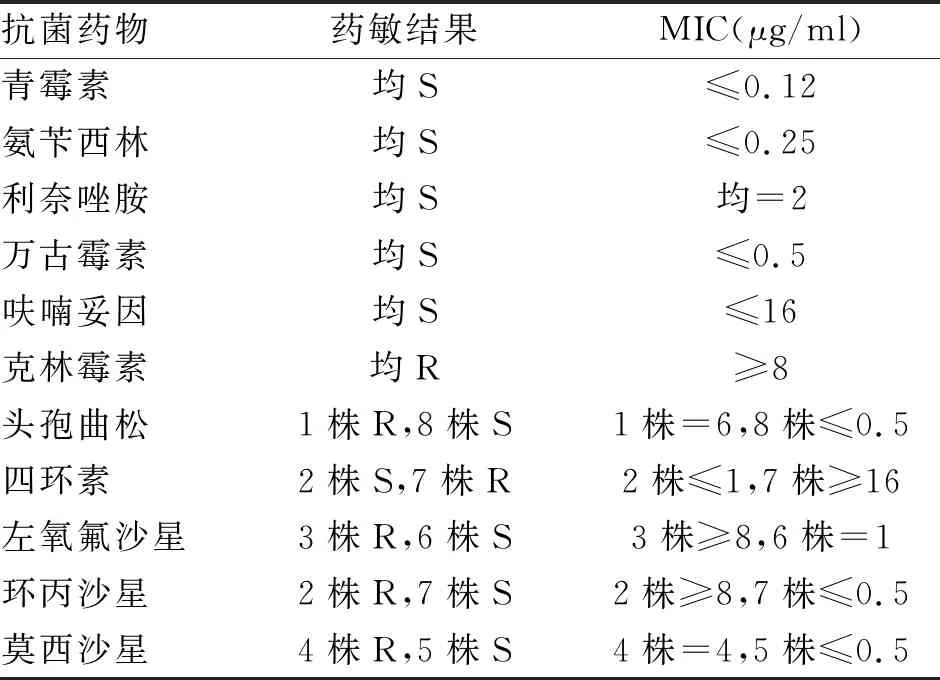
表3 9株GBS对常用抗菌药物的药敏结果
2.3 结局及预后 9例患儿中除1例住院3 d死亡外,余8例经治疗1周后,CRP及PCT基本转至正常,血培养8例转阴,血清白细胞治疗2周时基本恢复正常。但GBS脑膜炎患儿脑脊液白细胞及蛋白下降缓慢,除1例死亡外,余4例脑膜炎患儿脑脊液白细胞及蛋白均在4周之后逐渐降至正常,其中1例在治疗78 d时复查脑脊液白细胞仍高于正常,予出院后继续口服药物治疗3周后脑脊液白细胞及蛋白转阴。所有患儿出院后1、6、12、24个月电话随诊,其中1例发育滞后,余均正常。
3讨 论
GBS作为条件致病菌寄生于孕妇阴道内,对于未采取及时治疗措施的孕晚期孕妇,GBS会通过上行感染,影响到宫内情况,严重时可导致晚期流产、早产、新生儿感染,引起新生儿不良妊娠结局[4,5]。新生儿GBS感染可引起新生儿呼吸窘迫、窒息、肺炎、败血症、脑膜炎。本研究9例患儿中,肺炎呼吸困难起病者3例,发热败血症起病者6例,并发脑膜炎者5例。有关研究显示,国内35周以上孕妇的GBS带菌率为10%左右,而GBS是导致产妇及新生儿发生感染的首要影响因素[6]。统计显示北京地区孕妇围产期带菌率为13%, GBS 已成为围产期新生儿细菌感染性疾病的主要致病菌[7],我院同期住院新生儿败血症者共61例,统计GBS败血症占比为15%,由此可见GBS败血症并不少见。
预防新生儿GBS败血症的第一步是对产妇的筛查及预防。本研究中9例患儿只有1例产妇筛查GBS阳性,可见,临床产妇GBS筛查仍有漏筛或假阴性的情况,进而无法进行产妇的抗生素预防治疗,加大了新生儿感染概率。国外有研究表明,在孕晚期GBS阳性的孕妇中,有17%~25%的产妇在分娩时会出现GBS阴性,而孕35~37周GBS阴性的孕妇大约有5%~7%分娩时出现GBS阳性,可见GBS的定植可以是持续性、短暂性或间断性,导致妊娠晚期GBS的筛查易出现漏筛的情况[8]。Jennifer等[1]认为,通过改进围产期检查方法及疫苗,可进一步降低其发生率。但在安全有效GBS疫苗审批上市前,需要继续保持和提升预防措施的有效性,同时需重视其母筛查GBS阴性,但有其他感染高危因素的患儿,如胎膜早破>18 h、羊水污染、母亲产发热、患有绒毛膜羊膜炎者,需高度重视此类产妇所分娩新生儿,早期识别早发感染。我国母婴同室早发感染高危儿临床管理专家共识指出,除需高度重视母亲有感染高危因素的婴儿外,对于无已知高危感染因素者,需重视产科和儿科信息沟通、密切临床观察及感染指标的检测,早期预防性地使用抗生素,可进一步降低新生儿早发感染发生率和致残致死率[9]。
范小萍等[10]对56例新生儿GBS败血症中血乳酸、CRP、降钙素原(PCT)、白介素-6(IL-6)水平检测研究发现,CRP的AUC值最高,CRP升高对新生儿GBS意义最大,当然四项指标联合检测效果最好。也有研究发现,10例新生儿GBS感染患儿中,均伴有PCT的升高,本研究9例患儿中CRP均有增高,平均在(77.49±52.91)mg/L,8例PCT升高,WBC平均为(14.91±13.26)×109/L,其中3例患儿WBC明显低于正常,由此可见对于有GBS高危感染或其他感染因素高危者,建议早日联合检测血常规、CRP、PCT等炎性指标,并选用对GBS敏感青霉素类抗生素联合用药[11]。
流行病学调查显示,该病对红霉素及克林霉素的耐药性较高,GBS菌株最敏感的抗生素当属青霉素[12,13],对于该病的药物治疗目前尚无统一的专家共识,临床多采用联合用药。有研究显示GBS 感染所致化脓性脑膜炎患儿行头孢曲松钠与氨苄西林联合治疗的效果显著,明显优于单用氨苄西林组,可缓解患儿的临床体征与相应症状,且具有较佳预后,建议可推广[14]。本研究中的9例患儿中,5例合并脑膜炎,占比55.56%;死亡1例,占11.11%;运动发育迟缓者1例,占11.11%。9例患儿中,只有1例采用了头孢曲松单独抗感染治疗,余均采用青霉素和头孢曲松或美罗培南等联合用药。众所周知新生儿败血症抗感染疗程一般为10~14 d,脑膜炎疗程建议为14~21 d,从本研究发现,GBS败血症合并脑膜炎中,除1例死亡外,平均住院日为47 d,可见临床中GBS败血症合并脑膜炎患儿的疗程可能会更久。
新生儿GBS感染很复杂,并发脑膜炎概率高,具有侵袭性,治疗时间久,费用高,而且可能出现严重的后遗症甚至死亡。尤其是对于其母未行产前GBS筛查,或GBS筛查阴性产妇所分娩的婴儿,需提高对新生儿常见症状的识别能力,早发现早治疗,预防和减少其所致后遗症及死亡。产科医师和新生儿医师共同努力,旨在完善GBS的普遍筛查,降低孕母GBS漏筛率、完善早产儿筛查及预防策略,从而减少新生儿GBS感染,降低新生儿GBS病死率、病残率。
