投喂频率对杂交鲷及黑鲷的体成分、血清生化及基因表达的影响
2022-11-30孙瑞健仇玉燕杨志强倪可雯徐大凤于雯雯刘艳丽肖李霞陈淑吟
孙瑞健 ,仇玉燕 ,2,杨志强 ,倪可雯 ,2,徐大凤 ,于雯雯 ,刘艳丽 ,肖李霞 ,陈淑吟 *
(1.江苏省海洋水产研究所,江苏 南通 226007;2.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;3.江苏省淡水水产研究所,江苏 南京 210017;4.启东市渔业技术推广站,江苏 启东 226213)
适宜的投喂频率不仅可以促进鱼的健康生长,降低规格差异,还可以节约饲料,改善水质[1-3]。通过检测鱼体健康相关指标,可以了解设置的投喂频率是否适宜。文献[4]研究表明,鱼体的营养状况、健康水平以及生理代谢等情况,可以通过体成分与血清生化指标来反映;文献[5-6]指出,投喂频率对鱼类的体成分和血清生化指标等有显著影响。如投喂次数从每日1 次增加至4 次,条石鲷(Oplegnathus fasciatus)幼鱼的粗脂肪含量显著升高8.8%,而灰分含量显著降低11.8%[7];牙鲆(Paralichthys olivaceus)幼鱼每天投喂3 次较每2 d投喂1 次的粗蛋白和粗脂肪含量分别升高10.6%和 87.5%[8];花鲈(Lateolabrax maculatus)幼鱼的水分含量随着投喂次数的升高而降低[9]。团头鲂(Megalobrama amblycephala) 在每日投喂 3~4 次时,血液溶菌酶含量升高[10];饥饿状态会导致黄颡鱼(Pelteobagrus fulvidraco)幼鱼血清总蛋白含量显著升高[11]。另外,与鱼体营养及能量需求相关功能基因也受到投喂频率的影响[12]。当投喂频率从每日2 次升至4 次时,中华鲟(Acipenser sinensis)幼鱼肝脏ghr 基因表达量显著降低,igf1 表达量显著升高[13];每日投喂 4 次,黄颡鱼(P. fulvidraco)幼鱼的肝脏lpl[14]及sod[15]基因表达量均显著高于只投喂1 次的。
杂交鲷为选育的新品系,是以黑鲷(Acanthopagrus schlegelii)(♀)×真鲷(Pagrus major)(♂)的杂交子一代为亲本获得的杂交子二代,其在早期发育阶段,已表现出了明显的生长优势[16],是生长性能好、抗逆性强的潜力品种之一。从前期研究中,已了解杂交鲷与黑鲷的最佳投喂频次,杂交鲷相对具有更优的生长性能[1]。现分析比较投喂频率对杂交鲷和黑鲷的体成分、血清生化及基因表达等影响,深入了解投喂频率对其影响的机制,拟为其个性化投喂管理提供依据。
1 材料与方法
1.1 试验鱼来源
试验鱼为江苏省海水增养殖技术及种苗中心繁育的健康幼鱼。随机抽取规格一致的个体进行试验,其中杂交鲷体质量(6.42±0.14)g,体长(5.70±0.11)cm;黑鲷体质量(6.52±0.23)g,体长(5.86±0.14)cm。
1.2 试验设计
试验前,将试验鱼暂养1 周。共设置4 个投喂频率组(1~4 次/d,简称 1 T—4 T)。相同投喂频率的2 种鱼,饲养于同一室内水泥池不同网箱中,网箱尺寸为1.0 m×1.0 m×1.2 m,3 个网箱并排为 1 组(即3 个试验重复),2 种鱼放养密度均为60 尾/网箱。各试验组投喂及日常管理方法一致。投喂频率和投喂时间见表1。饱食投喂粗蛋白≥40.0%的海水鱼配合饲料,饲料粒径大小依鱼体生长过程而调整。试验期间,水质因子采用在线探头监测,水温22~29 ℃,pH 值 7.5~8.2,盐度 2.9%~3.0%,ρ(氨氮)<0.2 mg/L。24 h 持续充气,水中 ρ(溶解氧)大于6.0 mg/L。每日换水1 次,日换水量为池水量的50%~80%,自然光照。
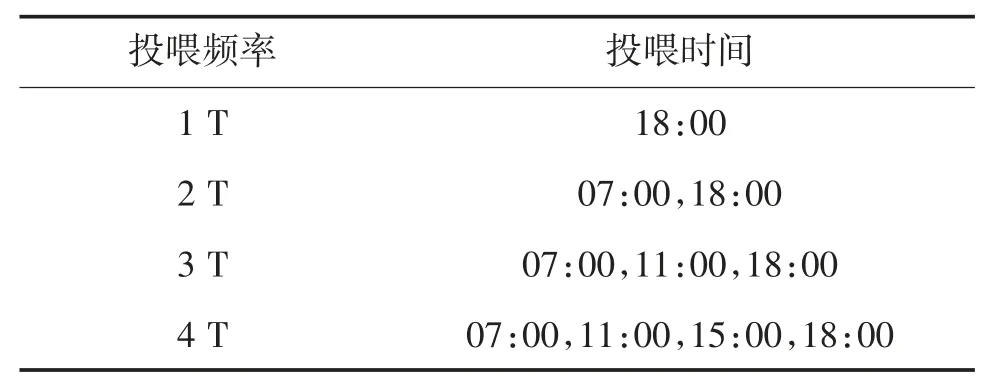
表1 杂交鲷及黑鲷的投喂频率和投喂时间
1.3 样品采集与指标测定
养殖40 d 后,试验鱼停止投喂24 h 后开始取样。取样时,从每个网箱里随机各抽取6 尾鱼,于鱼尾静脉取血,4 ℃冰箱静置 12 h 后,4 ℃、4 500 r/min离心20 min,取血清于-80 ℃保存备用;快速解剖,取肝脏、肌肉等组织速冻于液氮中,后置于-80 ℃冰箱冷冻保存。
1.3.1 体成分测定
取肌肉测定体成分。粗脂肪(crude fat, EE)、粗蛋白(crude protein, CP)、水分(moisture)、灰分(ash)等分别按《食品安全国家标准食品中脂肪的测定》(GB 5009.6—2016)《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5—2016)《食品安全国家标准食品中水分的测定》(GB 5009.3—2016)《食品安全国家标准食品中灰分的测定》(GB 5009.4—2016)进行测定。
1.3.2 血清生化指标测定
取血清测定血清生化指标。皮质醇(cortisol,COR)、总胆固醇(total-cholesterol, TC)、甘油三酯(triglyceride,TG)、总蛋白(total protein,TP)、溶菌酶(lysozyme,LZM)活性均采用南京建成生物工程研究所提供的试剂盒进行测定。
1.3.3 基因表达量测定
取肝脏组织用于测定相关基因表达量。使用Trizol 法提取杂交鲷及黑鲷肝脏组织总RNA,采用 PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa, #RR047A)反转录试剂盒合成cDNA,并置于-20 ℃保存待用。根据黑鲷基因组中的相关基因序列,应用Primer 5.0软件设计特异性引物,引物均由上海生工生物工程股份有限公司合成,序列见表2。采用SYBR Green 荧光嵌合法,利用BIO-RAD CFX ConnectTM荧光定量PCR 检测系统,进行实时荧光定量PCR扩增反应,反应程序为:95 ℃预变性3 min;循环条件:95 ℃变性 10 s,55 ℃退火 20 s,72 ℃延伸20 s,75 ℃最后延伸 5 s,共进行 40 个循环。反应完成后绘制熔解曲线,熔解反应条件为:65~95 ℃,每5 s 升温0.5 ℃。选取actin作为内参基因,对各组织样本进行标准化,采用2-ΔΔCt 法进行计算基因相对表达量。

表2 实时定量PCR 引物
1.4 数据统计与分析
应用Excel 2019 和SPSS.22 统计软件分析试验数据,结果以“平均值±标准误(mean±SE)”表示,差异显著(P<0.05)时,再采用Duncan 法,进行组间差异的多重比较。
2 结果与分析
2.1 杂交鲷及黑鲷体成分的变化差异
由体成分检测结果得出,同一投喂频率的2 种鱼的各个体成分指标均无显著差异(P>0.05),见表3。随着投喂频率的升高,杂交鲷和黑鲷的粗脂肪含量呈升高的趋势,且1 T 组显著低于4 T 组(P<0.05);而鱼体的水分含量呈降低的趋势,1 T 组显著高于4 T 组(P<0.05)。投喂频率对 2 种鱼的粗蛋白、灰分含量均无显著影响(P>0.05)。
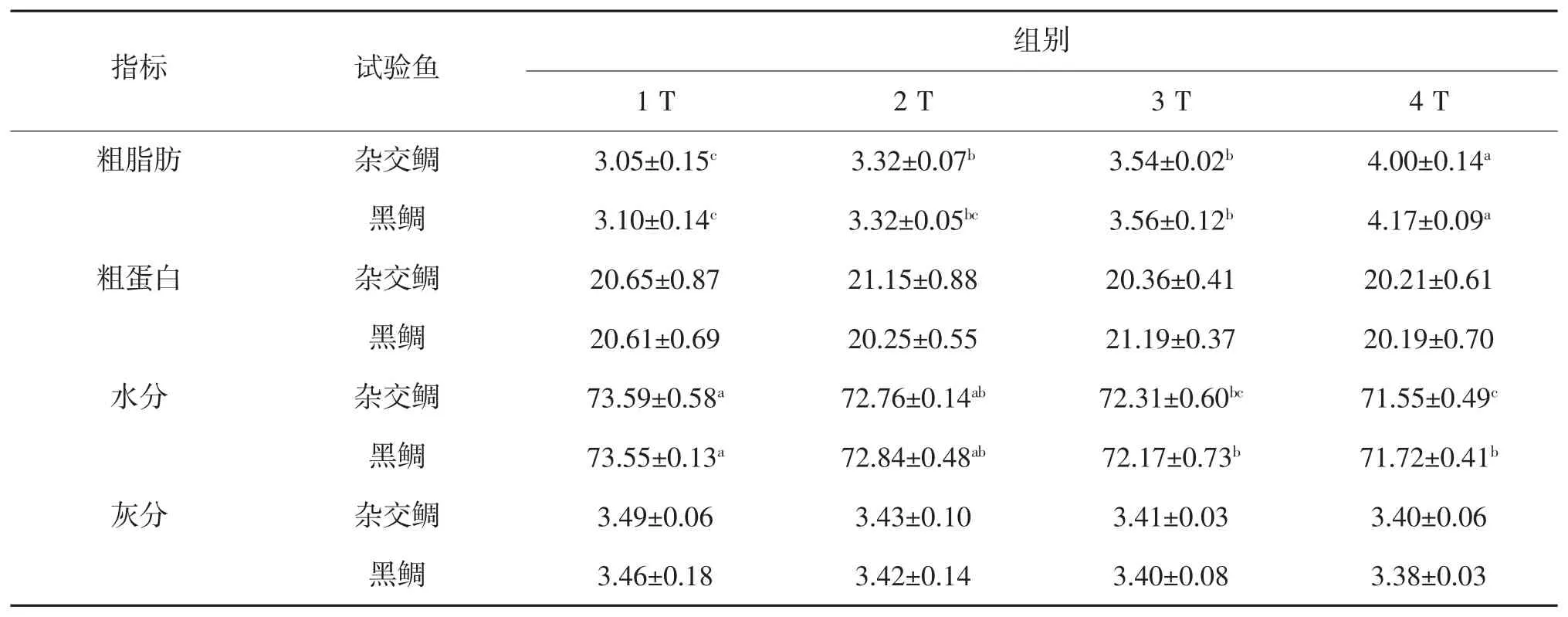
表3 不同投喂频率下杂交鲷及黑鲷体成分的变化差异① %
2.2 杂交鲷及黑鲷血清生化指标的变化差异
血清生化检测结果表明,随着投喂频率的升高,杂交鲷的TC 及黑鲷的TC、TG 含量也逐渐升高,1 T组显著低于 4 T 组(P<0.05),但与 2 T、3 T 组间无显著差异(P>0.05)。杂交鲷和黑鲷的TP 随着投喂频率的升高呈先升高后降低的趋势,2 T 组显著高于 4 T 组(P<0.05)。杂交鲷在 4 T 组的 TC、TG 含量显著低于黑鲷(P<0.05),见图1。此外,皮质醇和溶菌酶指标,不因鱼种及投喂频率的不同而变化。
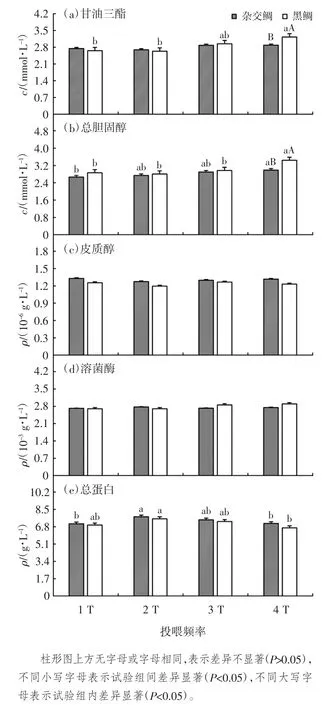
图1 不同投喂频率下杂交鲷及黑鲷血清生化指标的比较
2.3 杂交鲷及黑鲷相关基因表达量的变化差异
2 种鱼的相关基因表达水平受投喂频率不同程度的影响,不同投喂频率下杂交鲷及黑鲷相关基因相对表达量的比较见图2。由图2 可见,投喂频率从1 T升至3 T 时,杂交鲷及黑鲷的ghr 基因表达量显著降低(P<0.05);igf1 基因相对表达量显著升高(P<0.05),Cu/Zn sod 基因表达量无显著变化(P>0.05);lpl 基因表达量则呈先升高后降低的趋势,2 T 组显著高于1 T组和 3 T 组(P<0.05)。投喂频率从 3 T 升高至 4 T 时,ghr、igf1、lpl、Cu/Zn sod 基因表达量均无显著变化(P>0.05)。4 T 组 lpl、ghr 基因表达量显著低于 2 T 组,Cu/Zn sod 基因表达量显著高于2 T 组。此外,杂交鲷在2 T组的 igf1、lpl 基因表达量显著高于黑鲷(P<0.05),1 T组的 ghr 基因表达量显著低于黑鲷(P<0.05),4 T 组的Cu/Zn sod 基因表达量显著高于黑鲷(P<0.05)。
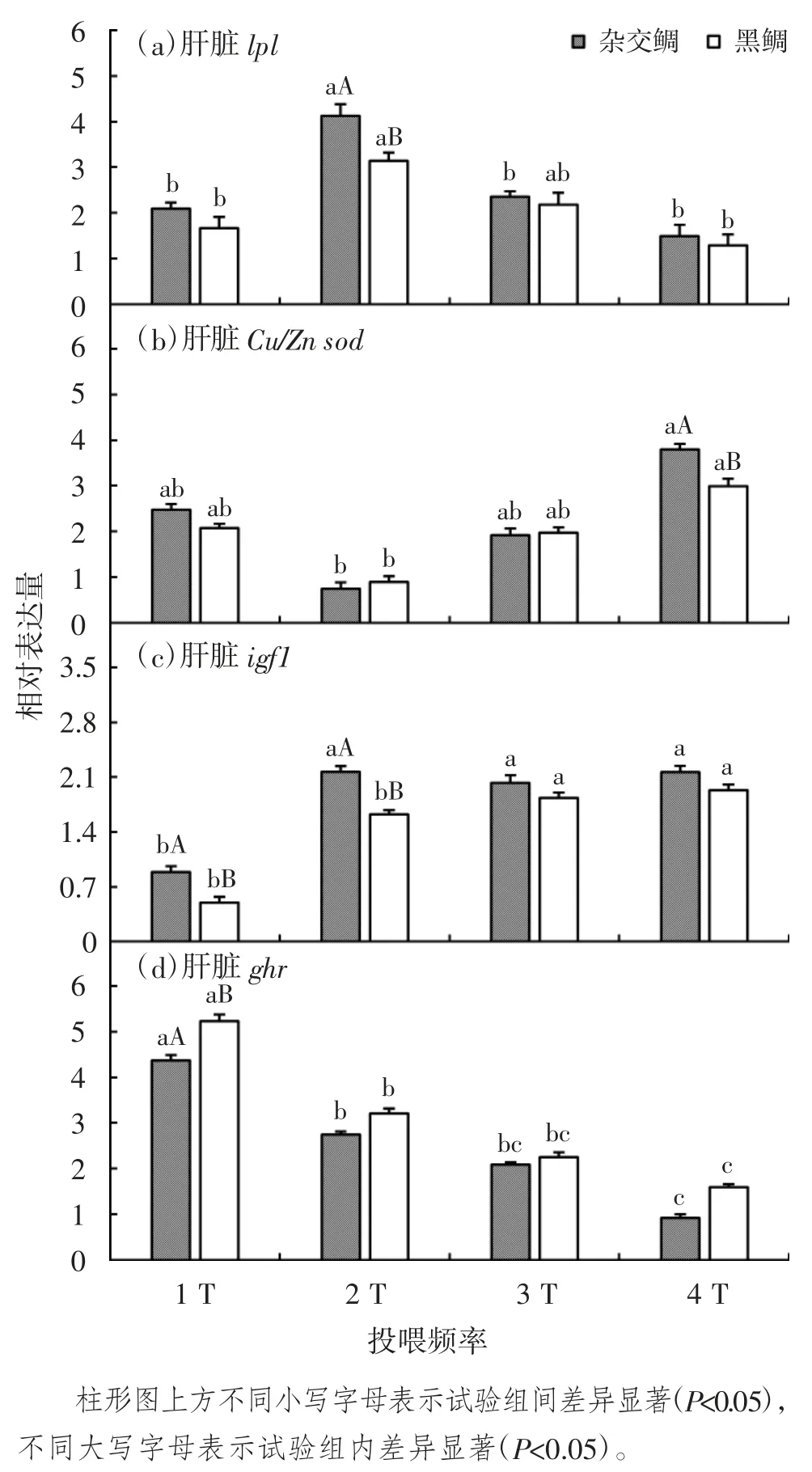
图2 不同投喂频率下杂交鲷及黑鲷相关基因相对表达量的比较
3 讨论
3.1 体成分检测结果
鱼体成分是被用来评估鱼体质量、评判投喂策略的标准之一[17]。该试验中,随着投喂频率的升高,杂交鲷和黑鲷的粗脂肪含量升高,水分含量降低。对大杂交鲟(Huso dauricus♀×Acipenser schrenckii♂)[18]、黄河鲤鱼(Cyprinus carpio)[19]、花羔红点鲑(Salvelinus malma)[20]等幼鱼的研究,也得到了相似的结果。这可能是因为增加投喂频率,鱼类的饲料摄食量增大,因此鱼体中转化储藏起来的脂肪含量也随之增大[21-22]。但鱼种或饲料成分等的不同,也存在不同的研究结果[23]。另外,投喂频率对2 种鱼的粗蛋白、灰分含量均无显著影响。文献[24-25]关于乌苏里拟鲿(Pseudobagrus ussuriensis)幼鱼、阴影施氏油鲶(Steindachneridion scriptum)幼鱼的研究结果与本试验结果相似。推测是蛋白质和灰分含量涉及鱼体组织功能,不易受投喂频率等外源因素的影响[26]。但也有研究认为,部分鱼类在饥饿状态下,优先利用脂类与糖原供能,蛋白质的消耗少,粗蛋白含量相对较高[27]。
3.2 血清生化指标
COR 是由肾上腺皮质分泌的一种“应激激素”,与鱼体的代谢、免疫功能有关,而LZM 是参与免疫、抗菌抗病的碱性酶[28-29]。本试验中,投喂频率对2 种鱼的 COR、LZM 含量无显著影响。文献[30-31]对大口黑鲈(Micropterus salmoides)、花鳗鲡(Anguilla marmorata)等的研究也有同样结果。推测投喂频率的改变对多数鱼类的免疫功能不会造成影响。但也有个别鱼类如团头鲂[10]、哲罗鱼(Hucho taimen)[32]等的COR 和LZM 活性,受到了投喂频率的显著影响,这可能是高摄食量对其产生了应激反应。而TP 含量是体现鱼体营养状况相关的重要指标[33]。投喂频率升高时,杂交鲷和黑鲷的TP 含量先升高后降低,且2 T 组显著高于4 T 组。文献[18]对研究的大杂交鲟TP 含量变化趋势与本试验相似,这或许是因为超出适宜范围的高投喂频率,影响到鱼体的营养吸收。而花鳗鲡的TP 含量不因投喂频率变化而发生改变,只与自身的合成代谢相关[31]。TC 和TG 含量与鱼体的脂代谢有关[34]。因此,随着投喂频率的升高,2 种鱼的TC 含量及黑鲷的TG 含量均呈显著升高趋势,这与文献[35-36]关于吉富罗非鱼(Oreochromis niloticus)、条纹锯(Centropristis striata)的研究结果一致。此外,4 T 组内杂交鲷的TC、TG 含量显著低于黑鲷。可见,在高投喂频率组中,黑鲷更容易在体内积累由多余的养分转化而成的脂肪。
3.3 不同基因表达水平
类胰岛素生长因子(igf1)的基因表达,受鱼类营养贫瘠状况的影响[37-38]。升高投喂频率到2 T,igf1 的表达水平随之升高。生长激素受体(ghr)是检验鱼类生长性能和生理状态的指标,其在细胞内的表达量对生长激素发挥作用有重要影响[39]。本试验中,在较低投喂频率下,2 种鱼的ghr 基因表达处于较高水平。其原因可能是投喂量较少时,鱼体通过自身调节,上调ghr 表达,以减少营养不足对生长性能的影响,ghr 表达量也随之升高[40]。此外,2 种鱼的igf1 与生长速率呈正相关,ghr 与生长速率呈负相关,对多数鱼的研究都得到了该结果[41]。而同一投喂频率下,杂交鲷ghr 表达量低于黑鲷,igf1 表达量高于黑鲷,这在一定程度上反映杂交鲷的生长速度或许比黑鲷更快。
鱼种的脂蛋白脂肪酶(LPL)和超氧化物歧化酶(SOD)的表达,亦受能量与营养的影响[42-43]。本试验中,日投喂1 次时,2 种鱼生长所需的营养不足,脂肪积累少,lpl 与Cu/Zn sod 基因表达均处于较低的水平;投喂2 次时,进食量加大,鱼体脂肪含量升高,LPL分解甘油三酯为机体供能,lpl 及Cu/Zn sod 基因表达均显著上调[44];投喂4 次时,鱼体脂代谢紊乱,胃肠负荷加大,加之摄食活动增加,lpl 消耗量上升,其表达量下降,而机体通过自我调节恢复平衡后,Cu/Zn sod表达量降低[45-46]。此外,杂交鲷2 T 组的lpl 基因与4 T组的Cu/Zn sod 基因表达量,均显著高于黑鲷,表明杂交鲷的脂代谢平衡能力与抗氧化能力优于黑鲷。
