产油单针藻的最适培养基筛选及产油特性提升
2022-11-30马思琦尹紫良林宜萌葛菁萍
马思琦,李 畅,樊 阳,孙 莹,尹紫良,林宜萌,葛菁萍
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150500;2黑龙江大学生命科学学院/黑龙江省普通高校微生物重点实验室,哈尔滨 150080)
0 引言
随着世界经济的迅速发展和世界人口的不断膨胀,人们对能源的需求量日益增加,有研究预计人类对能源的需求到2030年将会增加50%[1]。目前全球能源主要由化石能源如煤、石油、天然气等供应,化石能源属于不可再生能源,其储存量有限,无法满足人类对能源的长期使用需求。为缓解人类社会面临的能源危机,人们需要寻找清洁的可再生能源来代替化石能源的使用,生物柴油是一个可选择的替代方案。生物柴油即来源于生物体的燃料,其使用能够减少二氧化碳及碳氢化合物的排放,有利于减缓温室效应,但目前的生物柴油原料主要基于传统农业的食品及资源,如大豆油、玉米油等,这类生物柴油的生产需要占用大量耕地资源,产出效率低[2]。近年来,微藻作为第三代生物柴油的潜在生产者表现出诸多优势。微藻在代谢过程中能够将底物转化为三酰基甘油酯,用于生物柴油的生产[3-4]。微藻光合效率高,生长周期短,不与农作物争地。除了生产生物柴油外,微藻还能生产多不饱和脂肪酸、色素、抗氧化剂等高价值副产物[5-9]。
利用微藻生产生物柴油尚未实现产业化,主要障碍在于微藻生物柴油的生产成本较高。为了降低微藻产油成本,需要在开发新藻种、提高藻株产油潜能、采用新的培养技术、减少采收过程中的能源消耗等各环节加大研究力度[10]。在上述环节中,对藻株培养条件的探索与优化是分离新藻株后的必要流程。不同藻株在分离生境上的差异往往导致了其生理代谢特征的特殊性,进一步体现在藻株生长对培养基营养的独特需求上。因此,选择合适的培养基并对培养基中的重要成分做系统性优化是提升藻株产油指标的重要步骤,也是挖掘藻株产油潜能的最直接和有效的方法[11]。目前已有研究利用培养基筛选[12]及营养条件优化[13],显著提升微藻藻株的生物量及油脂含量。
本研究以前期分离自黑龙江省大庆地区盐碱湖泊的单针藻(Monoraphidium sp.)HDMA-11为供试藻株[14],筛选其适合生长及产油的培养基,并对其培养条件做了进一步的优化,以期进一步提升藻株的产油潜能,为进一步应用于生物柴油生产领域奠定基础。
1 材料与方法
1.1 供试藻株与培养基
1.1.1 供试藻株 供试藻株单针藻(Monoraphidium sp.)HDMA-11由黑龙江省普通高校微生物重点实验室保存。
1.1.2 培养基 培养基配方参照文献[12,15-16]。
1.2 试验方法
1.2.1 培养条件 以培养至对数生长末期的藻液作为种子液,以10%(v/v)的接种量接种于新鲜的培养基中,装液量200 mL/500 mL(三角瓶)。在光照摇床中,每天光照16 h、黑暗8 h培养,光照强度3000 lux,恒温25℃。每天以180 r/min转速振荡培养液3次,每次10 min,培养周期为6~22天。
1.2.2 藻株生长曲线的测定 利用光学显微镜及血球计数板来计算微藻细胞个体数,以培养时间为横轴,对应时间点的藻细胞密度为纵轴,绘制藻株生长曲线,用于藻株生长状况和生长速度的比较。
1.2.3 藻株生物量的测定 取稳定期的微藻培养液70 mL于已称重的100 mL的离心管中(W1),以转速3800 r/min离心20 min,倒去上清液,再以ddH2O洗涤2次后,分别离心并倒去上清液,将离心得到的微藻藻泥放在50℃的烘箱中烘干至恒重(W2)。藻细胞的生物量(DCW)的计算见公式(1)。
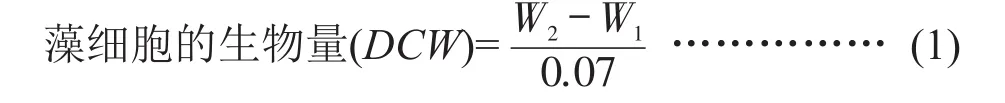
1.2.4 藻株油脂含量的测定 微藻油脂的含量利用尼罗红染色荧光光谱法测定,参照方法Greenspan等[17]的方法,在培养周期相应时间(T)取藻液,调整藻液OD680值为0.8。取调整OD值后藻液4 mL,加入1 mL DSMO,使用50 μL 100 μg/mL的尼罗红溶液对藻液染色5 min,使用荧光光度计测定相对荧光强度(Relative Fluorescence Units,RFU),激发波波长为480 nm,检测波波长为570 nm。油脂生产率的计算见公式(2)。
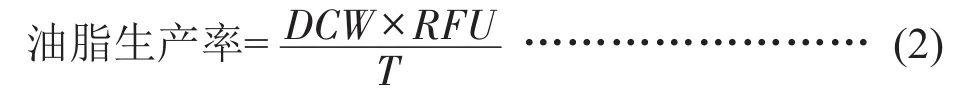
1.3 数据处理
使用SPSS软件(20.0版本)对数据进行统计分析。
2 结果与分析
2.1 培养基种类对HDMA-11生长速度的影响
使用培养微藻常用的培养基(BBM培养基、TAP培养基、D1培养基和SE培养基)对HDMA-11进行培养,以HDMA-11使用BG-11培养基的生长为参照,筛选适合HDMA-11生长的培养基。以培养天数为横坐标,藻液的细胞数为纵坐标绘制藻株的生长曲线(图1)。HDMA-11在这几种培养基中均可生长,未观察到明显的生长延滞期,但生长速度区别较大。在BBM培养基中,HDMA-11的生长情况与在BG-11培养基中类似,细胞数在培养过程中稳定增加,在培养末期细胞数达到8.0×107/mL,与在BG-11培养基中的细胞数(8.4×107/mL)相似。使用D1培养基、SE培养基时HDMA-11的生长较慢,培养末期细胞数仅为BG-11培养基中细胞数的一半。在TAP培养基中HDMA-11的生长最快,培养第6天即可达到稳定期,虽然HDMA-11在TAP培养基中生长至培养末期时,细胞数(6.5×107/mL)有所降低,略低于BG-11培养基中细胞数,但考虑到HDMA-11在TAP中生长时在较短时间内即可达到稳定期,极大缩短了培养周期,生长效率最高。

图1 Monoraphidium sp.HDMA-11在不同培养基中的生长曲线
2.2 培养基种类对HDMA-11生物量及含油量的影响
对于产油藻株来说,藻细胞的生物量、含油量是藻株产油能力的基础指标。本研究检测了HDMA-11在不同培养基中培养后期的生物量和油脂含量,结果如图2所示。在BG-11培养基中,HDMA-11可达到较高生物量,为(490±6)mg/L。在BBM培养基中,HDMA-11的生物量为(480±14)mg/L,与HDMA-11在BG-11培养基中的生物量相比差异不显著。在TAP培养基中,HDMA-11的生物量有所降低,为(301±4)mg/L。在D1培养基和SE培养基中,藻细胞的生物量较低,仅为226~230 mg/L。与生物量的差异相比,HDMA-11的油脂含量在BG-11、BBM和TAP培养基中没有显著差异。而在D1培养基和SE培养基中,HDMA-11的油脂含量较低。综合考虑HDMA-11在D1培养基和SE培养基中较慢的生长速度(图1)和较低的生物量和油脂含量(图2),D1培养基和SE培养基不适合该藻株的生长和产油。因为藻细胞在不同培养基中达到稳定期的培养天数不同,油脂生产率更能反应藻细胞的产油能力。计算后发现,虽然藻株在TAP培养基中生物量略有降低,但藻株在TAP培养基中生长速度快,同时油脂含量未下降,最终藻株在TAP培养基中的相对油脂生产率最高,达256 RFU/(L·d),比在BG-11培养基中的相对油脂生产率增加117%。因此,选择TAP培养基作为HDMA-11的培养基,进行进一步的生长优化。
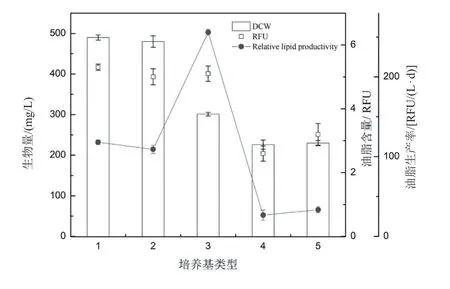
图2 Monoraphidium sp.HDMA-11在不同培养基中的生物量、油脂含量
2.3 碳源种类对HDMA-11生物量及含油量的影响
以TAP培养基为起始培养基,选择微藻培养常用的8种碳源(果糖、甘露醇、麦芽糖、乙酸、甘油、乙酸钠、葡萄糖和蔗糖),以培养期结束时HDMA-11的生物量和油脂含量为检测指标,检测HDMA-11可利用的碳源种类(图3)。HDMA-11几乎不能利用甘油生长,对甘露醇、乙酸钠和葡萄糖的利用效率也很低,只能达到79~130 mg/L的生物量。果糖或蔗糖作为碳源时,HDMA-11的生物量略有增加,达到222~230 mg/L。藻细胞利用麦芽糖生长时,生物量进一步增加至为294 mg/L。在检测的八种碳源中,乙酸为HDMA-11最适生长碳源,在培养周期结束时,HDMA-11的生物量为(351±19)mg/L(图3A)。进一步检测HDMA-11利用各碳源生长至稳定期的油脂含量,发现当以甘露醇、甘油、乙酸钠、葡萄糖或蔗糖为碳源时,藻细胞积累油脂的能力也受到了影响。果糖或乙酸作为碳源时,HDMA-11的油脂含量较高。考虑到乙酸作为碳源时更有利于HDMA-11生物量的积累,并综合考虑碳源成本和藻株生长状态,之后的实验均以乙酸作为HDMA-11培养的添加碳源。

图3 碳源种类对Monoraphidium sp.HDMA-11生物量(A)和油脂含量(B)的影响
2.4 氮源种类对HDMA-11生物量及含油量的影响
分别用硝酸铵、硝酸钠、氯化铵、蛋白胨、酵母提取物和尿素作为氮源,考察HDMA-11利用不同氮源的生长情况。以培养期结束时HDMA-11的生物量和油脂含量为检测指标,检测HDMA-11可利用的碳源种类。由图4A可知,6种氮源均可被HDMA-11利用,使用不同氮源所获得的最终生物量数值差异不显著。使用硝酸铵、硝酸钠和氯化铵作为氮源时HDMA-11的油脂相对含量高于使用蛋白胨、酵母提取物和尿素作为氮源时的水平(图4B)。从生长情况来看,使用氯化铵作为氮源时藻细胞生长的状态最好,藻液较绿,最终OD680达到了2.8(图5),因此之后的实验中选择氯化铵作为氮源。
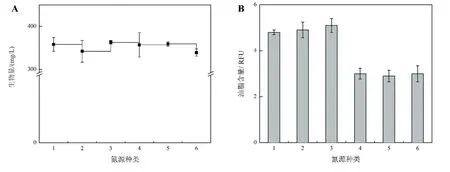
图4 氮源种类对Monoraphidium sp.HDMA-11生物量(A)和油脂含量(B)的影响
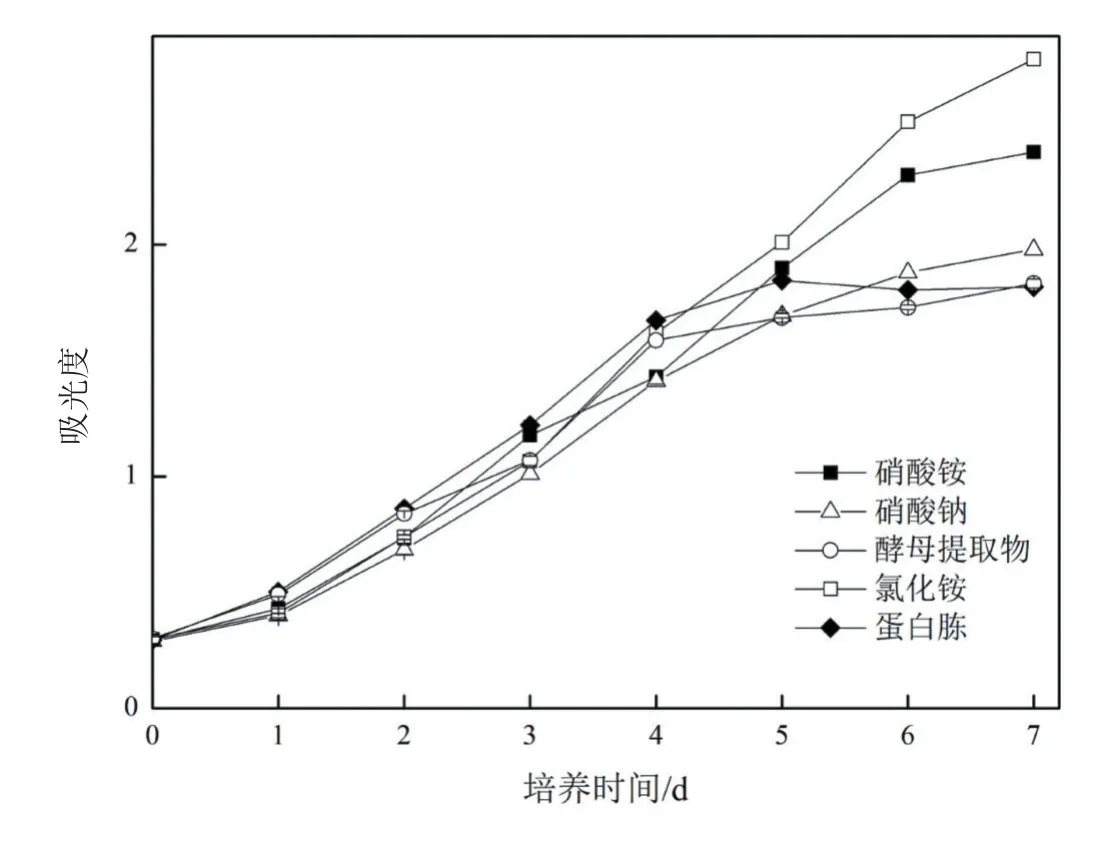
图5 氮源种类对Monoraphidium sp.HDMA-11生长中OD680的影响
2.5 乙酸添加量对HDMA-11生物量及含油量的影响
为了进一步优化HDMA-11的产油特性,检测了乙酸添加量对HDMA-11生物量及含油量的影响。设置了0、1、2、4、8 mL/L共5个乙酸添加量,为了避免乙酸对培养体系pH的影响,在加入乙酸后,将培养基初始pH统一调整为7.0。如图6A所示,当乙酸含量为0~2 mL/L,藻细胞的生物量随着乙酸增加而增加,最高生物量为(406±10)mg/L。但随着乙酸浓度进一步增加,藻细胞生长受到抑制,以8 mL/L乙酸对藻细胞的抑制作用最强。高浓度的乙酸极大影响藻细胞生物量的积累,在8 mL/L乙酸浓度下,HDMA-11的生物量仅为(126±6)mg/L。藻细胞的油脂积累特性也与乙酸浓度密切相关(图6B),不添加乙酸的实验组,油脂积累受到的影响最大,仅为1.3 RFU。1 mL/L乙酸和2 mL/L乙酸最有利于藻细胞的油脂积累,而较高浓度的乙酸(4~8 mL/L)不利于藻细胞产油。当乙酸浓度从1 mL/L升至2 mL/L,HDMA-11的生物量显著增加,油脂含量下降不显著,因此选择2 mL/L为本研究添加乙酸的浓度。
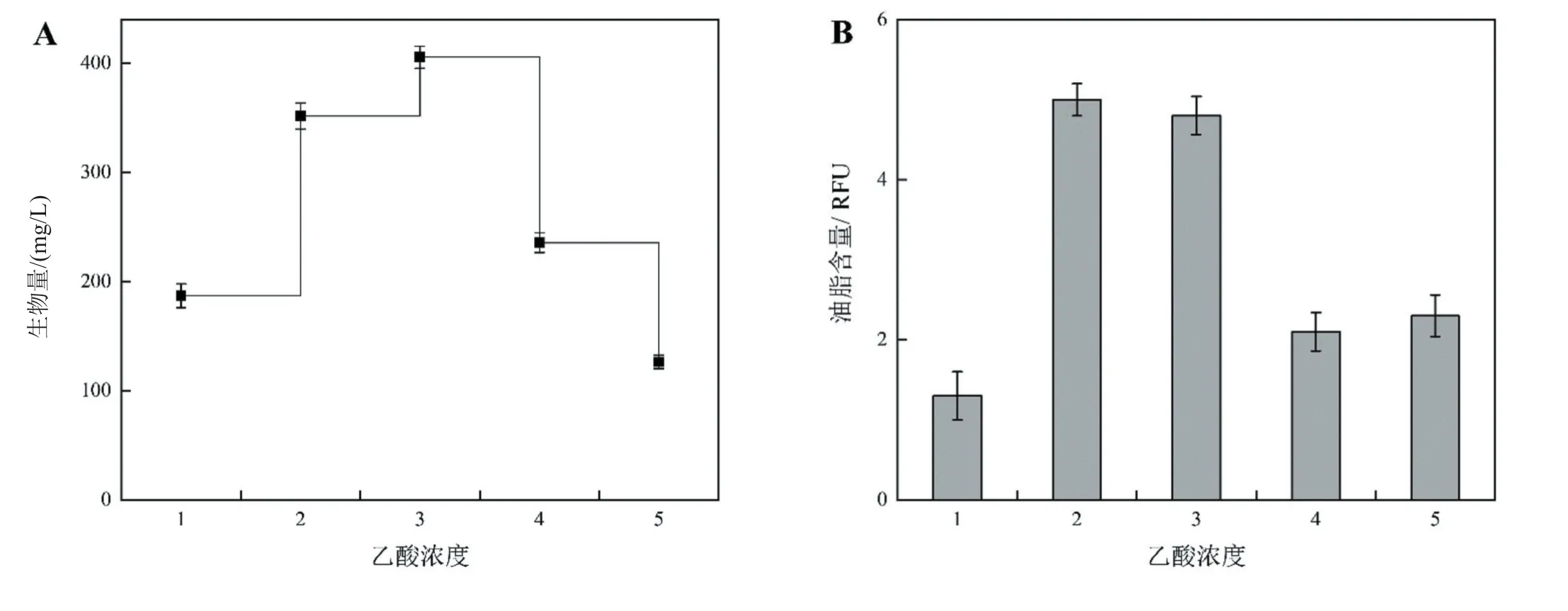
图6 乙酸浓度对Monoraphidium sp.HDMA-11生物量(A)和油脂含量(B)的影响
2.6 氯化铵浓度对HDMA-11生物量及含油量的影响
在优化乙酸添加量的基础上,进一步检测不同的氯化铵浓度(125、375、750、1500、3000 mg/L)对藻株HDMA-11生长的影响。在培养期结束后检测藻细胞的生物量和油脂含量,结果如图7所示。当氯化铵浓度在从125 mg/L升至750 mg/L时,藻细胞的生物量由350 mg/L增加至419 mg/L,但当氯化铵浓度进一步增加,藻细胞的生长受到抑制,生物量显著降低(图7A)。相比之下,藻株的含油量在不同氯化铵浓度下差异不显著。考虑到氯化铵对HDMA-11生物量的影响,将氯化铵浓度确定为750 mg/L。
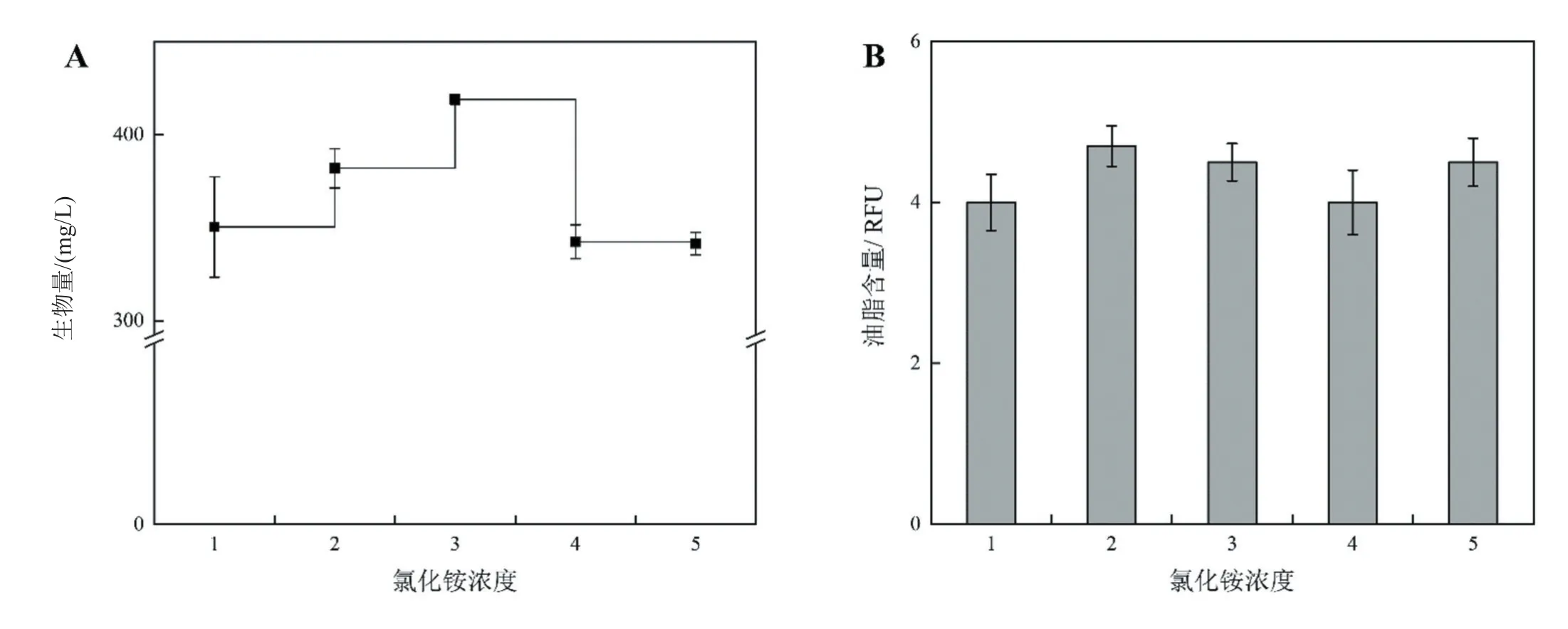
图7 氯化铵浓度对Monoraphidium sp.HDMA-11生物量(A)和油脂含量(B)的影响
经过了培养基的筛选和培养条件的优化,HDMA-11的产油指标提升情况见表1。将培养基由BG-11替换为TAP后,藻株生物量有所降低,但因培养周期极大缩短,藻株的生物量生产率提升了127%,油脂生产率提升了117%。又进一步对HDMA-11可利用的碳源种类、氮源种类进行摸索,优化了碳源添加量和氮源添加量,优化后的HDMA-11生物量生产率提升了40%,较本研究初始培养条件提升218%,优化后的HDMA-11油脂生产率提升23%,较本研究初始培养条件提升了116%。

表1 HDMA-11在优化培养条件前后的生物量、生物量生产率、油脂含量和油脂生产率
3 讨论
培养基是影响微藻类生长的重要因素。ZHAO等[12]研究了4种培养基对雨生红球藻(Haematococcus pluvialis)LUGU生长的影响,发现LUGU在BBM培养基中生长可获得较高生物量。对于单针藻M.sp.NTAI02来说,BG-11培养基并不适合它生长[18],而卷曲纤维藻(Ankistrodesmus falcatus)在BG-11培养基中的生长速度远超另外3种培养基[19]。对于不同的微藻藻种或者藻株来说,由于生理特性及利用营养素的效率不同,最适培养基可能非常不同。为了提升藻株的生长速度、生物量积累水平和产油效率,有必要筛选合适的培养基。以往研究对于单针藻的生理特性及适用培养基研究较为有限,本研究选择5种微藻常用的培养基,检测HDMA-11对这几种培养基的适用性(图1)及HDMA-11产油指标的变化(图2)。从达到稳定期的细胞数来看,使用BG-11和BBM培养基的结果较为类似,使用TAP培养基时藻株细胞数略低。但当藻株在TAP培养基中生长时,藻株可以在极短时间内达到稳定期,生长速度快,再结合生物量与油脂含量的指标,确定藻株使用TAP培养基兼具生长速度和产油效率的优势。TAP培养基常用于衣藻属(Chlamydomonas)藻株的培养,较少用于单针藻属的培养[20]。本研究供试藻株分离自大庆地区盐碱湖泊的特殊生境,它所适用培养基的特殊性也说明它在生理代谢上的特殊性。
碳源是微藻生长繁殖需要的重要物质,筛选适合且成本较低的碳源对于进一步降低微藻培养成本具有重要意义,对于新分离的藻株尤其如此。微藻常用碳源包括糖类、有机酸、醇类等。YEE[21]发现,Monoraphidium griffithii NS16可利用葡萄糖、果糖、麦芽糖、乙酸钠和甘露醇生长,其中0.05%的甘露醇和0.1%的果糖可使藻细胞生物量增加0.1~1倍。葡萄糖是微藻培养常用的碳源,但HDMA-11不能利用葡萄糖生长,向微藻培养体系中加入葡萄糖后,大部分藻细胞形态发生变化,不能正常生长繁殖。推测该藻株在进化过程中主要以自养方式生长,不能以葡萄糖代谢作为中心代谢途径,且葡萄糖的存在对藻细胞生长有一定的毒性作用。蔗糖在酸性条件下可水解为葡萄糖和果糖,麦芽糖在酸性条件下可水解为葡萄糖,考虑到本研究所用培养基的初始pH值为7.0,且微藻在培养过程中pH逐渐增加,未能达到蔗糖和麦芽糖的水解条件,这可能是HDMA-11在蔗糖或麦芽糖为碳源的培养基中生长状况优于葡萄糖为碳源培养基的原因之一。在碳源利用特征上,HDMA-11能够高效利用乙酸(图3),在一定浓度范围内增加乙酸添加量可促进藻株的生长,但当乙酸添加量高于4 mL/L,藻株的生长受到较大抑制(图6),且这种生长抑制与乙酸降低培养体系pH值并无关系。
本研究还筛选了HDMA-11可利用的氮源,发现该藻株可利用6种氮源,这其中包含了硝酸盐和铵盐(图4)。基于现有大部分研究,硝酸盐是单针藻属常用的氮源。Wu等曾检测Monoraphidium sp.SB2可利用的氮源种类,发现SB2利用硝酸钾的效率最高,可获得较高生物量[22]。而铵盐若浓度过高,可能导致植物光合作用的破坏[23-26],这可能是本研究中增加氯化铵浓度抑制HDMA-11生长的原因(图7)。本研究仅对HDMA-11的碳源种类、氮源种类做了初步探索,对HDMA-11的乙酸添加量和氯化铵浓度做了初步优化,后续工作将进一步检测环境条件如初始pH、培养温度对藻株产油指标的影响。另外,培养基中其他成分对藻株的影响也值得进一步探究,以进一步提升该藻株的产油能力。
4 结论
本研究以实验室前期分离的单针藻(Monoraphidium sp.)HDMA-11作为出发藻株,筛选其最适培养基并优化了培养基成分。当使用TAP培养基,乙酸添加量为2 mL/L,氯化铵浓度为750 mg/L时,藻株的产油性能最佳,生物量生产率和油脂生产率分别为70 mg/(L·d)和315 RFU/(L·d)。说明培养基类型及成分的优化可提升藻株产油指标,是改善藻株产油潜能的重要方法。
