甜菜热激蛋白基因BvHSP18.2的克隆和生物信息学分析
2022-11-30王锦霞孟诗琪钟鑫爱刘大丽
张 琼,王锦霞,3,孟诗琪,钟鑫爱,刘大丽,兴 旺
(1国家甜菜种质中期库,黑龙江大学,哈尔滨 150080;2黑龙江大学省高校甜菜遗传育种重点实验室/现代农业与生态环境学院,哈尔滨 150080;3黑龙江大学省高校生化与分子生物学重点实验室/生命科学学院,哈尔滨 150080)
0 引言
甜菜(Beta vulgaris L.)不仅是重要的经济作物,也是世界范围内常用的糖料作物之一,属二年生草本植物,作为一种喜温、耐寒、抗旱且耐盐碱的植物,在中国的黑龙江省、内蒙古自治区以及新疆维吾尔自治区种植较广。按其用途可以分为糖用甜菜、饲用甜菜和食用甜菜。糖用甜菜是一种制糖作物,通过榨取甜菜块根获取糖分;饲用甜菜营养丰富、适口性好,是饲喂家畜的优质多汁类饲料,合理饲喂可以提高动物的生产性能和繁殖性能[1]。食用甜菜多为营养丰富的红甜菜,其叶片中含有较多的纤维、钠、镁、类黄酮和较高的维生素C含量,而茎中的钾含量较高[2]。除此之外,甜菜还具有生产燃料乙醇、甜菜碱等功能,且成本低廉、能量效率化,可以成为规模化、工业化、商业化的优质原料。
伴侣蛋白,也称之为分子伴侣,是一类在序列上没有相关性但有共同功能的蛋白质,他们在细胞内帮助其他含有多肽的结构完成正确的组装。在植物生长发育过程中,蛋白质的合成和修饰导致近三分之一的新生蛋白质出现错误,特别是细胞内外的应激反应会导致错误折叠蛋白质数量的增加,从而使细胞器内的稳态失衡。植物遭受盐分、干旱之类的胁迫和病原体攻击等,都会引起细胞器的应激[3]。植物具有专门的应激反应或未折叠蛋白质反应(UPR)信号通路,以转录调节细胞器特异性分子伴侣,并减少驻留蛋白质折叠机制上的蛋白质折叠负荷[4]。如,为应对功能障碍,线粒体进化出了一种被称为线粒体未折叠蛋白反应(UPRmt)的应激机制,将线粒体蛋白质折叠环境的状态与线粒体伴侣基因的转录结合起来,引发伴侣基因的上调表达。其中mtHSP70和HSP60可以有效帮助线粒体蛋白的正确折叠,从而重建细胞内环境稳态[5]。内质网中出现蛋白质错误折叠时,UPR会诱导HSP40、ERdj3、DNAJB11和HSP70伴侣蛋白的表达,从而修复错误折叠的蛋白质[6]。
多项研究表明,热激蛋白家族(heat shock proteins,HSPs)是最为常见的分子伴侣之一,可作用于植物各个细胞器,多种应激反应及植物的不同发育阶段均有相应的表达。水稻在氧化应激下,HSP60的过量表达可以避免Fe/S酶释放Fe2+,保护其不被氧化,在植物抵抗氧胁迫机制中发挥重要作用[7]。HSP20以ATP依赖的方式阻止非天然蛋白质的聚集,并维持其稳定[8]。果实发育阶段的葡萄在H2O2胁迫下,HSP20表达下降,说明植物在发育阶段也可以诱导分子伴侣的表达,促进植物的种子萌发、胚胎发育等[9]。
热激蛋白,也叫热休克蛋白,是一类进化保守的多肽,从细菌到人体中均有表达[10]。热休克蛋白根据其分子量分为两类,即高分子量热休克蛋白(HSP100、HSP90、HSP70、HSP60和HSP40)和低分子量热休克蛋白(sHSP)[11]。热激蛋白最早在果蝇幼虫唾液腺染色体中发现,并在热激条件下表达[12]。TISSIERES等[13]通过设计对照试验并采用SDS凝胶电泳技术从果蝇的唾液腺中将这种蛋白分离出来,并命名为热激蛋白,也被称为热休克蛋白。到了1979年,科学家BARNETT等[14]在对烟草以及豌豆的组织培养细胞进行热激处理时,发现细胞内有表达模式类似动物热激蛋白的分子蛋白存在,为探究植物中的热激蛋白奠定了一定的基础。自此,热激蛋白的研究正式进入科研领域,随后越来越多的研究结果表明热激蛋白在高温、干旱、氧化、重金属等逆境下均能大量表达[15]。sHSP作为热激蛋白家族中最重要的成员之一,广泛参与生物体应激反应[16]。sHSP蛋白的特征是具有一条小的多肽链(16 k~42 kD),序列包括保守的C端结构域和差异性较大的N端,C端大约含有90个氨基酸,又称α-晶体蛋白域(alpha crystallin domain,ACD),这一α-晶体蛋白是小分子热激蛋白发挥分子伴侣作用的关键[17];根据N端氨基酸序列及胞内定位可分为6个亚族,其中classI、classII和classIII可定位于细胞质和细胞核,其余3个亚族定位于质体、内质网和线粒体[18]。
近年来,由于全基因组序列测序的完成,已从多种植物中鉴定出小分子热激蛋白,如拟南芥[19]、番茄[20]、水稻[21]和大豆[22],但关于BvHSP18.2的报道较少。因此,本实验试图通过克隆BvHSP18.2,并对其进行了相应的生物信息学分析,进一步推测BvHSP18.2基因的生物学功能,为之后进行甜菜小分子热激蛋白的功能分析奠定了一定的基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 甜菜品种为‘780016B/12优’,由国家甜菜种质资源中期库提供。
1.1.2 引物序列 根据甜菜BvHSP18.2基因(LOC104 903994)的碱基序列设计相应的上下游扩增引物。
上游:5’-ATGTCGCTAATTCCAAGCTT-3’;
下游:5’-TTAAGCAGAGATATCAATAGACTTG ACTTC-3’。
1.2 试验方法
1.2.1 总RNA的提取 取1 g甜菜叶片,置于已通过液氮充分预冷的研钵中,快速研磨,待研至粉末状后使用Easypure Plant RNA Kit(TransGen)提 取 总 RNA。1.0%的琼脂糖凝胶电泳检测所提取RNA的质量,通过超微量分光光度计测定RNA的浓度和纯度。
1.2.2 BvHSP18.2基因的克隆 取1µg总RNA,以其为模板,利用TransScript ONE-Step gDNA Removal RNA反转录试剂盒反转录成cDNA(反转录条件为30℃,10 min;42℃,30 min;99℃,5 min;4℃保存)。以cDNA为模板,利用BvHSP18.2基因的碱基序列设计上下游引物并进行PCR扩增,通过反应的条件为94℃,2 min;94℃,30 s;55℃,35 s;72℃,1 min;72℃,10 min;共30个循环。
扩增产物用1%琼脂糖凝胶电泳检测,并进一步确定其浓度及纯度。按照BvHSP18.2:pEASY-Blunt=2:1的摩尔比构成的反应体系,在25℃下连接,将目的基因连接到pEASY-Blunt载体上,并将连接产物转化到大肠杆菌感受态细胞Trans-T1中。利用X-gal以及Amp双重筛选出阳性重组子。挑选阳性克隆提质粒,利用BamHI和XhoI进行限制性内切酶酶切鉴定。酶切鉴定的阳性结果送上海生工进行测序鉴定,进一步确定其正确性。
1.2.3 BvHSP18.2基因的生物信息学分析 利用NCBI网站中的ORF Finder、Blastp分别进行开放阅读框及编码氨基酸分析及BvHSP18.2基因同源序列搜索。利用GSDS2.0分析BvHSP18.2基因外显子和内含子结构。利用ProtParam tool、ProtScale分析BvHSP18.2的分子量、等电点等相关理化性质及亲疏水性。利用SOPMA、SWISS-MODEL分别对BvHSP18.2蛋白质的二级、三级结构进行预测。利用SignalP-5.0 Server、TMpred预测BvHSP18.2信号肽的位置及跨膜结构域。
利用NetPhos 3.1 server、Cell-PLoc2.0预测该蛋白的磷酸化位点及进行亚细胞定位预测。整合BvHSP18.2的多序列比对结果,并利用MEGA11进行系统进化树的构建。利用PlantCARE在线工具分析该基因启动子区的顺式作用元件。
2 结果与分析
2.1 甜菜BvHSP18.2基因的克隆
利用TRIZOL法提取甜菜叶片总RNA,经1.0%琼脂糖凝胶电泳验证,28 S rRNA的亮度与宽度为18 S rRNA的两倍左右(图1A),说明提取的RNA较完整。以此RNA反转录的cDNA为模板,通过RT-PCR扩增得到目的基因BvHSP18.2。取2µL PCR产物加6×loading buffer,经1.0%的琼脂糖凝胶电泳检测(图1B),结果表明:该扩增片段与Genbank中的目的基因大小一致的位置上,且无杂质拖带现象,特异性扩增效果较好。
将目的基因BvHSP18.2的扩增片段与克隆载体pEASY-Blunt连接并获取质粒后,用BamHI与XhoI这两种限制性内切酶进行双酶切鉴定,其酶切产物经1.0%的琼脂糖凝胶电泳检测,在载体(3963 bp)和目的基因(962 bp)响应的位置出现了条带(图1C)。阳性质粒pEASY-Blunt-BvHSP18.2进一步测序,确定了重组质粒的正确性。
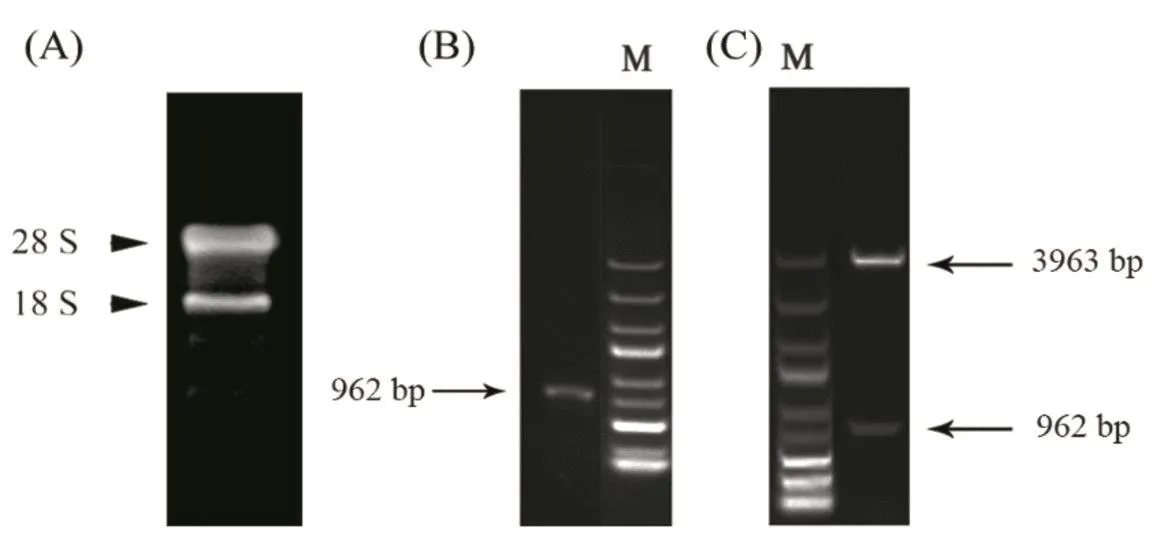
图1 甜菜BvHSP18.2基因的克隆
2.2 BvHSP18.2基因结构特征分析及其编码蛋白的理化性质分析
ORF Finder分析结果显示,BvHSP18.2基因序列全长为962 bp,编码区长度477 bp,共编码158个氨基酸。BvHSP18.2基因为正向序列,位于2号染色体上,含有1个外显子,不含内显子。
运用ProtParam可以计算蛋白质的理化性质,包括分子量、理论等电点、氨基酸组成、原子组成、消光系数、体内半衰期、不稳定指数、脂肪指数和总平均亲水性等。BvHSP18.2蛋白分子式为C928H1466N266O284S6、分子量为21085.82 Da;理论等电点(Theoretical pI)为6.99,数值接近7,推测其为中性蛋白;不稳定系数为59.86,数值大于40,推测其为不稳定性蛋白;X消光系数为0.783;其半衰期在酵母体内大于20 h,大肠杆菌体内大于10 h;脂肪指数(Aliphatic index)为65.14;平均亲/疏水系数为-0.906,推测其为亲水蛋白。
2.3 BvHSP18.2的二、三级结构预测
SOPMA预测的二级结构显示,BvHSP18.2蛋白的组成包含20.99%的α-螺旋,16.57%的延伸链,4.97%的β-转角和57.46%的无规则卷曲,因此α-螺旋和无规则卷曲为该蛋白二级结构的主要元件。
为了验证上述BvHSP18.2二级结构预测的结果,利用SWISS-MODEL软件对BvHSP18.2蛋白三级结构进行建模(图2),从图中可以得知BvHSP18.2的主要结构为α-螺旋和无规则卷曲,与上述的二级结构预测结果相符。
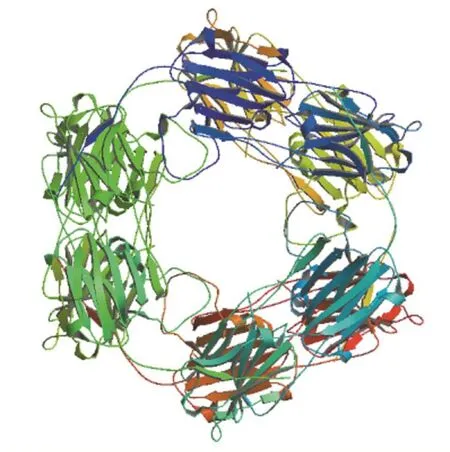
图2 BvHSP18.2的三级结构预测
2.4 BvHSP18.2的亲/疏水性、信号肽、跨膜结构域、磷酸化位点以及亚细胞定位预测
通过分析蛋白质序列的亲疏水性轮廓,可以得到蛋白质的抗原表位分析,同时也可以分析蛋白质的折叠情况。如图3所示,BvHSP18.2在118、119位点亲水性最强,为-3.767,在第27位疏水性最强,数值为1.322;且整体亲水性位点多于疏水性位点,因此亲/疏水性预测结果表明该蛋白为亲水蛋白。该蛋白无信号肽,不存在跨膜区域。NetPhos3.1Server磷酸化位点预测BvHSP18.2结果表明,该蛋白共有13个磷酸化位点,10个丝氨酸磷酸化位点,3个苏氨酸磷酸化位点。使用Cell-PLoc2.0对甜菜BvHSP18.2进行亚细胞定位预测,结果显示其生命活动的主要场所在细胞质。

图3 BvHSP18.2亲/疏水性预测
2.5 BvHSP18.2的多序列比对及系统发育分析、进化树分析
多序列比对可以分析和确定目的基因的氨基酸序列中是否含有重要的功能位点。在NCBI数据库中进行BLASTp同源检索发现,BvHSP18.2的氨基酸序列与其他12种植物,分别是菠菜(Spinacea oleracea L.)、藜 麦 (Chenopodium quinoa W.)、冬 瓜 (Benincasa hispida(Thunb.)Cogn.)、甘薯(Ipomoea triloba(Lour.)Burkill.)、烟 草 (Nicotiana attenuata L.)、西 葫 芦(Cucurbita pepo subsp.Pepo L.)、黄瓜(Cucumis sativus L.)、甜 瓜 (Cucumis melo L.)、苦 瓜 (Momordica charantia L.)、芙 蕖 (Nelumbo nucifera G.)、笋 瓜(Cucurbita Maxima D.)、油 橄 榄 (Olea europaea var.Sylvestris L.)的序列同源性较高(图4)。

图4 BvHSP18.2的多序列比对
利用MEGA11,采用最大似然法进一步分析甜菜BvHSP18.2的进化关系。通过比对可以发现甜菜BvHSP18.2与藜科的藜麦CqHSP17.8、菠菜SoHSP17.8的亲缘关系最为相近(图5)。与上述氨基酸序列同源性分析结果一致。
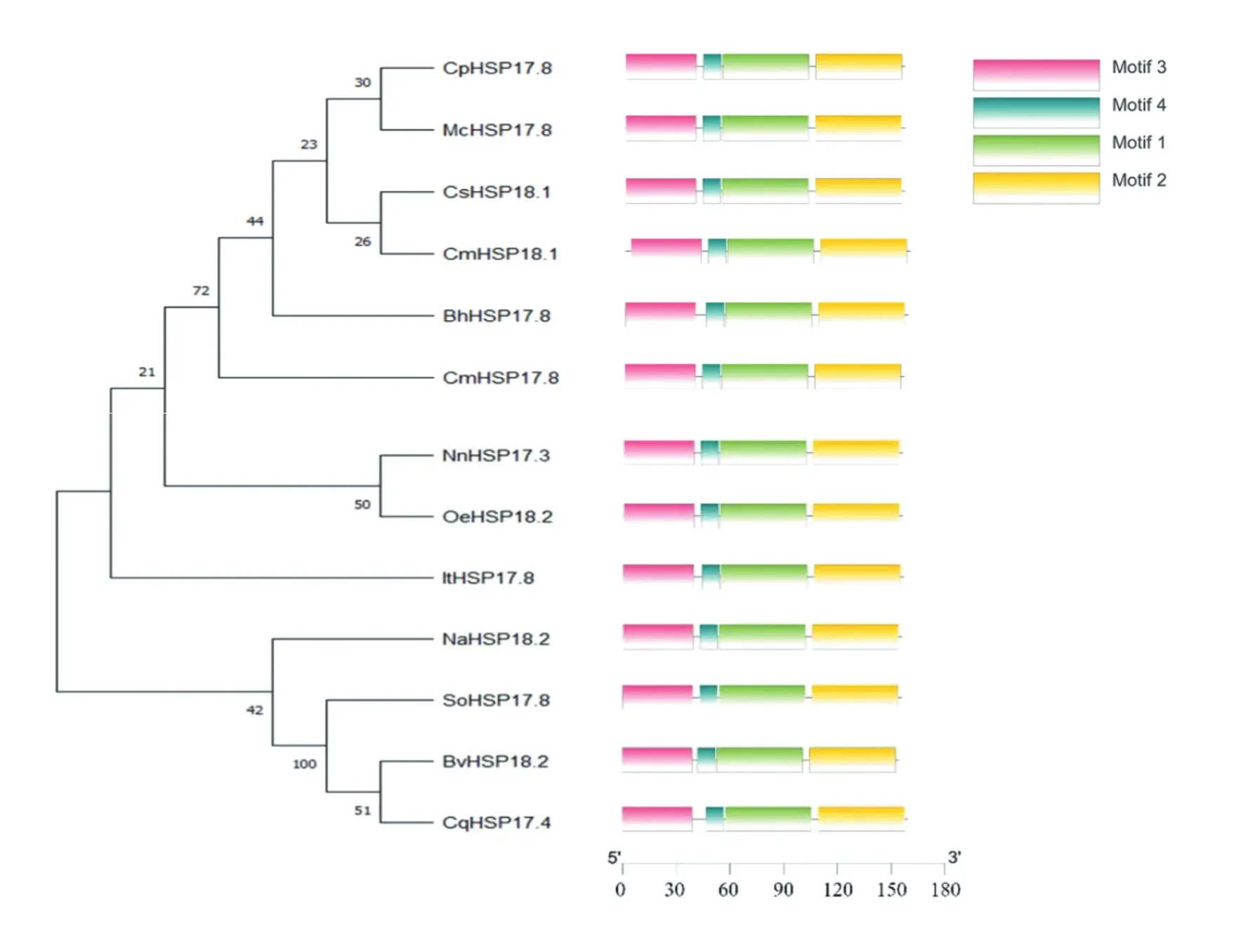
图5 BvHSP18.2系统发育进化树
2.6 BvHSP18.2基因启动子区的顺式作用元件分析
为探究BvHSP18.2基因的调控机制,通过NCBI获取该基因起始密码子上游2000 bp的启动子区域,通过PlantCARE来预测其顺式作用元件。预测结果显示(表1),该基因上游调控序列中含有36个CAAT-box和34个TATA box,说明该区域是典型的真核生物核心启动子元件,且该启动子的转录活性较高。同时启动子顺式作用元件分析结果显示BvHSP18.2与光响应相关的作用元件,如:AE-Box、AT1-motif、ERE、GT1-motif、TCCC-motif和TCT-motif等;同时还具有与MYB结合元件,可参与水杨酸和防御和应激反应等。

表1 BvHSP18.2基因启动子区顺式作用元件分析
3 讨论
本研究从甜菜体内克隆获得小分子热激蛋白BvHSP18.2,其氨基酸大小为20.1 kDa,与GenBank数据大小一致,且该基因无内含子。前人在对水稻、拟南芥的RNA进行序列分析时发现,无内含子的基因在干旱胁迫、盐胁迫中更敏感,且有可能参与到植物的表观遗传和发育过程[23]。BvHSP18.2不稳定系数为59.86,数值大于40,推测其为不稳定性蛋白,而不稳定性被认为是应激蛋白共同的特征,也可反映BvHSP18.2基因的快速诱导特性。亚细胞定位预测显示BvHSP18.2主要在细胞质中行使其功能,与孙爱清等[24]通过试验分析出的玉米ZmHSP17.7定位一致,但蓝莓VcHSP17.7经亚细胞定位预测位于细胞核[25],甘蔗SoHSP20位于叶绿体[26],黄瓜CsHSP20位于线粒体[27]。
BvHSP18.2与其他sHSP的多序列比对结果表明,该基因具有高保守的ACD结构域,与番茄、拟南芥等多种植物的sHSP的相关报道具有一致性。ACD结构域可能与一种多聚复合物的形成相关,这些复合物被认为与sHSP的分子伴侣活性具有重要的关系[28]。系统进化树的分析结果显示,BvHSP18.2与藜科植物的亲缘关系更为亲近,藜麦[29]、菠菜[30]的热休克蛋白在热处理过程中都表现出显著的上调,推测BvHSP18.2可能在植物遭受热胁迫过程中发挥着重要作用。
sHSP基因家族在调节植物生长发育和胁迫反应中起着重要作用。至今,已在多种植物中成功扩增获得sHSP基因,如拟南芥中存在有19个小分子热激蛋白基因,水稻基因组中则有23个小分子热激蛋白基因。sHSP基因可作用于植物生长的各个时期以及不同的环境胁迫中[31],如,在热胁迫、盐胁迫和干旱等非生物胁迫条件下,马铃薯sHSP基因亚家族表现出异质性表达模式[32];在盐胁迫中sHSP基因也表现出了一定的作用,位于紫花苜蓿线粒体中的小分子热激蛋白基因(MsHSP23)在真核和原核模型系统中的过度表达增强了紫花苜蓿对盐和砷胁迫的耐受性[33];玉米ZmHSP17.7基因可受高温快速诱导[24];在番茄不同发育阶段sHSP基因均发挥作用,尤其番茄小分子热激蛋白(SlsHSP)在生殖器官中的表达要大于在营养器官[34]。根据以上报道,笔者发现sHSP基因家族在非生物胁迫中发挥关键的作用。而本研究通过对BvHSP18.2的理化性质、系统进化、顺式作用元件等分析,发现该基因可能参与甜菜生长发育的调控和胁迫等应激反应。
为了进一步明确BvHSP18.2基因的生物学功能,根据本文的研究结果,可进一步体内体外验证和探究BvHSP18.2在非生物逆境胁迫下的表达及在甜菜生长发育过程中的作用。研究结果也将为利用现代生物技术进行种质资源的优化提供优良基因。
4 结论
本研究成功扩增得到了甜菜热休克蛋白BvHSP18.2基因的序列全长为962 bp,编码区长度477 bp,编码158个氨基酸。通过对BvHSP18.2基因启动子进行顺式作用元件的分析,BvHSP18.2包含植物激素反应、非生物和生物胁迫反应以及与植物发育相关的顺式元件,可以参与众多生物过程。该基因的克隆为下一步深入细致研究BvHSP18.2在甜菜生长发育过程中发挥的作用及在非生物逆境胁迫下的表达特性奠定了基础。
