尿素深施后模拟水田系统中氮素的迁移转化途径
2022-11-30朱静平邓秋宏
朱静平,邓秋宏
(1西南科技大学环境与资源学院,四川 绵阳 621000;2低成本废水处理技术四川省国际科技合作基地,四川 绵阳 621000)
0 引言
氮是植物需求量最大的矿质营养元素。为提高作物产量,人类在农业生产中大量施用氮肥。其中,中国氮肥生产以尿素为主,尿素施用量占农用氮肥总施用量的50%以上[1]。然而目前的研究表明,尿素施入土壤后,仅有20%~35%能被作物吸收利用[2],剩余尿素则在土壤、大气、水体以及生物等环境体系中迁移转化、循环滞留,导致中国土壤酸化、水体富营养化等环境问题突出[3]。目前水田中土壤氮素迁移转化过程的研究主要集中于降雨[4-5]、灌溉[6-7]以及排水[8]等对氮素迁移转化产生的影响。而针对水田中氮肥施入土壤后土-水系统具体发生的反应以及氮素迁移转化过程研究较少。
本研究以西南科技大学水稻试验基地的稻田土作为研究对象,通过室内模拟装置模拟水田,探究尿素深施入土壤后氮素在土-水系统中的迁移转化途径,旨在为探明水田系统中的氮素迁移转化规律提供参考。
1 材料与方法
1.1 试验装置及材料
模拟装置:试验采用高50 cm、上口内径45 cm、下口内径39 cm的塑料桶体装填土壤模拟水田,并在桶体上方搭建雨棚以减少外界降雨对试验的干扰;共设置2套模拟装置。
供试土壤:取自西南科技大学水稻试验基地的紫色土,土壤的理化指标如表1所示。
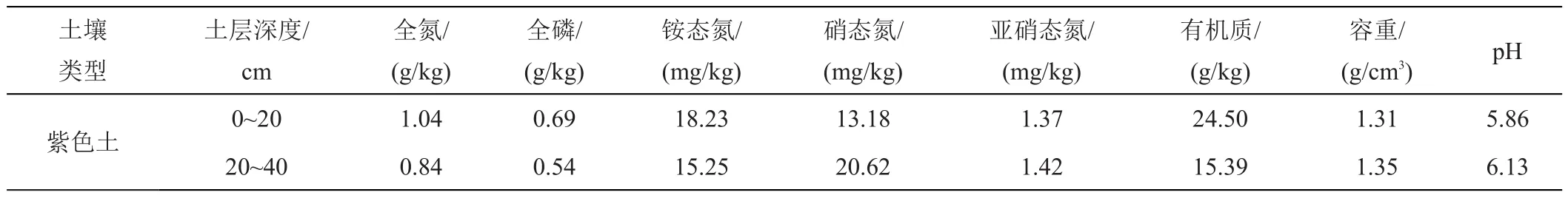
表1 原状土土壤理化指标
1.2 试验设计与方法
填充土壤:填充用的土壤经过风干过筛,并按照大田原状土容重分层(0~20、20~40 cm)回填至各模拟装置中。其中每套装置0~20 cm共填充土体约39 kg,20~40 cm共填充土体约42 kg。每套模拟装置填充完土壤后,缓慢灌水至土体湿润并达到水分饱和,持续一个月使土体自然沉降并恢复至田间状态。
施肥量:参照当地水稻常规施肥量,氮肥施用量为150 kg/hm(2以纯N计)。根据所施尿素纯N含量及每套装置填充土壤的表面面积0.138 m2可计算出,尿素施用量为4460 mg。2套模拟装置中1套施肥处理,另1套作为空白对照组(CK),即不施肥处理。
施肥方式及水分管理:施肥方式采用尿素深施方式(0~20 cm),先将尿素一次性均匀施入0~20 cm土层后,再缓慢灌水至土壤表层水深5 cm。实验过程中定期补水以维持土壤表层水深5 cm,表层水体积约为8 L。
在施肥后第1~15天内,每天直接测定表层水中的pH、水温、溶解氧,并取样测定氮素浓度,同时每隔2天取样测定氨挥发量。在实验结束后分层(0~20、20~40 cm)取样测定土壤中全氮、硝态氮、铵态氮和亚硝态氮的含量。通过分析表层水和土壤中各指标值的变化,探明尿素深施方式下系统中氮素的迁移转化情况。试验在四川省西南科技大学水处理与污染控制中心实践教学基地,于2021年8—9月进行。
1.3 分析项目与测定方法
水样样品测定方法:pH采用pHS-320型酸度计测定;DO采用雷磁便携式溶解氧测定仪测定;NH4+-N的测定采用纳氏试剂分光光度法[9];NO3--N的测定采用紫外分光光度法[9];TN的测定采用碱性过硫酸钾消解紫外分光光度法[9]。
土壤样品测定方法[10]:土壤全氮的测定采用半微量开氏法;土壤铵态氮的测定采用KCl浸提-靛酚蓝比色法;土壤硝态氮的测定采用紫外分光光度法;土壤亚硝态氮的测定采用磺胺/盐酸萘乙二胺-分光光度法。
氨挥发测定方法:采用通气式氨挥发测定法[11]。通气装置由内径16 cm、高10 cm的聚氯乙烯硬质塑料管制成,测定过程中分别将2块厚度为2 cm、直径16 cm的海绵均匀浸入20 mL磷酸甘油混合液并固定于管内,下层海绵置于距管底5 cm处,上层海绵与管顶部相平。
2 结果与分析
2.1 土-水系统中氮素损失量
尿素深施方式下,在15天的试验期间,2套模拟装置土壤表层水中各氮素浓度及施肥装置表层水pH随时间的变化如图1所示;实验期间施肥装置表层水水温及溶解氧浓度变化见图2。
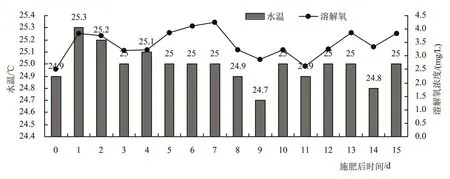
图2 表层水温度及溶解氧浓度随时间的变化
结合试验前后表层水、土壤中氮素的含量变化,可初步对土-水系统中的氮素损失量进行估算。
2.1.1 施肥前后表层水中氮素变化量
(1)NH4+-N。当尿素施入土壤后,在脲酶的作用下发生水解反应,NH4+是尿素水解的直接反应产物。由图1可知,施肥后第15天表层水中NH4+-N浓度为24.03 mg/L,相较施肥前表层水中NH4+-N浓度1.02 mg/L增加了23.01 mg/L。
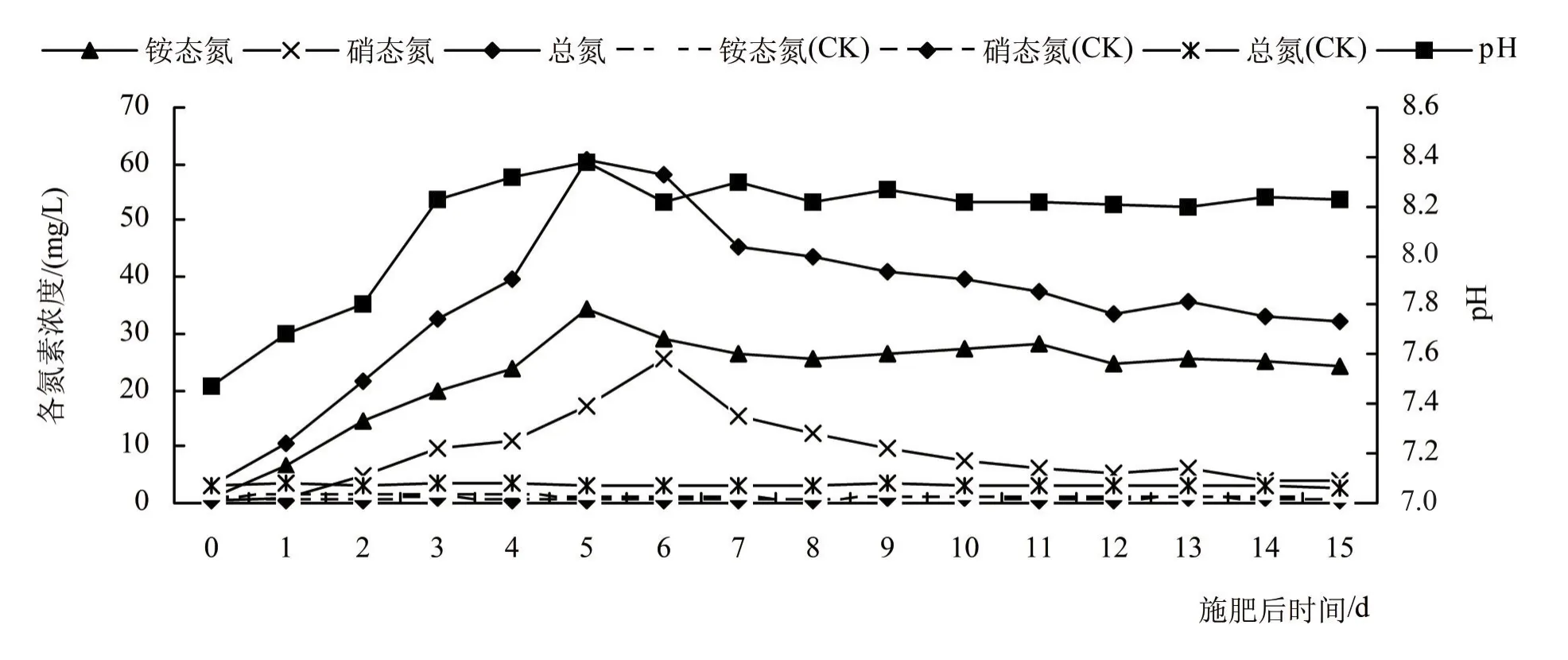
图1 表层水中氮素浓度及pH随时间的变化
(2)NO2--N、NO3--N。NO2--N、NO3--N主要来源于NH4+-N的硝化作用[12]。硝化作用主要由两类菌完成:氨氧化菌将NH4+-N转化成NO2--N,亚硝酸盐氧化菌再将NO2--N转化成NO3--N[13]。这2种菌对pH的变化十分敏感,氨氧化菌和亚硝酸盐氧化菌的适宜pH分别为pH 7.0~8.5和pH 6.0~7.5[14]。由图1中pH的变化可以看出,试验研究过程中表层水始终维持在pH 7.47~8.38,该pH范围有利于氨氧化菌生长以及亚硝化反应的发生,从而促进了NH4+-N向NO2--N的转化。
然而,NO2--N作为硝化反应的中间产物十分不稳定,极易被氧化为NO3--N[15]。于德爽等[16]的研究表明,NO2--N适宜存在的溶解氧浓度范围为0.50~1.00 mg/L;同时,李东等[17]的研究结果证实,当DO提高至1.42~1.51 mg/L时,亚硝化率下降约76%,水溶液中NO3--N浓度也明显增加。由图2可知,试验研究过程中表层水中溶解氧浓度维持在1.33~3.44 mg/L,有利于NO2--N向NO3--N进行转化,不利于表层水中NO2--N的积累。
此外,研究表明,氨氧化菌适宜温度为30~35℃[18],而亚硝酸盐氧化菌的适宜温度为25~30℃[19]。从图2中水温变化可以看出,试验研究过程中水温维持在24.7~25.3℃之间,该温度条件更有利于亚硝酸盐氧化菌的生长。
综上分析可知,整个试验研究过程中,表层水系统中的温度和溶解氧条件不利于NO2--N积累,故可忽略表层水中NO2--N积累量。由图1可知,施肥后第15天表层水中NO3--N浓度为3.90 mg/L,相较施肥前表层水中NO3--N浓度0.372 mg/L增加了3.53 mg/L。
(3)有机氮。表层水中的TN主要包括无机氮和有机氮2种氮素形态,其中无机氮主要包括NH4+-N、NO2--N和NO3--N。由上述分析可知,表层水系统中NO2--N积累量可忽略不计,故根据表层水中的TN、NH4+-N和NO3--N含量即可估算出表层水中有机氮的含量。
通过计算可知,施肥前(第0天)表层水中有机氮浓度为1.86 mg/L;施肥后第5天,表层水中有机氮浓度升高至最大值9.52 mg/L。且对比空白组(CK)可以发现,不施肥情况下表层水中有机氮浓度变化较小,始终维持在1.80~2.09 mg/L之间。由此说明不施肥条件下,土壤中有机氮通过土-水交换进入表层水中的量较少,而土壤深施肥能明显增加表层水中有机氮的含量,因此施肥后表层水中有机氮增加量可全部视为尿素分子。
相较施肥前表层水中有机氮浓度1.86 mg/L,施肥后第15天表层水中有机氮浓度(4.18 mg/L)增加了2.32 mg/L。
综上(1)~(3)所述,施肥后第15天较施肥前(第0天)相比,表层水中NH4+-N、NO3--N、有机氮浓度分别增加了23.01、3.53、2.32 mg/L,在体积约为8 L的表层水中,NH4+-N、NO3--N、有机氮增加量分别为184.08、28.22、18.56 mg。
2.1.2 施肥前后土壤中氮素变化量 尿素深施前后,土壤pH及各氮素含量的变化如表2所示。
(1)无机氮。土壤中无机氮主要包括NH4+-N、NO3--N以及NO2--N 3种氮素形态。根据表2中施肥前后土壤各氮素含量以及不同土层深度的土壤重量分别计算可知,施肥后第15天与施肥前(第0天)相比0~40 cm土壤中NH4+-N增加量为1600.74 mg;NO3--N增加量为62.04 mg;NO2--N减少量为53.40 mg。
(2)有机氮。全氮主要包括有机氮和无机氮,根据表2中各氮素含量则可计算出施肥后第15天土壤中有机氮的增量为760.62 mg,由于施肥时无其他有机态氮源输入,即增加的有机氮量可视为尿素分子。故施肥后第15天,仍有760.62 mg氮素以尿素分子的形态存在于土壤中。
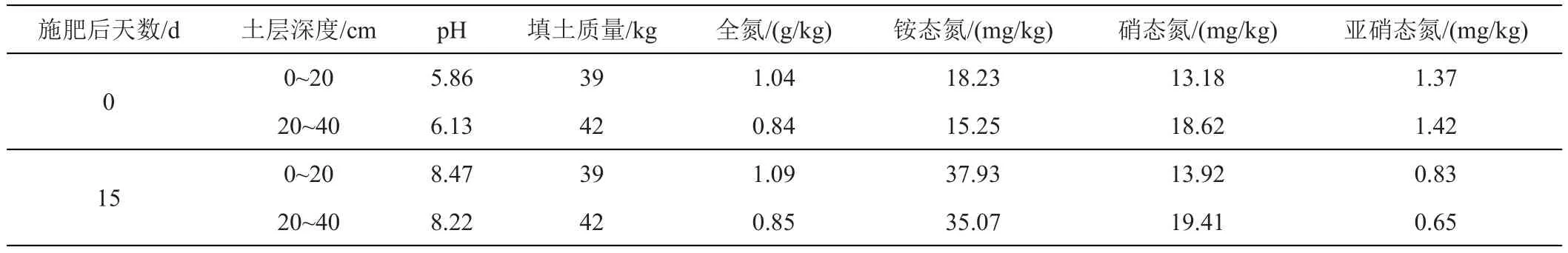
表2 土壤pH及各氮素含量变化
综上(1)~(2)所述,施肥后第15天较施肥前(第0天)相比,土壤中NH4+-N、NO3--N、有机氮的增加量分别为 1600.74、62.04、760.62 mg;NO2--N 减 少量为53.40 mg。
(3)土-水系统中氮素损失量。结合上述(1)、(2)中分析可知,施肥后第15天较施肥前相比土-水系统中各氮素含量变化如下表3所示。
由尿素分子化学式[CO(NH2)2]可知,施入土壤的4460 mg尿素中含有2081.33 mg N元素。结合表3土-水系统中氮素含量变化可知施肥后第15天较施肥前相比系统中N元素的增加量为1755.90 mg,因此整个土-水系统中损失的N元素含量为325.43 mg。
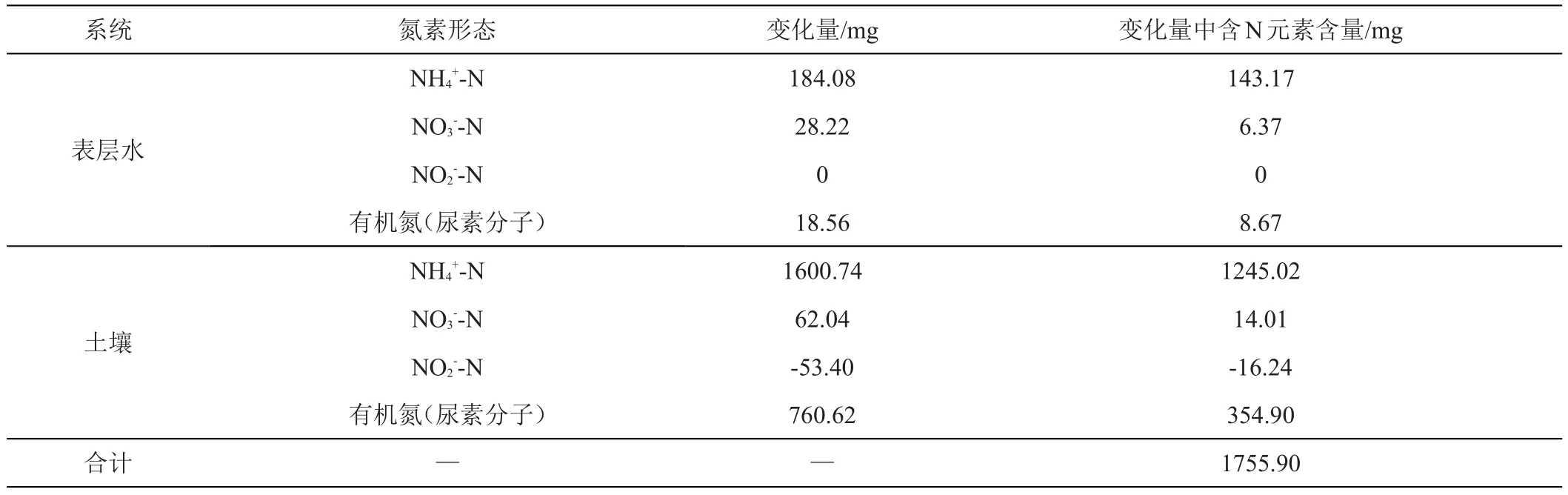
表3 施肥前后土-水系统中各氮素变化量
2.2 土-水系统氮素的迁移转化
2.2.1 土-水系统氮素迁移转化过程中的生化反应 土-水系统中涉及氮素迁移转化过程的生化反应可能包括微生物固氮作用、尿素水解、氨挥发、生物硝化反硝化以及厌氧氨氧化等,主要反应方程式如下:

(1)微生物固氮作用。具有固氮能力的生物主要是原核微生物,根据它们和高等植物的关系,可分为自生固氮菌、共生固氮菌和联合固氮菌3种[24]。其中,共生固氮菌以及联合固氮菌必须与植物形成紧密共生关系或必须生活在植物根际、叶面等处才能进行固氮作用,而自生固氮菌可自由生活,能独立进行固氮[25]。由于本研究系统中无植物种植,故该系统中进行固氮作用的微生物主要为自生固氮菌。
张秋磊等[26]研究表明,自生固氮菌虽无需与植物配合,但自生固氮菌在满足了自身的氮素需要后就不再进行固氮作用,若固氮量过高反而会抑制其自身固氮系统的固氮能力。因此这种固氮方式效率低下,固氮量有限,故该系统中微生物固氮作用可忽略不计。
(2)尿素水解。由于尿素采用深施方式,故在土壤中存在尿素水解反应。同时施入土壤中的部分尿素分子在未水解的情况下可通过土—水交换作用进入表层水中发生水解。
因此,在土—水系统中,土壤和表层水中均可能发生尿素水解反应。
(3)氨挥发。由于本系统土壤表层始终维持5 cm厚水层,土壤间隙液中的游离氨无法直接挥发至大气中,故只能通过土—水交换作用进入到表层水中,进而通过水—气界面挥发。
氨挥发主要受氨氮浓度、温度以及pH等因素的影响。试验研究过程中表层水的水温维持在24.7~25.3℃、酸碱度维持在pH 7.47~8.38,在该温度以及pH条件下,存在氨挥发。
因此,在土-水系统中,氨挥发主要发生在表层水中。
(4)硝化反应。硝化反应为需氧反应。在尿素深施方式下,翻动土壤增加了土壤孔隙度且改善了土壤通透性,有利于氧气渗入土壤。因此在施肥后短时间内,可能存在生物硝化反应。但有研究表明[27],在土壤孔隙被水填充呈水饱和状态下(尤其在保持淹水层时),氧气的扩散系数极小,故土壤中硝化反应作用微弱。
对于表层水而言,其溶解氧浓度维持在1.33~3.44 mg/L,充足的氧分子为反应提供了良好的条件,因此表层水中的NH4+-N在微生物作用下可进行硝化作用。
综上所述,在土—水系统中,土壤中硝化反应作用微弱,该反应主要发生在表层水中。
(5)反硝化反应。本研究系统中,土壤表面长期维持5 cm水层,随着有限的氧气不断被土壤中微生物所消耗,土壤系统逐渐处于缺氧状态,有利于生物反硝化反应进行。生物反硝化作用生成的N2或中间产物NO2、N2O、NO等气体通过水—气界面逸出土—水系统。
研究表明,反硝化菌对溶解氧含量十分敏感。康媞等[28]研究表明在活性污泥系统中,溶解氧达到0.3~1.5 mg/L时,反硝化过程就停止了。由于氧会与硝酸盐竞争电子供体,同时分子态氧会抑制硝酸盐还原酶的合成及其活性,因此溶解氧对反硝化过程有抑制作用。由于表层水中溶解氧浓度在施肥后1~15天维持在1.33~3.44 mg/L,始终处于好氧状态,不利于反硝化反应进行,因此整个试验过程表层水中发生的反硝化反应可忽略。
综上所述,在土—水系统中,生物反硝化反应主要发生在土壤中。
(6)厌氧氨氧化反应。由于厌氧氨氧化菌是一种倍增时间长,生长条件相对苛刻的自养菌,因此需要通过探讨底物、溶解氧、pH以及温度等因素对其生长的影响来判断该反应是否会在土—水系统中发生。
对于表层水而言,由于表层水中溶解氧浓度高且基本无NO2--N的积累,故基本不存在厌氧氨氧化作用。
研究表明,厌氧氨氧化菌的最适酸碱度在pH 6.50~8.50之间[29],且在温度为20~40℃范围内,厌氧氨氧化菌均可表现出一定的活性[30]。试验过程中,水温维持在24.7~25.3℃、土壤pH在施肥后第15天可达到pH 8.22~8.47,因此土壤中可满足厌氧氨氧化菌生长的pH和温度条件。
然而,土壤中厌氧氨氧化反应和反硝化反应对反应底物NO2-会产生竞争作用。由于厌氧氨氧化菌倍增时间长,而反硝化菌倍增时间短,生长速率更快,故反硝化菌处于优势地位。同时,土壤有机质的存在也会对厌氧氨氧化菌有一定的抑制作用。有机质作为反硝化过程的电子供体,会增加反硝化对NO2--N的利用率,进而抑制厌氧氨氧化脱氮过程[31]。且根据吉布斯自由能分析,反硝化反应相比于厌氧氨氧化反应更容易发生[32]。
因此,土-水系统中厌氧氨氧化反应可忽略。
综上(1)~(6)分析可知,土—水系统氮素迁移转化过程中,尿素水解反应在表层水和土壤中均会发生,氨挥发和硝化反应主要发生在表层水中,反硝化反应主要发生在土壤中。且土—水系统中的氮素损失主要来源于氨挥发及生物反硝化作用。
2.2.2 土-水系统中氮素迁移转化过程与损失分析 土—水界面、水—气界面不断发生的交换作用及生物化学反应是土—水系统中氮素迁移转化的主要原因。结合以上分析,施肥前至施肥后第15天土—水系统中氮素的含量变化及发生的主要生化反应如表4所示。
由表4可知,施肥后第15天系统中以有机氮(尿素分子)形式存在的氮素含量为779.18 mg。故施入土壤的4460 mg尿素中约有3680.82 mg尿素在脲酶作用下水解为NH4+-N,由式(1)计算得出NH4+-N生成量应为2208.49 mg。其中,相较施肥前(第0天),土-水系统中NH4+-N总增加量为1784.82 mg,故参与迁移转化的NH4+-N量为423.67 mg。
由表4中的主要反应可知,土-水系统中NH4+-N主要通过氨挥发和生物硝化作用进行迁移转化。
(1)氨挥发。尿素深施方式下,在15天的试验期间,土—水系统中累计氨挥发量变化如图3所示。
由图3可知,施肥后第15天累计氨挥发量达到21.54 kg/hm2。根据模拟装置土壤表面面积0.138 m2可计算出,该系统氨挥发损失量为290.79 mg。
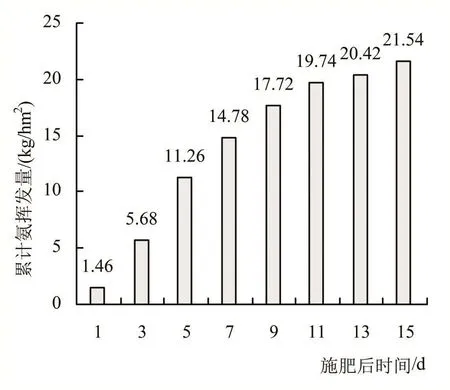
图3 土-水系统中累计氨挥发量变化
(2)硝化反应。由上述分析可知,参与迁移转化的NH4+-N量为423.67 mg。结合氨挥发量可计算出,系统中参与硝化反应的NH4+-N量约为132.88 mg。结合式(2)可计算出系统中硝化反应生成的NO3--N量约为457.70 mg。
(3)反硝化反应。硝化反应生成的NO3--N部分留在表层水中,部分通过土—水交换作用进入土壤后,或被土壤吸附,或发生反硝化反应消耗。
由式(5)~(9)可知,NO3--N、NO2--N均可作为反硝化反应的底物。表4中,相较施肥前(第0天),施肥后第15天土—水系统中NO3--N总增加量为90.26 mg,NO2--N减少量为62.04 mg。结合上述分析可计算得到发生反硝化反应消耗的NO3--N量应为367.44 mg;消耗的NO2--N量为62.04 mg。
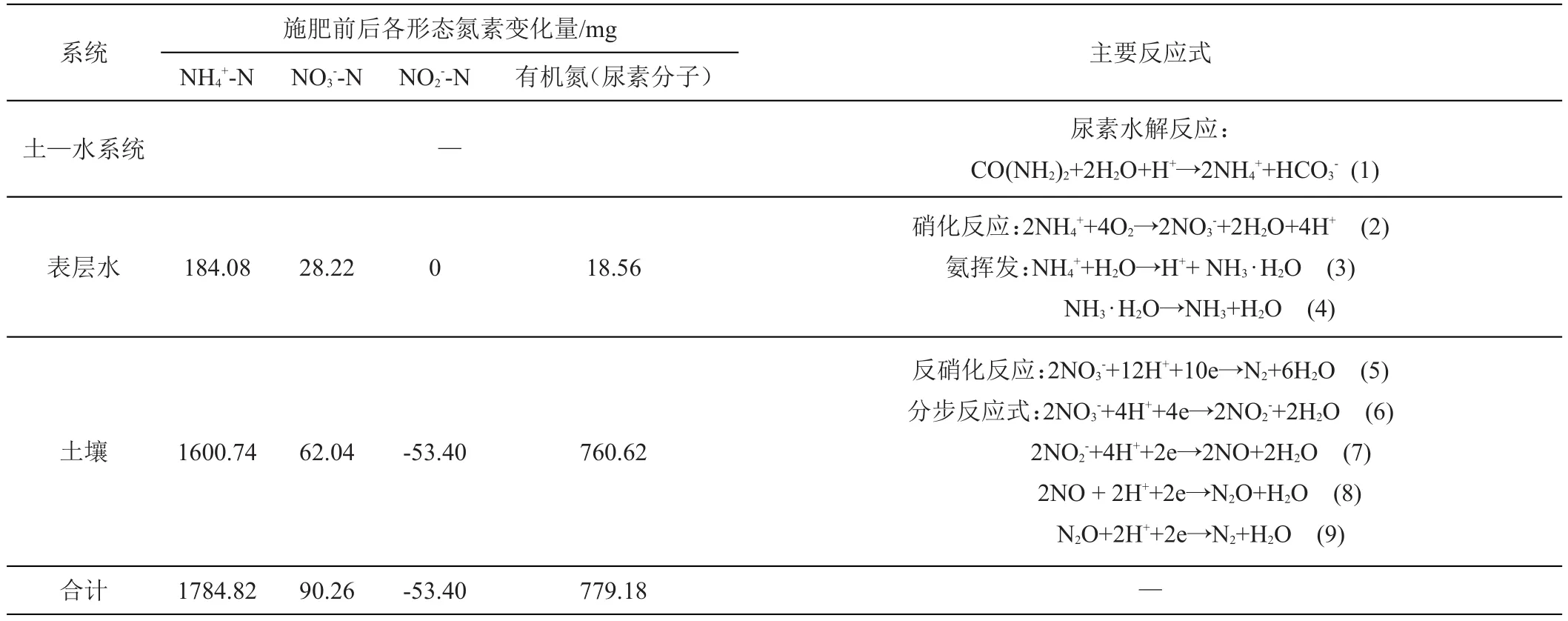
表4 施肥前后土—水系统中氮素含量变化及主要反应
综上所述,土—水系统中通过氨挥发和反硝化反应损失的N元素量如表5所示。
由表5可知,土-水系统中损失的N元素含量为328.02 mg,与2.1中整个土-水系统中损失的N元素含量为325.43 mg基本吻合。此外,系统中通过反硝化反应损失的N元素含量约占总损失量的31.05%,而氨挥发损失的N元素含量约占68.95%,故系统中的N元素损失以氨挥发为主。
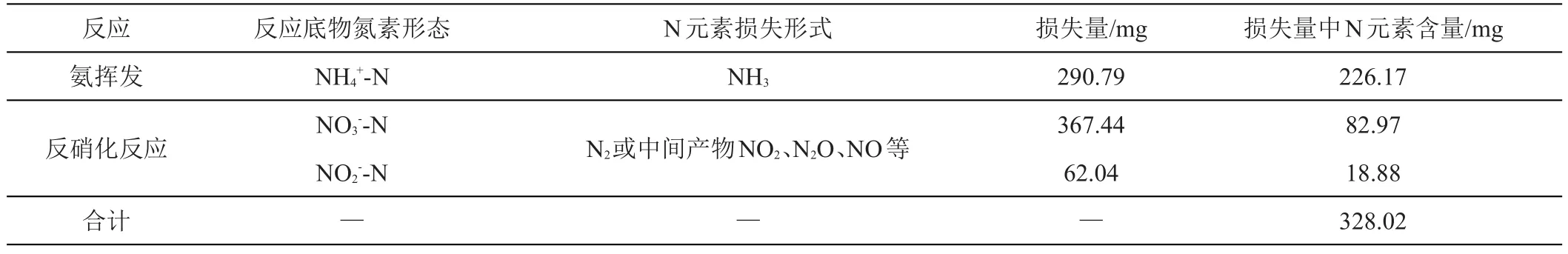
表5 土—水系统中N元素损失量
3 结论
尿素深施方式下,施肥后15天内尿素水解率可达到82.53%,其中水解后存在于土壤中的氮素占73.30%、表层水中占8.71%,发生生化反应损失的氮素约占19.78%。施肥后15天内滞留于土壤或表层水中暂未被分解的尿素为总施入量17.47%,其中土壤中占97.62%;表层水中占2.38%。
尿素深施方式下,氮素在土—水系统中的迁移转化途径为表层水中以氨挥发和硝化反应为主,土壤中以反硝化反应为主。土-水系统中的氮素损失主要来源于氨挥发及生物反硝化作用,损失量约占总施肥量的14.86%,其中通过反硝化反应损失的N元素量约占31.05%,通过氨挥发损失的N元素量约占68.95%。
