复合乳酸菌发酵红茶汤香气成分及活性因子变化规律
2022-11-29陈清爱林湘旋韩金志
陈清爱, 林湘旋, 陈 驰, 韩金志
(1.福建商学院旅游与休闲管理学院,福建 福州 350012;2.福州大学生物科学与工程学院,福建 福州 350108;3.福建农业职业技术学院现代农业工程学院,福建 福州 350007)
乳酸菌作为一类重要的实际安全(GRAS)级食品微生物广泛应用于发酵食品,具有抗菌防腐、赋予食品特殊风味以及提高营养品质等功能[1].目前用于生产发酵食品的乳酸菌有20余种,如酸奶的生产会用到保加利亚乳杆菌和嗜热链球菌,德式乳杆菌用于发酵畜产品,干酪乳杆菌和副干酪乳杆菌用于生产乳酪等[2],植物乳杆菌是酸菜发酵生产中的优势菌株[3].其中,植物乳杆菌和发酵乳杆菌通常可作为发酵剂用于生产各类发酵食品,其代谢产生的乳酸和过氧化氢,可调节肠道pH,活化肠道中的过氧化酶—硫氰酸盐反应体系,具有抑制病原菌、调节肠道菌群等功能;此外,乳酸菌菌体细胞可与胆固醇、胆盐通过共沉淀作用去除体外胆固醇的主要方式发挥降血脂功能[4];同时,复合乳酸菌对人体免疫系统有一定的调控作用,如促进肠道免疫系统的发育、诱导T细胞的分化[5].
中国是世界红茶的发源地,也是红茶的最大出产国,红茶以其独特的香气与滋味深受消费者青睐.当前已在红茶中鉴定出400多种香气物质;此外,红茶含有多种功能性活性成分和滋味物质,已分离鉴定出700多种已知化合物,包括蛋白质(20%~30%)、茶多酚(18%~36%)、糖类(20%~25%)、氨基酸、生物碱、芳香物质和维生素等[6].当前,发酵茶饮料因其独特的风味与良好的益生功能,已成为市场消费的热点产品,并引起众多科研工作者关注.红茶富含多种营养成分,可为微生物发酵提供丰富的碳源、氮源和生长因子,同时也为发酵茶饮料的独特风味提供物质基础或前体;同时,微生物发酵使茶饮料中的酚氨比下降、芳香物质增加,并积累大量初级或次级代谢产物,从而改善茶汤风味,提高益生功能[7].发酵茶饮料由于其独特的风味和保健功能而受到广大消费者喜爱,国内也有越来越多针对发酵茶饮料的工艺开发和功能性研究报道.如刘佳奇等[8]用植物乳杆菌发酵正山小种红茶和铁观音乌龙茶的茶汤,确定最优发酵工艺,并对发酵前后的茶多酚、咖啡因、氨基酸含量及抗氧化能力、香气成分进行分析,研制出风味独特的发酵茶饮料.当前虽然已有乳酸菌发酵茶饮料的相关研究,但对于复合乳酸菌发酵红茶饮料的香气成分和活性因子等变化规律缺少系统研究,且在发酵过程中茶汤中香气成分和活性因子的组成结构以及各组分含量的变化规律尚不明确,无法为乳酸菌发酵茶饮料工业化生产提供技术支持.
本研究以福建闽北小种红茶为原料,以植物乳杆菌和发酵乳杆菌作为复合发酵菌株,对发酵红茶汤香气成分和活性因子在不同发酵阶段的变化规律进行探讨,旨在为乳酸菌发酵红茶饮料在生产中实现发酵过程控制和功能性研究提供依据.
1 材料与方法
1.1 材料
1.1.1 原料与试剂 红茶(正山小种)购自福建茶叶进出口有限公司.
MRS培养基购自广东环凯微生物科技有限公司;42种游离氨基酸混合标准品购自德国曼默博尔公司;8种有机酸混合标准品购自北京北方伟业计量技术研究院;γ-氨基丁酸(gamma-aminobutyric acid, GABA)标准品、L-茶氨酸标准品购自美国Parliament St公司;咖啡因标准品购自坛墨质检科技股份有限公司;乙腈(色谱级)购自德国默克集团有限公司;2-辛醇(纯度99.8%)购自德国Dr.Ehrensorfer公司;植物乳杆菌、发酵乳杆菌由福州大学生物科学与工程学院实验室保藏.
1.1.2 仪器与设备 主要仪器与设备有5977A气相色谱质谱联用仪(美国安捷伦科技有限公司)、SPX-150BⅢ恒温生化培养箱(黄骅菲斯福实验仪器有限公司)、反相C18液相色谱柱(4.6 mm×200 mm,美国安捷伦科技有限公司)、LDZF-50L-Ⅲ立式高压灭菌锅(上海申安医疗器械厂)、MP511 pH计(上海三信仪表厂)、Fresco 17高速冷冻离心机[赛默飞世尔科技(中国)有限公司]、LC-20A高效液相色谱仪(日本岛津公司)、Carbo-Pac PA20色谱柱(3 mm×150 mm,美国戴安公司)、A300氨基酸自动分析仪(德国曼默博尔公司)、UV-1100紫外可见分光光度计(上海美普达仪器有限公司)、 PDMS固相微萃取头(30 μm,美国Supelco公司)、Dionex-5500超高相离子交换色谱仪(美国戴安公司)、57330-U SPME手动进样柄(美国Supelco公司).
1.2 样品制备
1.2.1 待接菌种的制备 将冷冻保存的植物乳杆菌和发酵乳杆菌(体积比为1∶1)进行多次MRS培养基活化、复壮培养.取一定量的菌液进行离心操作,离心完成后去除上清液,用生理盐水润洗3次,润洗后以生理盐水作为参比溶液.将菌液光密度(D600 nm)调整至0.5~0.6,等待接菌[9].
1.2.2 复合乳酸菌发酵红茶汤的制备 在10 g干燥红茶中加入2 L纯净水,煮沸保持5 min后,加入10 g葡萄糖,溶解并过滤除渣.取上清茶汤分装于丝口瓶中,于115 ℃条件下高压灭菌20 min,待其冷却至室温,加入0.5%(体积比)植物乳杆菌和0.5%(体积比)发酵乳杆菌的生理盐水菌悬液(D600 nm为0.5~0.6),于37 ℃条件下恒温静置发酵.试验设置3个平行.
1.3 指标测定
1.3.1 复合乳酸菌活菌数和pH的测定 分别在红茶汤发酵0、2、4、8、12、18、24、36、48、72、96 h时取样,样品经生理盐水梯度稀释后,涂布于MRS固体培养基上,置于37 ℃恒温培养箱培养24 h后进行菌落计数.同时分别在红茶汤发酵0、24、48、72、96 h时取样,样品于10 000×g离心5 min,取上清测定样品的pH.
1.3.2 单糖含量的测定 按文献[10]的方法检测发酵红茶汤中的单糖含量.分别在红茶汤发酵0、24、48、72、96 h时取样,样品经15 000×g离心10 min后,收集上清,过0.22 μm滤膜.取适量上清用超纯水稀释100倍后,采用超高相离子交换色谱系统和脉冲安培检测器进行检测.以0.02%(质量比)NaN3为流动相,采用Carbo-Pac PA20色谱柱(3 mm×150 mm)检测.检测条件:柱温30 ℃、进样量10 μL、流动相流速0.5 mL·min-1.
1.3.3 挥发性香气成分含量的测定 按文献[11]的方法检测发酵红茶汤中的挥发性香气成分含量.分别在红茶汤发酵0、24、48、72、96 h时取样,取5 mL样品置于12 mL顶空萃取瓶中,依次加入1 g NaCl、10 μL 10 mg·mL-12-辛醇(内标)[12],混匀,置于40 ℃水浴磁力搅拌器中,于600 r·min-1条件下温育20 min后插入固相微萃取针,压出萃取纤维,使其固定在距离液面0.5~1.0 cm处,吸附萃取30 min后收回萃取纤维,拔出萃取针并插入气相色谱—质谱联用仪中进样分析.采用DB-WAX色谱柱(30 m×0.25 mm,0.25 μm)检测,检测条件[13-14]:进样口温度250 ℃;柱温箱起始温度40 ℃,保留8 min,然后以4 ℃·min-1升温至150 ℃,再以20 ℃·min-1升温至250 ℃,保留5 min;载气为99.999%高纯度氦气,流速1 mL·min-1;离子源温度为230 ℃,电离方式为EI,电离能量为70 eV,接口温度为250 ℃,四级杆温度150 ℃,选择SCAN模式为扫描方式进行定性分析,离子碎片的扫描范围为30~500 m·z-1,溶剂延迟时间为2.5 min.选择匹配度≥85,计算挥发性香气成分含量.
挥发性香气成分含量=(各挥发性香气成分峰面积×2-辛醇含量)/2-辛醇峰面积.
1.3.4 游离氨基酸含量的测定 分别在红茶汤发酵0、24、48、72、96 h时取样,将400 μL经0.45 μm过滤处理的样品与100 μL 10%磺基水杨酸混合均匀,置冰箱(2~8 ℃)中冷藏静置过夜.于15 000×g条件下离心15 min,取上清再次以15 000×g离心5 min.样品按1∶2的体积比稀释后过0.22 μm滤膜,使用氨基酸自动分析仪检测游离氨基酸含量.
1.3.5 有机酸含量的测定 按文献[15-16]的方法测定发酵红茶汤中的有机酸含量.分别在红茶汤发酵0、24、48、72、96 h时取样,样品在15 000×g条件下离心5 min,过0.22 μm滤膜,使用高效液相色谱仪进行检测.检测条件:流动相为0.01 mol·L-1磷酸二氢钠(pH 2.7),过0.45 μm滤膜,超声处理20 min;反相C18液相色谱柱(4.6 mm×200 mm,5 μm)的柱温27 ℃;紫外检测器的检测波长为210 nm;进样量为20 μL,流动相流速为0.8 mL·min-1.
1.3.6 活性因子含量的测定 分别在红茶汤发酵0、24、48、72、96 h时取样.GABA含量参照QB/T 4587—2013[17]的方法测定;L-茶氨酸含量参照GB/T 23193—2017[18]的方法测定;茶多酚含量参照GB/T 21733—2008[19]的方法测定;咖啡因含量参照GB 5009.139—2014[20]的方法测定.
1.4 数据处理
数据采用SPSS Statistics 26.0进行分析,使用软件Origin 2018和Hypertext Markup Language 1.0.3.7-Illustrator绘图.
2 结果与分析
2.1 发酵红茶汤复合乳酸菌活菌数和pH的变化
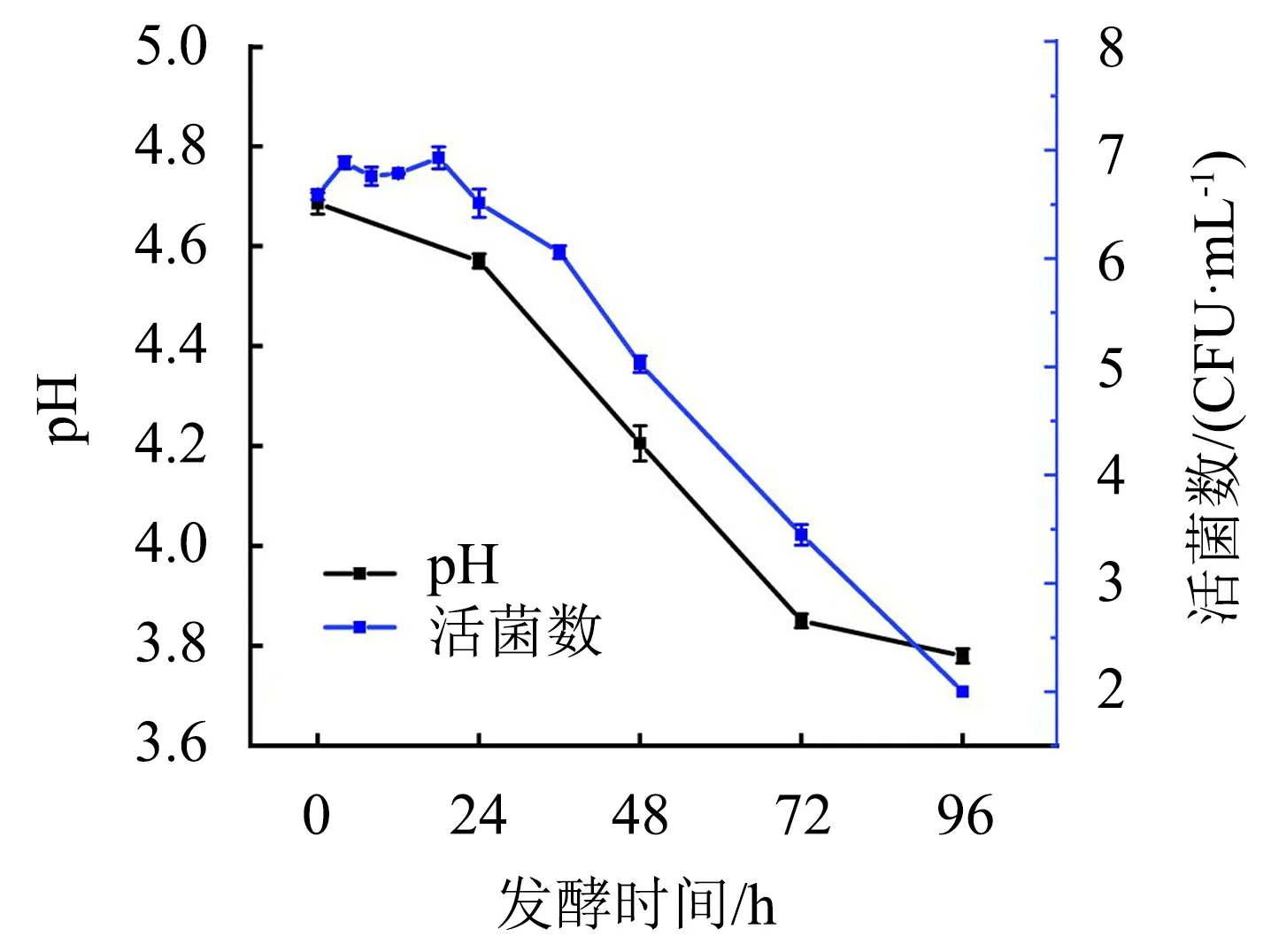
图1 不同发酵阶段红茶汤中复合乳酸菌活菌数和pH的变化Fig.1 Changes in pH value of black tea infusion and the number of viable compound Lactobacillus at different fermentation stages
在发酵过程中红茶汤pH和复合乳酸菌活菌数的变化是判断发酵进程的重要指标.图1显示,经复合乳酸菌发酵0~96 h,红茶汤的pH由4.69逐步下降至3.78,说明乳酸菌代谢产酸.红茶汤发酵0~18 h,乳酸菌能够利用茶汤中的营养物质进行繁殖,其活菌数略有上升;发酵24~96 h,乳酸菌活菌数呈下降的趋势,这可能与茶汤中营养物质浓度低且含有多酚、生物碱等抑菌物质对乳酸菌的生长繁殖产生逆境胁迫有关.
2.2 发酵红茶汤单糖含量的变化
单糖是重要的可发酵碳水化合物,是乳酸菌发酵过程中的主要碳源物质.由表1可见,在红茶汤发酵的过程中共检6种单糖,包括葡萄糖、果糖、甘露糖、鼠李糖、半乳糖和木糖.其中,葡萄糖含量在发酵0~24 h呈上升的趋势,这可能是由于复合乳酸菌在繁殖过程中不仅能够消耗葡萄糖,同时也能分解多糖分子产生葡萄糖;果糖和甘露糖含量的变化趋势相似,都是先下降而后略有上升,这意味着它们在发酵过程中处于动态变化状态;半乳糖含量较少,变化不显著;发酵48~96 h,乳酸菌在代谢中产生少量鼠李糖;木糖伴随着发酵进程而逐步被消耗,其含量在发酵24 h后由0.74 mg·mL-1被完全消耗至0 mg·mL-1.可见,茶汤中的葡萄糖、果糖、甘露糖和木糖是乳酸菌发酵过程中的主要碳源物质,且代谢过程中不产生木糖.
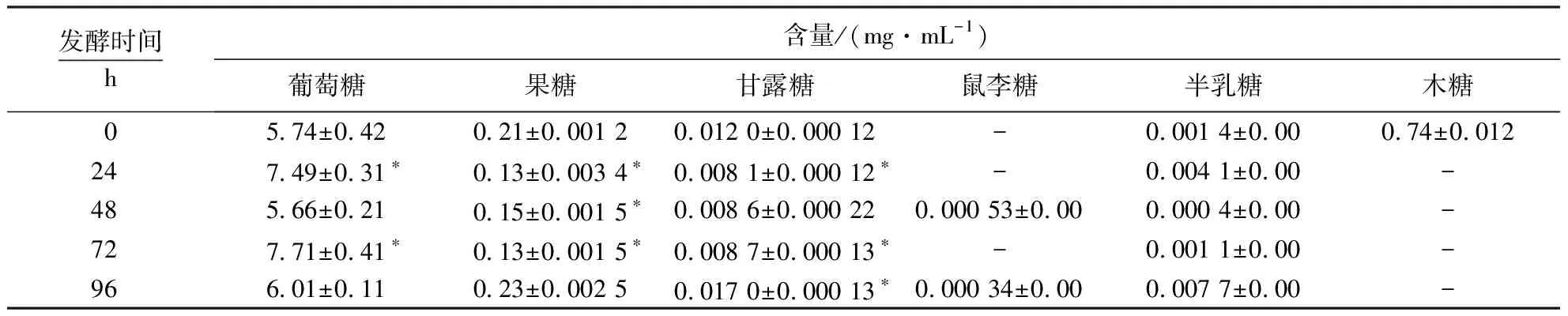
表1 不同发酵阶段红茶汤中单糖含量的变化1)Table 1 Changes in contents of monosaccharides in black tea infusion at different fermentation stages
2.3 发酵红茶汤挥发性香气成分的变化
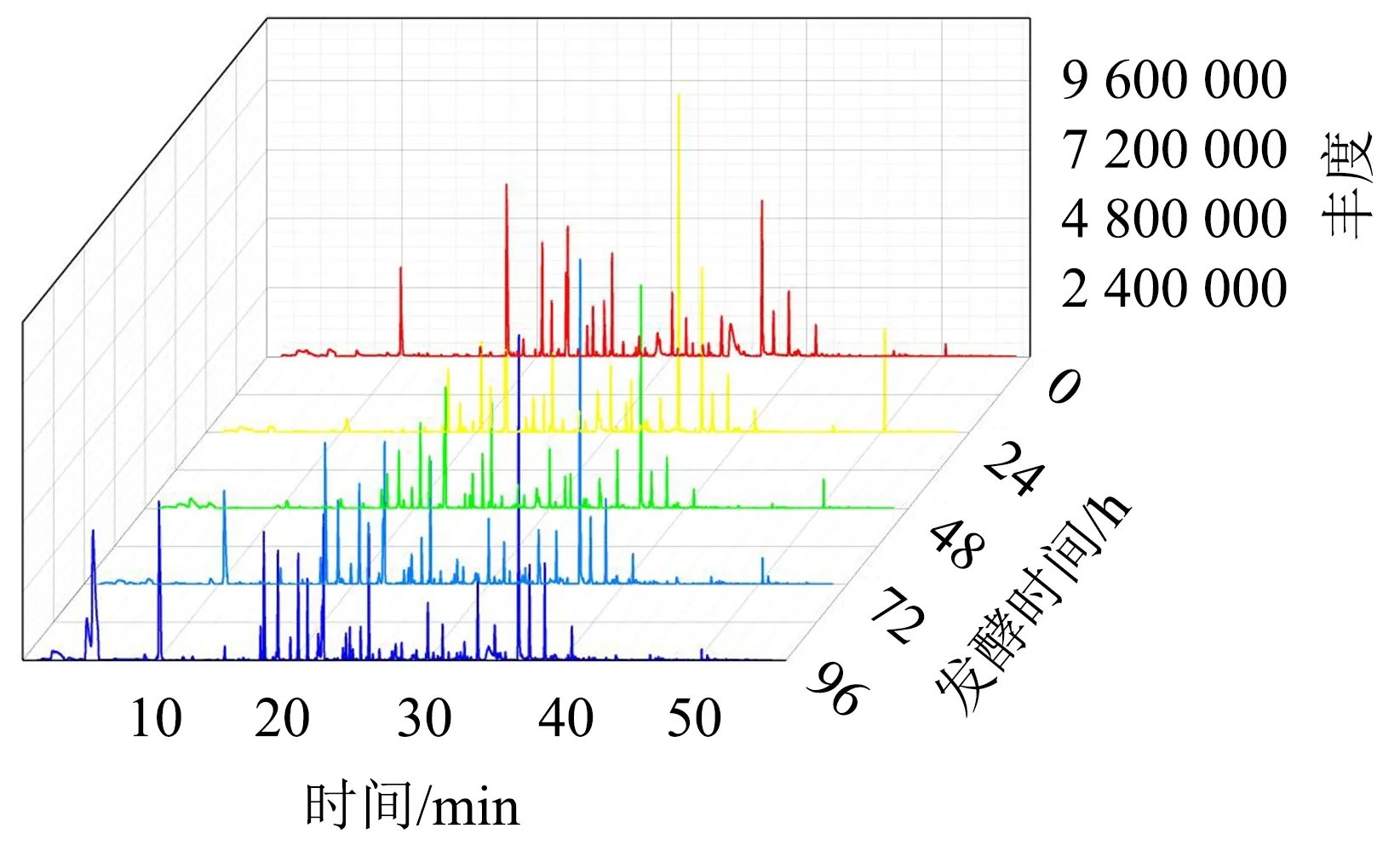
图2 不同发酵阶段红茶汤中挥发性香气成分总离子流图Fig.2 Total ion chromatogram of volatile aromatic components in black tea infusion at different fermentation stages
挥发性香气成分的丰度与结构组成是评价发酵红茶汤品质的关键指标之一.气相色谱—质谱总离子流图(图2)显示,复合乳酸菌发酵红茶汤中的挥发性物质组成及含量在不同发酵阶段存在差异,且随着发酵时间而处于动态变化过程,但经过发酵后,茶汤香气成分的丰度均显著增加.由不同发酵阶段挥发性香气成分组成热图(图3)和附件表1(扫OSID码可见)可知,复合乳酸菌发酵红茶汤与未发酵组相比较,挥发性香气成分数量明显增加,香气物质组成随着发酵时间呈动态变化.未发酵时,茶汤中的香气成分主要为D-柠檬烯、苯乙醛、反式β-罗勒烯、甲酸辛酯、糠醛和松油醇等;发酵24 h, 香气成分主要为β-罗勒烯、苯甲醛、月桂烯、吲哚、3,5-二甲基苯甲醛、3-己烯-1-醇、1-甲基萘、2,4-二叔丁基苯酚和顺-茉莉酮等;发酵48 h,香气成分主要为糠醛、壬醛、松油醇、5-甲基-2-呋喃甲醛、α-亚乙基-苯乙醛、反-β-紫罗兰酮、顺-罗勒烯、顺-3-壬烯-1-醇、2-甲基萘、3,6-壬二烯-1-醇、反-橙花叔醇、反-3-己烯-1-醇、乙酰苯、3,7-二甲基-1,6-辛二烯-3-醇、甲基苯甲醇、苯甲醛和柠檬醛等;发酵72 h,香气成分主要为香叶醇、苯甲醛、柠檬醛、反-3-己烯-1-醇、乙酰苯、3,7-二甲基-1,6-辛二烯-3-醇、甲基苯甲醇、苯甲醛、柠檬醛、4-(2,6,6-三甲基-1,3-环己二烯-1-基)-3-丁烯-2-酮、顺-2-己烯-1-醇、水杨酸甲酯、2,4-二甲基苯甲醛、乙酰呋喃、苯甲醇、2-十一酮、1-庚醇、苯乙醇、苯乙烯、苯乙腈、月桂烯和吲哚等;发酵96 h,香气成分主要为香叶醇、D-柠檬烯、β-环柠檬醛、2-莰烯、顺-2-己烯酸、β-罗勒烯、苯甲醇、2-十一酮、1-庚醇、苯乙醇和氯甲酸辛酯等.由此可见,复合乳酸菌发酵红茶汤具有更加丰富的风味物质,且发酵72 h的香气成分最多.在整个发酵过程中,随着时间的延长,香叶醇、反-3-己烯-1-醇、2-十一酮、1-庚醇、苯乙醇、氯甲酸辛酯和十三烷酮等含量呈逐渐增加的趋势,这些挥发性香气成分的增加可进一步提升茶汤香气,并赋予茶汤的花香和水果甜香;而壬醛和松油醇等含量随着发酵时间的延长呈逐渐下降的趋势,则可减少茶汤中的青草味.
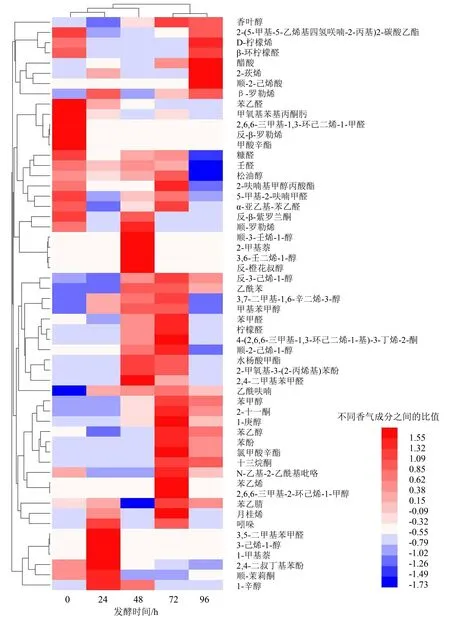
图3 不同发酵阶段红茶汤中挥发性香气成分组成热图Fig.3 Heat map of aromatic components in black tea infusion at different fermentation stages
2.4 发酵红茶汤游离氨基酸含量的变化
图4显示,在红茶汤发酵过程中共检测出22种游离氨基酸,氨基酸的组成和含量在不同发酵阶段均呈差异性变化.未发酵时,茶汤中的氨基酸组成以苏氨酸、正亮氨酸、谷氨酸和β-丙氨酸等为主;发酵24 h,茶汤中的苏氨酸、正亮氨酸、谷氨酸和β-丙氨酸含量持续下降,氨基酸组成以精氨酸、色氨酸、天冬氨酸、丝氨酸和天冬酰胺为主;发酵48 h,氨基酸组成以缬氨酸、丝氨酸和天冬酰胺为主;发酵72 h,氨基酸组成以羟基脯氨酸为主,其他氨基酸含量持续下降;发酵96 h,氨基酸组成以乙醇胺、苯丙氨酸和肌氨酸为主.不同种类游离氨基酸呈现出酸、咸、苦、鲜等滋味[21].茶汤经乳酸菌发酵作用后,苦味氨基酸,如色氨酸、赖氨酸和精氨酸含量减少,这与已有的研究结果[22]一致.
2.5 发酵红茶汤有机酸含量的变化
图5显示,在红茶汤发酵各阶段均检测出8种有机酸.发酵0~96 h,茶汤中的有机酸含量总体呈增加的趋势,有机酸组成及含量在不同发酵阶段呈差异性变化.发酵24 h,茶汤中的酒石酸、甲酸、乳酸、柠檬酸、乙酸和琥珀酸含量呈增加的趋势(其中,乳酸和柠檬酸含量增幅显著),苹果酸和丙酸含量略有减少;发酵48 h,茶汤中的甲酸、苹果酸、乳酸、乙酸和琥珀酸含量增加(其中,乙酸和琥珀酸含量增幅显著),而酒石酸、柠檬酸和丙酸含量减少(其中,柠檬酸含量显著下降);发酵72 h,茶汤中的酒石酸、乳酸、乙酸、琥珀酸和丙酸含量有所增加(其中,乳酸、乙酸和丙酸含量显著增加),而甲酸、苹果酸和柠檬酸含量减少(其中,柠檬酸含量显著下降);发酵96 h,茶汤中的酒石酸含量有所增加,乙酸、琥珀酸和丙酸含量呈下降的趋势(其中,乙酸和琥珀酸含量下降幅度明显),其他有机酸含量基本不变.这表明乳酸菌发酵有利于有机酸的积累,对于改善茶汤的感官品质有较好的作用.

图4 不同发酵阶段红茶汤中游离氨基酸含量的变化Fig.4 Changes in contents of amino acids in black tea infusion at different fermentation stages
2.6 发酵红茶汤活性因子含量的变化
红茶汤中的GABA、茶多酚、L-茶氨酸和咖啡因等物质具有重要的生理活性功能,在茶汤发酵过程中,这些活性因子呈一定程度的变化.图6显示:发酵0~96 h,茶汤中的GABA含量呈先递增后下降的趋势;发酵72 h,GABA含量达到峰值,为0.649 mg·mL-1.研究表明:GABA由谷氨酸在谷氨酸脱羧酶(GAD)的作用下合成[23];乳酸菌发酵可增加发酵谷物中的GABA含量,可显著提高奶酪和酸奶中的GABA含量[24].发酵24 h,茶汤中的茶多酚含量无明显变化,此时的茶多酚含量可达到198.234 mg·mL-1,但随着发酵时间的延长呈较明显的下降趋势,发酵96 h时的茶多酚含量下降为134.484 mg·mL-1.发酵后茶多酚含量略有下降,可能是茶多酚在发酵过程中发生一系列的生化反应转化为茶黄素和茶褐素所致[25].L-茶氨酸含量随着发酵时间的延长呈较缓慢的下降趋势,未发酵时的含量最多,发酵48 h时的含量最少.L-茶氨酸含量经乳酸菌发酵后有所下降,这可能是L-茶氨酸作为一种能源被乳酸菌利用或者转化为D-茶氨酸所致.在整个发酵过程中,茶汤中的咖啡因含量基本保持不变,维持在0.163~0.168 mg·mL-1.
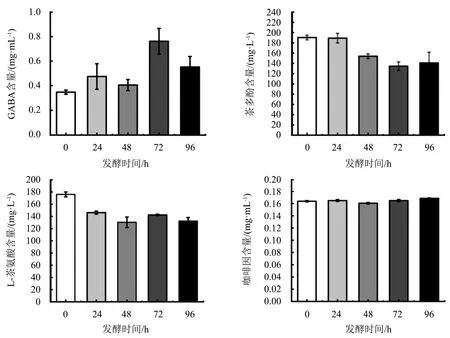
图6 不同发酵阶段红茶汤中活性因子含量的变化Fig.6 Changes in contents of bioactive factors in black tea infusion at different fermentation stages
3 结论
乳酸菌发酵红茶饮料不仅可赋予红茶饮料新的风味与口感,同时可将乳酸菌的益生功能与红茶的健康功能相结合.本研究以正山小种红茶为原料制成红茶汤,以植物乳杆菌和发酵乳杆菌作为复合发酵菌株,对不同发酵阶段茶汤中的还原糖、挥发性香气成分、游离氨基酸、有机酸、GABA、茶多酚、L-茶氨酸和咖啡因等含量的变化过程进行分析,阐释了复合乳酸菌发酵红茶汤在不同发酵阶段的香气成分和活性因子的变化规律.研究结果可为乳酸菌发酵茶饮料工业化生产的品质控制与功能性研究提供参考.
