黏质沙雷氏菌产舍雷肽酶的发酵培养基优化
2022-11-29梅建凤郑素晶应国清
梅建凤,郑素晶,陈 翔,李 靓,易 喻,应国清
(1.浙江工业大学 药学院,浙江 杭州 310014;2.舟山市食品药品检验检测研究院,浙江 舟山 316021)
舍雷肽酶,又称沙雷肽酶、沙雷蛋白酶等,英文名称有serrapeptase,serratiopeptidase,serralysin和serratia-protease等。它是一种碱性金属蛋白酶,最初是从黏质沙雷氏菌(Serratiamarcescens)E15菌株中分离得到,因其来源而得名[1-3]。舍雷肽酶具有出色的酪蛋白水解和溶纤活性,能水解组织中异常渗出物、变性蛋白质和血纤维凝块,使脓、痰和血凝块等液化而易于排出,具有良好的抗炎、抗菌、消肿和化痰作用[4-6],舍雷肽酶无论是单独使用,还是与其他药物联合使用,对动脉粥样硬化、淀粉样变性、牙周炎、支气管炎、鼻窦炎、类风湿性关节炎、腕管综合征和其他各种自身免疫性疾病都有较好的治疗效果[7-11],该酶还能促进抗生素在组织中渗透,从而增强抗生素的治疗效果[12]。早在20世纪60年代,舍雷肽酶就在日本上市,随后在世界多个国家上市并使用至今。因出色的功效和无副作用的特性,近年来,该酶作为辅助治疗药物和抗心血管疾病的保健食品市场需求旺盛,在电商平台上的销售量逐年增长。
目前,国际市场上的舍雷肽酶主要由日本和印度生产,国内未见有企业生产。为了开发具有自主知识产权的舍雷肽酶生产工艺,梅建凤等[13-14]开展了舍雷肽酶产生菌的分离、诱变育种、酶学性质和发酵工艺等研究,从家蚕(BombyxmoriL.)的蚕蛹肠道中分离得到一株黏质沙雷氏菌LL-413,能产生分子质量为52 kDa的舍雷肽酶。有关菌株的分离、鉴定和酶学性质研究已在文献[14]中报道,笔者研究报道该菌株产舍雷肽酶发酵培养基优化,首先在初始牛肉膏蛋白胨培养基的基础上,通过单因素设计法[15]确定发酵培养基中的主要成分;然后采用响应面分析法[16-17]确定主要成分的较佳浓度;最后考察了培养基初始pH和培养时间对产酶活力的影响,确定了黏质沙雷氏菌LL-413产舍雷肽酶的较佳培养基组成和培养时间,黏质沙雷氏菌LL-413的发酵产酶活力得以大幅度提高。
1 材料与方法
1.1 菌种和主要试剂
黏质沙雷氏(S.marcescens)LL-413菌株,分离自家蚕的蚕蛹肠道,保藏于中国典型培养物保藏中心,保藏编号CCTCC M2015780;福林酚试剂(生物试剂),国药集团化学试剂有限公司;实验所用其他试剂均为市售分析纯试剂或生物试剂。
1.2 仪器和设备
GI54DWS型压力蒸汽灭菌器,致微(厦门)仪器有限公司;SHP-250D生化培养箱,上海森信实验仪器有限公司;HZ-9311K恒温振荡培养箱,太仓华利达实验设备有限公司;SW-CJ-2D型超净工作台,苏州净化设备有限公司;SP-752型紫外-可见分光光度计,上海光谱仪器有限公司。
1.3 实验方法
1.3.1 培养基的配制
种子培养基和初始产酶培养基均为牛肉膏蛋白胨培养基,成分包括:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.0。250 mL三角瓶装50 mL培养基,8层纱布扎口,121 ℃蒸汽灭菌20 min。
1.3.2 初始产酶培养
0.5 mL的20%甘油冷冻保藏菌液接入20 mL的种子培养基,于30 ℃、200 r/min摇床中培养12 h后获得种子液,按1%的体积分数移取种子液接种于产酶培养基,于30 ℃、200 r/min摇床中培养24 h。
1.3.3 酶活的测定
培养液经5 000 r/min离心10 min后取上清液,经过适当倍数稀释后测定酶活。1 mL待测酶液和1 mL酪蛋白水溶液(20 g/L,50 mmol/L,pH 8.0的Tris-HCl缓冲液配制)于试管中,振荡混合后于37 ℃水浴中保温10 min,再加入2 mL的三氯乙酸终止液(TCA,0.4 mol/L)终止酶解反应,继续水浴保温20 min,经8 000 r/min离心5 min。取1 mL上清液于另一试管中,加入5 mL的Na2CO3(0.4 mol/L)和1 mL福林酚试剂,37 ℃水浴保温显色30 min,以酶解反应保温前加入TCA的相同处理为参比,测定A660,依据相同实验方法绘制的酪氨酸浓度—A660标准曲线,计算出酶解体系中酪氨酸的质量(μg),舍雷肽酶活力的定义:在pH 8.0、37 ℃反应条件下,1 min水解10 g/L酪蛋白产生1 μg酪氨酸为1个酶活力单位U。按上述定义计算发酵液中舍雷肽酶的活力。
1.3.4 菌体生物量的测定
培养液用去离子水稀释10倍后,以稀释相同倍数未接种的培养基为参比,测定OD600,依据预先制作的菌体OD600—菌体干质量标准曲线,计算培养液中的菌体干质量得率(g/L)。
1.3.5 实验设计
首先,采用单因素实验优化培养基的碳源的种类及浓度、氮源的种类及浓度和无机盐种类;然后,以单因素实验为基础,采用Box-Benhnken实验设计对黏质沙雷氏菌产舍雷肽酶的产酶条件进行3因素3水平的响应面分析,确定麦芽浸粉、酵母浸粉和牛肉膏的较优浓度;最后,考察培养基初始pH和培养时间对产酶活力的影响。
所有实验均重复3次,实验数据以3次实验结果的平均值表示。Box-Behnken实验采用Design-Expert V12设计和响应面分析。
2 结果与分析
2.1 单因素实验优化结果与分析
2.1.1 碳源种类及浓度对产酶活力的影响
因为初始产酶培养的牛肉膏蛋白胨培养基中无糖类碳源,添加糖类碳源有利于菌体大量生长和产酶,所以在牛肉膏蛋白胨培养基的基础上,分别添加10 g/L的葡萄糖、麦芽糖、蔗糖、麦芽浸粉和乳糖作为碳源,不同碳源对产酶活力的影响如图1所示。由图1可知:在牛肉膏蛋白胨培养基中添加10 g/L麦芽浸粉时,菌体干质量得率和酶活显著高于其他碳源,达到301.8 U/mL。

图1 不同碳源对产舍雷肽酶活力的影响Fig.1 Effect of carbon sources on the production of serrapeptase
麦芽浸粉不仅含有糖类,还含有>4%的蛋白质和氨基酸,有利于细菌的生长,因此麦芽浸粉是黏质沙雷氏菌产舍雷肽酶的合适碳源,进而考察其质量浓度(4~14 g/L)对酶活的影响,结果如图2所示。由图2可知:当麦芽浸粉质量浓度低于10 g/L时,酶活随其浓度的增加而增加;当其达到12 g/L以上时,酶活则开始有所下降,因此合适的麦芽浸粉质量浓度为10 g/L。

图2 麦芽浸粉质量浓度对产舍雷肽酶活力的影响Fig.2 Effect of malt extract concentration on the production of serrapeptase
2.1.2 氮源种类及浓度对产酶活力的影响
以10 g/L的麦芽浸粉作为培养基的碳源,考察不同氮源对产酶活力的影响。培养基中分别添加10 g/L的牛肉膏、蛋白胨、酪蛋白、酵母浸粉、脱脂奶粉,以及5 g/L牛肉膏+5 g/L酵母浸粉(简称牛+醇)、5 g/L牛肉膏+5 g/L蛋白胨(简称牛+蛋),不同氮源对产酶活力的影响如图3所示。由图3可知:当以5 g/L牛肉膏+5 g/L酵母浸粉作为氮源时,虽然菌体干质量得率低于脱脂奶粉为氮源,但酶活显著高于其他种类的氮源,此时酶活为360.2 U/mL。进一步分别考察牛肉膏和酵母浸粉质量浓度对产酶活力的影响。

图3 不同氮源对产舍雷肽酶活力的影响Fig.3 Effect of nitrogen sources on the production of serrapeptase
保持酵母浸粉的质量浓度5 g/L不变,考察牛肉膏质量浓度(2~14 g/L)对产酶活力的影响,结果如图4所示。由图4可知:提高产酶培养基中牛肉膏质量浓度,产酶活力并没有提高,而当其质量浓度高于5 g/L时,酶活反而有所降低。
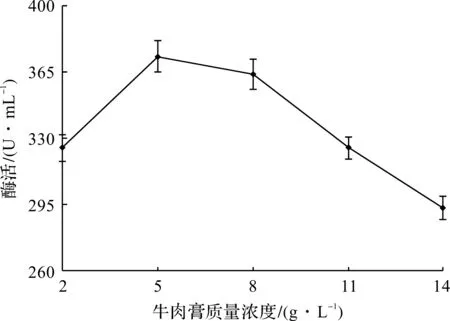
图4 牛肉膏质量浓度对产舍雷肽酶活力的影响Fig.4 Effect of beef extract concentration on the production of serrapeptase
保持牛肉膏质量浓度5 g/L不变,考察酵母浸粉质量浓度(2.5~15 g/L)对产酶活力的影响,结果如图5所示。由图5可知:当酵母浸粉质量浓度低于10 g/L时,酶活随其质量浓度增加而增加,之后酶活开始有所下降。因此合适的酵母浸粉质量浓度为10 g/L,此时,酶活为392.0 U/mL。
2.1.3 无机盐种类对产舍雷肽酶的影响
无机盐是微生物生长以及合成代谢产物不可缺少的营养成分,选取微生物培养基常用的无机盐ZnSO4(1 g/L)、MgSO4(1 g/L)、MnSO4(1 g/L)、KH2PO4(5 g/L)和K2HPO4(5 g/L),分别添加到培养基中,它们对产酶活力的影响如图6所示。由图6可知:当产酶培养基中加入1 g/L的ZnSO4、1 g/L的MgSO4和5 g/L的K2HPO4时,菌体干质量得率和产酶活力均有提高。培养基中同时添加这3种无机盐的实验结果表明酶活达到564.7 U/mL。
2.2 响应面实验优化结果与分析
2.2.1 设计方案和实验结果
由单因素实验结果可知:麦芽浸粉、酵母浸粉与牛肉膏的质量浓度对舍雷肽酶的酶活Y的影响较大。微生物培养基中的碳源和氮源往往存在交互作用,因此采用Box-Behnken中心组合设计的响应面实验优化它们的质量浓度,因素水平以及编码设计如表1所示,实验结果如表2所示。

表1 Box-Behnken实验设计的因素和水平及编码Table 1 Factors and levels for Box-Behnken experiment

表2 Box-Behnken实验设计结果Table 2 Results of Box-Behnken experiment
2.2.2 响应面模型及显著性分析
运用Design-Expert V12对表2中的实验结果进行二次多项式回归拟合,得到以编码因素表示的回归模型方程:Y=568.8+48.0A+15.4B+43.6C+4.05AB+7.95AC+26.4BC-71.3A2-62.4B2-45.9C2。

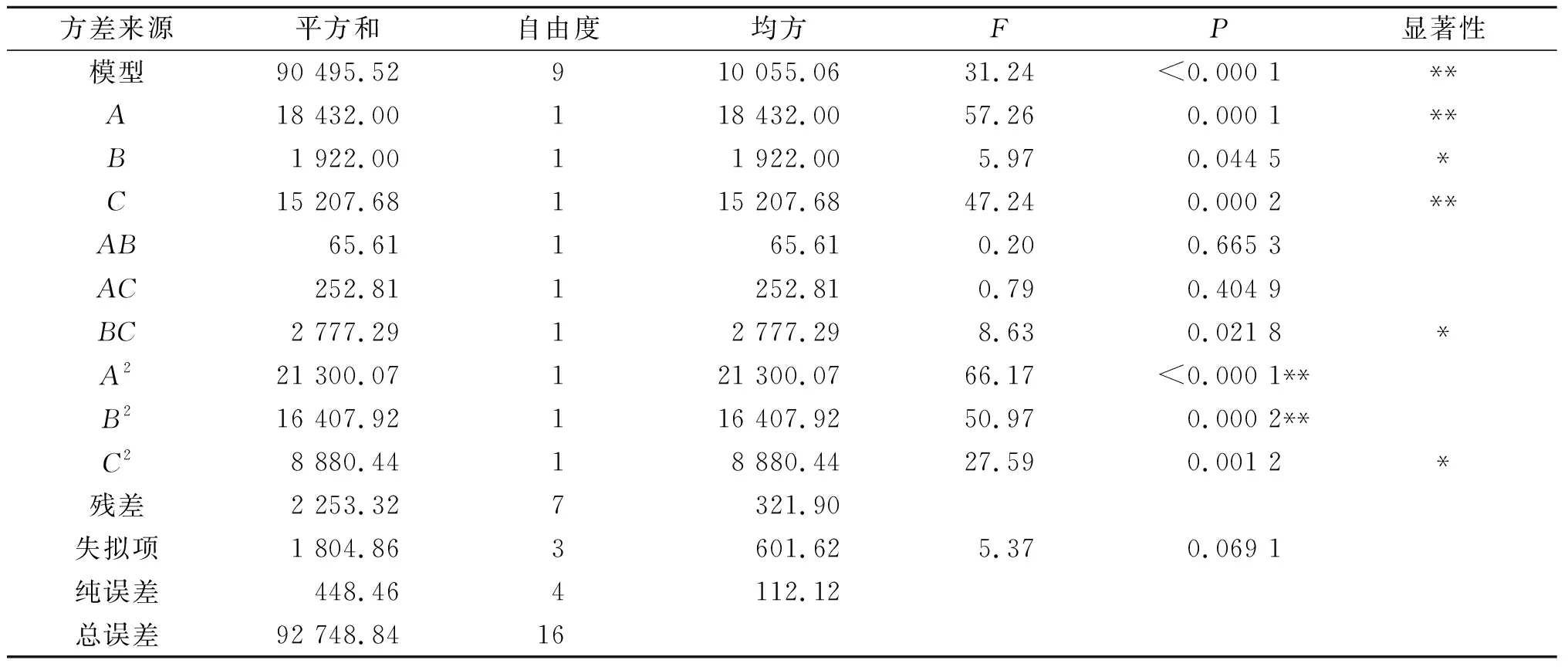
表3 回归模型方差分析Table 3 Analysis of variances of the regression model
由Design-Expert V12软件得到的麦芽浸粉质量浓度、酵母浸粉质量浓度和牛肉膏质量浓度3个因素之间的模型响应面图如图7所示。由图7可以直观地看出各因素对酶活影响的变化趋势,其中麦芽浸粉质量浓度对酶活的影响较大,随着其质量浓度的增加,酶活先有提高后降低,其次是牛肉膏浓度,虽然酵母浸粉质量浓度对酶活的影响相对较小,但是也达到了显著水平(P<0.05)。

图7 各因素交互作用对产舍雷肽酶活力影响的响应面图Fig.7 Response surfaces showing the effects of factors on the production of serrapeptase
2.2.3 优化结果验证
依据Design-Expert V12给出的最佳产酶条件:A=0.38,B=0.26,C=0.58,即麦芽浸粉质量浓度为11.9 g/L,酵母浸粉质量浓度为11.3 g/L,牛肉膏质量浓度为6.45 g/L,酶活最大预测值为592.5 U/mL。依据上述优化值做验证实验,3次实验的平均值为596.4 U/mL,与最大预测值基本相符,说明该模型有较高的准确性和实用性。经响应面分析实验优化,黏质沙雷氏菌LL-413发酵产酶活力从564.7 U/mL增加到596.4 U/mL,提高了5.67%。
2.3 培养基初始pH对产舍雷肽酶的影响
合适的培养基初始pH有利于菌体生长及产酶活力的提高,在确定培养基成分后,考察培养基初始pH对产酶活力的影响,结果如图8所示。由图8可知:当培养基初始pH低于8.0时,随着pH增加,酶活也随之增加;当培养基初始pH为8.0时,舍雷肽酶活力最高,这说明因舍雷肽酶属于碱性蛋白酶,偏碱性的培养环境有利于产酶活力的提高。

图8 培养基初始pH对产舍雷肽酶活力的影响Fig.8 Effect of the medium initial pH on the production of serrapeptase
2.4 产酶培养的时间曲线
初始产酶培养时间为24 h,经过培养基组成优化后,营养成分的质量浓度都有提高,24 h的培养时间可能不足,为此考察培养时间对产酶活力的影响,产酶培养的时间曲线如图9所示。由图9可知:产酶培养基接种后,菌体很快进入对数生长期;28 h后,虽然菌体生长达到平稳期,但是酶活还在继续增加;36 h时达到最大值,此时酶活为1 121 U/mL,菌体干质量得率为5.33 g/L。综上,合适的产酶培养时间为36 h。

图9 培养时间对产舍雷肽酶活力的影响Fig.9 Effect of fermentation time on the production of serrapeptase
3 结 论
通过单因素实验,发现麦芽浸粉、酵母浸粉与牛肉膏的质量浓度对舍雷肽酶的酶活的影响较大,因此采用Box-Behnken中心组合设计和Design-Expert V12软件对麦芽浸粉、酵母浸粉与牛肉膏的质量浓度进行优化,得到优选产酶培养基组成,在此基础上考察培养基初始pH和培养时间对产酶活力的影响,最终得到较优培养条件:麦芽浸粉11.9 g/L,酵母浸粉11.3 g/L,牛肉膏6.45 g/L,MnSO41 g/L,ZnSO41 g/L,K2HPO45 g/L,NaCl 5 g/L,初始pH 8.0,温度30 ℃,振荡转速200 r/min,接种量1%,培养时间36 h。在此条件下,黏质沙雷氏菌产舍雷肽酶活力达到1 121 U/mL,较优化前提高了3.89倍。笔者的研究结果为黏质沙雷氏菌产舍雷肽酶的工业化应用提供了参考。
