大叶紫薇炭疽病病原的鉴定及生物学特性
2022-11-29刘芝妤李增平
刘芝妤,李增平,张 宇
(海南大学 植物保护学院/热带农林生物灾害绿色防控教育部重点实验室,海口 570228)
大叶紫薇[Lagetstroemia speciosa(L.) Pers.],又称大花紫薇,原产于亚洲的热带地区,在我国的海南、广东、广西、四川、云南等省均有种植。大叶紫薇具有校高的药用价值和观赏价值,其提取物具有敛疮、解毒、凉血止血等功效,同时,园林绿化种植大叶紫薇移栽成活率极高,全年可观花的时间长达7个月[1−2]。2001年,朱爱萍等[3]对紫薇的白粉病(Uncinula austruliana)进行了生物学特性和致病性研究。2007年,翁殊斐等[4]对大花紫薇进行病虫害检索表的编制与综合防治,主要报道了大叶紫薇的斑点病(Phyllosticta lagerstroemiae)以 及 炭 疽 病(Colletotrichum gloeosporioides)。2009年,吴建民[5]对大叶紫薇褐斑病(Brown spot)和煤污病(Sooty mold)的症状、发生规律以及防治方法进行了报道。炭疽菌引起的植物炭疽病可导致寄主植物出现叶斑、枝枯等症状,甚至出现植株枯死。严重的植物炭疽病还可导致在种植产业上发生重大的经济损失。胶孢炭疽菌(Colletotrichum gloeosporioides)是一种常见的引发多种植物炭疽病的病原真菌,其侵染的寄主种类丰富,分布范围广,但近年来发现其包含有多个复合种,炭疽病在我国虽有大量报道,但对热带林木炭疽病的调查以及鉴定偏少[6]。目前,只有少量的文献中提及到大叶紫薇炭疽病的病原菌为胶孢炭疽菌,但是尚未见到大叶紫薇炭疽病的致病性测定、分子鉴定及生物学特性等方面的详细报道。因此,笔者在海南发现的大叶紫薇炭疽病病树上采集病叶,并进行病原菌的分离培养和致病性测定,同时采用形态学结合分子生物学手段进行病原菌的种类鉴定及其生物学特性研究,旨在进一步明确大叶紫薇炭疽病的病原菌种类,为后续研究其发病规律及诊断防治等提供理论依据。
1 材料与方法
1.1 研究材料大叶紫薇炭疽病病叶,于2020−12−13从海南省海口市世纪公园发病的大叶紫薇上采集病叶,带回实验室进行室内镜检,初步鉴定后分离菌株,并制作病叶标本保存,保存于实验室。
1.2 培养基PDA[Potato Dextrose Agar(Medium)]、PSA(Potato Saccharose Agar)、OMA(Oatmeal Agar)、CA(Cellulose Acetate)、CMA(Corn Meal Agar)、Czapek(Czapek Dox Agar)[7−8]。
1.3 试剂及仪器DNA提取试剂盒OMEGA Fungal DNA Kit购自美国OMEGA公司,2×Taqplus PCR Master Mix购自Biosharp公司。摄影生物显微镜为日本Olympus BX-51。
1.4 菌株的分离纯化采用常规的组织分离法,将病叶从病健交界处切取5 mm左右的小块,放入酒精中浸泡10 s后再放入0.1%升汞溶液中浸泡1 min,最后用灭菌水冲洗3次,置于空白培养皿风干并放置到PDA培养基平板上培养。28 ℃恒温黑暗条件下于斜面上保存分离得到的菌株备用。待菌丝生长到适宜大小,产孢后,再进行单孢分离纯化,从多个生长相同的菌株中选择生长良好的菌株,编号备用(菌株编号为DYZWTJ001)[9]。
1.5 致病性的测定将经28 ℃黑暗培养5 d的DYZWTJ001菌株的PDA平板用打孔器打成直径(d)为5 mm的菌饼。采用刺伤和无伤接种法,将菌丝面紧贴于经表面消毒处理的健康大叶紫薇叶片伤口上。对照接无菌的PDA。DYZWTJ001菌株经28 ℃黑暗培养7 d后,收集分生孢子,用无菌水洗脱菌落表面的分生孢子,制成分生孢子浓度为2×106个·mL−1的悬浮液;将一部分孢子悬浮液滴到经表面消毒处理的健康大叶紫薇叶片伤口上,将另一部分孢子悬浮液喷施在无刺伤的嫩叶上,对照接无菌水[10]。将接种好的叶片保湿后放置到(28±0.5)℃的黑暗培养箱中,28 ℃恒温培养7 d,并定期观察其发病情况,每处理设置3个重复。
1.6 病原菌的形态学鉴定DYZWTJ001菌株培养7 d后,观察菌落的正、反面颜色及边缘形状。挑取培养物用摄影生物显微镜对病原菌的显微结构进行拍照、观察和测量。观察分生孢子盘以及分生孢子,记录其形态特征并测量分生孢子盘以及分生孢子的大小。
1.7 病原菌的分子鉴定将DYZWTJ001菌株置于PDA培养基培养7 d后,使用OMEGA Fungal DNA Kit提取其总DNA。采用通用引物ITS[11](ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′)、ACT[12](ACT-512F:5′-ATGTGCAAGGCCGGTTTCGC-3′:ACT-783R:5′-TACGAGTCCTTCTGGCCCAT-3′)、GADPH[13](GDF:5′-GCCGTCAACGACCCCTTCAT TGA-3′;GDR:5′-GGGTGGAGTCGTACTTGAGC ATGT-3′)和 CHS[12](CHS-97F:5′-TGGGGCAAGG ATGCTTGGTTGAAG-3′;CHS-354R:5′-TGGAAG AACCATCTGTGAGAGTTG-3′)进行PCR扩增[14−15]。将扩增产物纯化、回收后送生工生物工程(上海)股份有限公司进行序列测定。将所获的序列在 NCBI 进行Blast比对,并提交序列。用Sequence Matrix软 件 进 行 序 列 拼 接,使 用MEGA7.0软件以最大似然法(Maximum Likelihood)构建系统发育树[16]。
1.8DYZWTJ001菌株生物学特性的测定选用PDA、PSA、OMA、CA、CMA、Czapek培养基制作平板,用于测试DYZWTJ001菌株在不同培养基上的生长影响。PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂10 g、蒸馏水1 000 mL;PSA培养基:马铃薯200 g、蔗糖20 g、琼脂20 g、蒸馏水1 000 mL;OMA培养基:燕麦片30 g、蒸馏水1 000 mL、琼脂20 g,在60 ℃下水浴1 h,双层纱布过滤去渣,补足水至1 000 mL,加入琼脂;CA培养基:新鲜胡萝卜200 g切成小片,加蒸馏水500 mL,用组织捣碎机捣碎约40 s,用4层纱布过滤去渣,补足水至1 000 mL,加入琼脂13 g;CMA培养基:玉米粉300 g、蒸馏水1 000 mL、琼脂20 g,在60 ℃下水浴1 h,双层纱布过滤去渣,上清液补足水至1 000 mL,加入琼脂;Czapek培养基:七水硫酸镁0.5 g、磷酸氢钾1 g、氯化钾0.5 g、硝酸钠2 g、蔗糖30 g、七水硫酸亚铁0.01 g、水1 000 mL。将菌株DYZWTJ001菌丝块置于平板中央,在相同温度(28 ℃)下培养5 d后,使用十字交叉法量取菌落的直径,每个处理重复3次。
测试不同温度条件下DYZWTJ001菌株生长的影响。在超净工作台里用直径0.5 mm打孔器从菌株DYZWTJ001菌落边缘取菌丝块,将菌丝块接种在PDA平板上,分别置于10、15、20、25、28、33、35 ℃共7个不同温度条件下进行恒温暗培养,5 d后使用十字交叉法量取其菌落的直径,每个处理重复3次。
测试不同pH值条件下DYZWTJ001菌株生长的影响。将已灭菌的PDA培养基冷却至50 ℃左右,使用1 mol·L−1的 HCl溶液和1 mol·L−1的NaOH溶液将PDA培养基的pH值调至2、3、4、5、6、7、8、9、10、11、12、13 共12个梯度后倒平板上,挑取菌株DYZWTJ001菌丝块置于平板中央,在28 ℃下培养,5 d后使用十字交叉法量取其菌落的直径,每个处理重复3次。
测试不同光照条件下DYZWTJ001菌株生长的影响。将菌株DYZWTJ001菌丝块接种于PDA平板中央,在28℃下分别置于光照24 h、黑暗24 h和光照:黑暗=12 h∶12 h条件下培养,5 d后使用十字交叉法量取其菌落的直径,每个处理重复3次。
1.9 数据处理利用SAS 8.1软件和Excel 2019软件对数据进行统计分析,采用Duncan’s multiple range test进行差异显著性分析。
2 结果与分析
2.1 大叶紫薇炭疽病的发病症状在海南发现的大叶紫薇炭疽病主要危害下层老叶。病斑多出现在叶尖和叶缘,叶面上也有少量发生。发病初期,在病叶上呈现红褐色小斑点,边缘具明显的亮黄色晕圈,继而病斑扩展为半圆形或不规则,褐色至灰白色,边缘具2~5 mm宽的紫红色或深褐色坏死带,病斑的外围出现明显的亮黄色的晕圈。潮湿条件下,病斑中央轮生小黑点。后期部分老病斑中央组织破裂出现穿孔,重病叶易脱落。
2.2 致病性的测定大叶紫薇炭疽病的致病性测定结果显示,接种3 d后,滴加分生孢子悬浮液在刺伤部分的老叶和喷施分生孢子悬浮液在无刺伤的嫩叶的处理均发病;接种4 d后,使用菌饼刺伤接种的老叶发病,老叶上未刺伤部分接种菌饼部分全部未发病,对照区域也未出现病变。接种7 d后,观察到叶片接种部位出现橘红色分生孢子团(图1)。从接种发病部位再分离获得的菌株与最初分离的DYZWTJ001菌株形态相同,证明DYZWTJ001菌株为大叶紫薇炭疽病的病原菌。

图1 大叶紫薇炭疽病的致病性测定结果
2.3 病原菌的形态学鉴定病原菌在自然生长5 d后的PDA培养基表面菌落的平均直径为6.9 cm。观察到其菌落上的菌丝非常的致密,表面蓬松,中心呈灰色,边缘呈白色,背面中心呈橘红色,边缘呈白色。分生孢子为单胞,整体呈现圆柱状,两端无色且钝圆,大小为(13.59~15.83)μm×(4.60~6.51)μm。分生孢子盘褐色,椭圆形,大小为(72.27~77.05)μm×(35.25~37.46)μm(图2)。

图2 大叶紫薇炭疽病病菌形态
2.4 病原菌的分子鉴定将测序后的各基因序列提交至GenBank数据库获得序列号,获得DYZWTJ001菌株的 rDNA-ITS、ACT 、GADPH和CHS序列长度分别为550 bp(NCBI 登录号为MZ955449) 、257 bp(NCBI 登录号为MZ955450)、251 bp(登录号为MZ955451)和283 bp(登录号为OM867674)。在NCBI数据库中选取 rDNA-ITS、ACT 和GADPH相关基因序列(表1),将3种序列拼接,利用MEGA 7.0软件联合构建系统发育树,结果(图3)表明,菌株DYZWTJ001与隐秘刺盘孢的遗传距离最小,在93%水平上聚为一支。结合形态学鉴定,确定DYZWTJ001菌株为隐秘刺盘孢(Colletotrichum aenigma)。
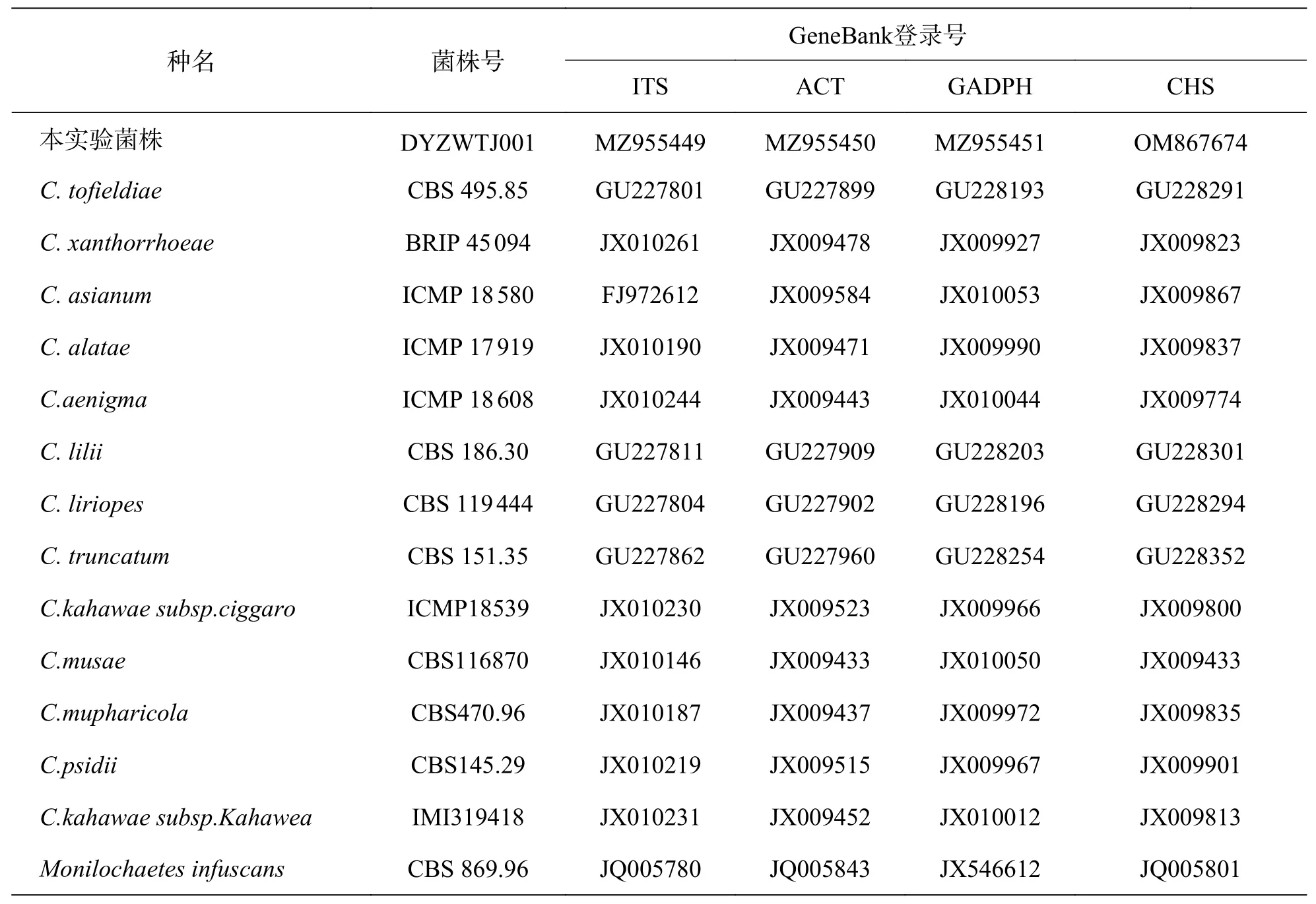
表1 参考菌株及其GeneBank登录号
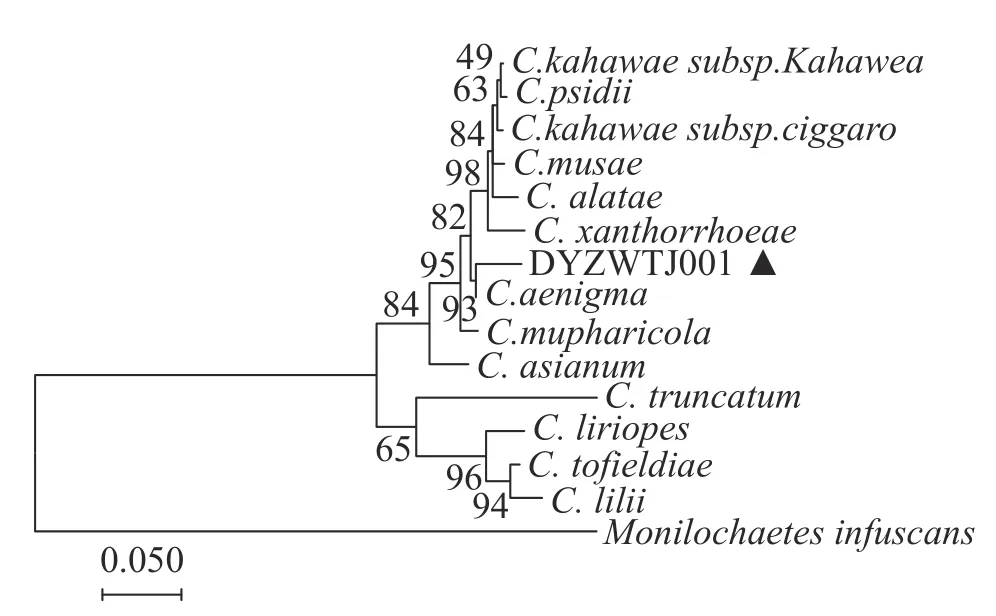
图3 基于 rDNA-ITS、ACT、GAPDH及CHS序列基础的菌株 DYZWTJ001 与其他炭疽菌相关种的系统发育树
2.5 生物学特性
2.5.1 不同培养基对菌丝生长的影响DYZWTJ001菌株均能在6种培养基上生长,其菌丝生长速度依次为PDA>PSA>CA>OMA>Czapek>CMA(表2)。培养基PDA和PSA下菌丝生长情况差异不显著(P<0.05)。

表2 不同培养基对DYZWTJ001菌丝生长的影响
2.5.2 不同温度对菌丝生长的影响菌株DYZWTJ001在不同梯度温度环境下培养5 d后,在20~32 ℃条件下均能生长,而在10 、15 、35 ℃条件下不能生长。20~30 ℃内,随温度的升高,菌落生长速度显著加快,30 ℃时病原菌菌落生长速度最快,菌落直径为6.92 cm,其次是28 ℃时病原菌菌落生长速度较快,菌落直径为6.70 cm,这两个温度下的菌落直径与其他温度下的菌落直径存在显著性差异(P<0.05),因此认定30 ℃为此炭疽菌最适生长温度;从30~32 ℃,菌丝生长速度随温度的升高而下降,到35 ℃时,病原菌完全停止生长(图4)。
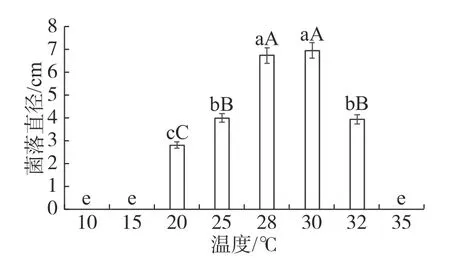
图4 不同温度培养DYZWTJ001菌株的菌落直径
2.5.3 不同pH对菌丝生长的影响菌 株DYZWTJ001在pH值为2时菌丝不能生长,在pH值3~13环 境 下 均 能 生 长。其 中,pH值 为8时,菌丝生长速度最快,菌落直径为5.86 cm,与其他pH值下的菌落直径存在显著性差异(P<0.05);之后随着pH值的升高,菌丝生长速率逐渐下降(图5),表明碱性条件比弱酸性条件更有利于菌丝的生长。
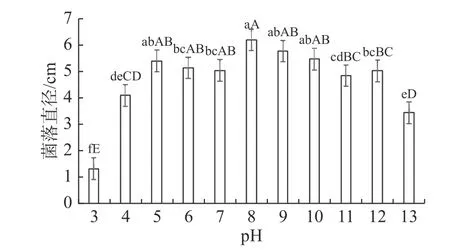
图5 不同 pH 条件下DYZWTJ001菌株的菌落直径
2.5.4 不同光照对菌丝生长的影响菌 株DYZWTJ001在不同光照条件下均能生长。在黑暗环境下,其生长速率最快,菌落直径达6.89 cm;全光处理次之,菌落直径达3.80 cm;光∶暗=12 h∶12 h处理生长最慢,菌落直径达3.81 cm(图6);光∶暗=12 h∶12 h处理和全光照处理间差异不显著(P<0.05),可见不同光照条件对此炭疽菌菌丝生长影响不大。

图6 不同光照下 DYZWTJ001 菌株的菌落直径
3 讨 论
本研究通过对大叶紫薇炭疽病的病原菌进行室内分离、纯化及致病性测定。利用ITS、ACT、GAPDH和CHS多基因序列分别对代表性菌株DYZWTJ001进行分子鉴定,确定该病原菌为隐秘刺盘孢(Colletotrichum aenigma)。进一步明确了引起海南大叶紫薇炭疽病的病原菌为隐秘刺盘孢。已有报道隐秘刺盘孢可引发苹果、辣椒、白木香、杨树等多种植物的炭疽病,这类病害主要分布在高温湿热的热带和亚热带地区,其寄主范围十分广泛[17]。大叶紫薇炭疽病菌的致病性研究结果表明,嫩叶的致病力显著高于老叶,老叶在刺伤的情况下才会发病,且嫩叶发病早于老叶,在嫩叶上接种发病扩散速度明显高于老叶。在老叶上,孢子悬浮液的侵染速度明显快于菌块,且病叶上极易产生大量分生孢子堆,可能会成为大叶紫薇炭疽病害传播的重要侵染源。因此,在大叶紫薇炭疽病防治阶段可以着重观测嫩叶上病害的发病情况,同时对于发病树叶以及病残体进行及时的清理,从而较好地防治大叶紫薇炭疽病。
显微镜下形态学观察其分生孢子无色,中间有油滴,单胞,呈长椭圆形状,这与前人研究结果基本一致[18]。通过对DYZWTJ001生物学特性研究结果表明,该菌株在20~32 ℃条件下均能生长,最适宜温度为30 ℃,这与前人研究炭疽菌结果基本一致[19]。DYZWTJ001在pH值3~13环境下均能生长,说明该菌株对于酸碱度的适应范围很广,对于强酸强碱环境也具有较强的适应性,其中最适宜的pH为8。培养基PDA与PSA的培养效果较好,这与前人的研究报道存在一定差异[20],可能是由于寄主植物不同,分离所获得的热带炭疽菌存在小种或生物型差异,而适宜该菌株的光照培养条件为24 h全黑暗,光照对其菌丝生长有抑制作用。因此,海南全年暖热,阴雨多湿,往往会引起大叶紫薇炭疽病发病扩散,对于高温多雨季节,应当加强防控,避免病害进一步加重以及扩散。
