经核苷(酸)类似物治疗的慢性乙肝患者血清乙肝病毒前基因组RNA的临床意义
2022-11-29曾伊凡王传敏何雨倩
曾伊凡 王传敏 何雨倩 陈 悦
慢性乙型肝炎(CHB)是由HBV持续感染导致的慢性肝脏炎症性疾病,与肝硬化和肝细胞癌的发生密切相关,每年有近百万患者因HBV感染导致相关疾病死亡[1-2],因此控制和治疗HBV感染具有重要意义。共价闭合环状DNA(cccDNA)是HBV复制的原始模板,检测不到时可作为判断HBV感染彻底治愈的理想指标[3]。然而cccDNA检测需行肝脏穿刺,这种有创性检查及其操作难度限制了cccDNA检测的广泛运用[4-6]。目前运用于判断抗HBV疗效指标有HBV DNA、HBV表面抗原(HBsAg)、HBV e抗原(HBeAg),但它们并不能准确反映肝组织内cccDNA活性[7-10]。外周血HBV前基因组RNA(pgRNA)仅来自cccDNA,特别是当病毒的逆转录过程被抑制时,更能准确反映cccDNA的存在及转录活性[9,11]。相关研究结果证实血清HBV pgRNA水平与肝细胞内cccDNA水平呈正相关[8,12-15],并有可能被用作核苷(酸)类似物(NAs)的疗效预测及指导患者安全停药的有效指标。因此,本研究将进一步探索HBV pgRNA检测的临床意义,综合评估其在临床中的应用价值。
对象与方法
1.对象:纳入2019年5月~2020年9月在我科门诊和病房确诊的CHB患者185例。CHB的诊断标准参考我国《慢性乙型肝炎防治指南(2019年版)》[16]。纳入标准:(1)年龄20~75岁;(2)HBV DNA<20 IU/ml(阴性);(3)接受48周、144周、240周Nas[恩替卡韦(ETV)或富马酸替诺福韦(TDF)]单药抗病毒治疗的CHB患者。排除标准:(1)同时合并其他病毒性肝炎(如甲、丙、丁、戊型肝炎病毒及其他病毒感染等)、自身免疫性肝病、遗传代谢性肝病、酒精或药物引起的肝病等;(2)免疫受损(服用化疗药物、糖皮质激素、免疫抑制剂等);(3)合并其他部位的原发肿瘤;(4)妊娠。根据接受NAs单药抗病毒治疗时间将185例患者分为48周组(53例)、144周组(61例)及240周组(71例)。本研究获得我院伦理委员会审核批准,所有患者均知情同意。
2.方法:收集患者的一般资料(年龄、性别、接受NAs单药抗病毒治疗时间)和治疗后的实验室检查结果(ALT、AST、HBsAg、HBV pgRNA检出率及其水平、HBeAg表达情况)。
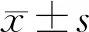
结 果
1.不同抗病毒治疗时间组患者的一般资料及实验室检查结果比较:185例患者中未发现HBsAg完全清除者。48周组、144周组及240周组患者性别、年龄、ALT、AST水平比较差异均无统计学意义(P>0.05)。240周组患者HBsAg水平低于48周组(P<0.05)。见表1。

表1 不同抗病毒治疗时间组患者的一般资料及实验室检查结果比较[M(P25,P75)]
2.不同抗病毒治疗时间组患者血清HBV pgRNA检出率和水平比较:经NAs单药抗病毒治疗后,185例患者血清HBV pgRNA的检出率为56.22%(104/185)。48周组、144周组及240周组患者血清HBV pgRNA检出率和水平比较差异均有统计学意义(P<0.05)。HBV pgRNA的检出率和水平随抗病毒治疗周期增长而下降,144周组和240周组患者HBV pgRNA检出率均低于48周组,144周组和240周组患者HBV pgRNA水平均低于48周组,240周组患者HBV pgRNA水平低于144周组(P<0.05)。见表2。

表2 不同抗病毒治疗时间组患者血清HBV pgRNA检出率和水平比较[M(P25,P75)]
3.HBeAg阳性组和HBeAg阴性组患者血清HBV pgRNA检出率和水平比较:根据治疗后HBeAg表达情况将185例患者分为HBeAg阳性组(53例)和HBeAg阴性组(132例)。HBeAg阳性组血清HBV pgRNA检出率和水平均显著高于HBeAg阴性组(P<0.05)。见表3。
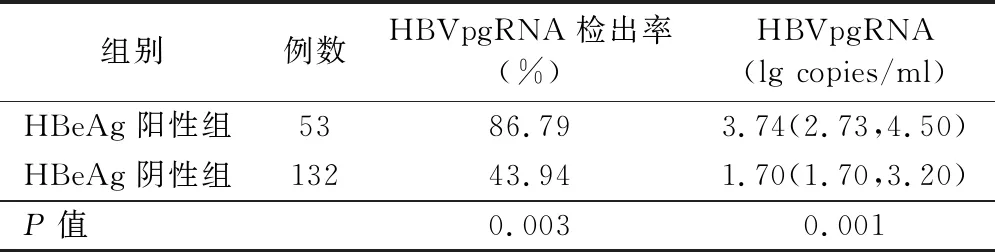
表3 HBeAg阳性组和HBeAg阴性组患者血清HBV pgRNA检出率和水平比较[M(P25,P75)]
4.血清HBV pgRNA与HBsAg的相关性分析:Spearman相关分析结果显示,经NAs治疗的CHB患者血清HBV pgRNA水平与HBsAg水平呈正相关(r=0.425,P<0.001)。HBeAg阳性患者HBV pgRNA水平与HBsAg水平呈正相关(r=0.404,P<0.01),HBeAg阴性患者HBV pgRNA水平与HBsAg水平无相关性(r=0.266,P>0.05)。
讨 论
在外周血中寻找能有效反映HBV转录活性并用于观察抗HBV药物治疗效果的生物标志物一直是一个挑战。Wang等[14]纳入47例接受ETV单药治疗超过1年且HBV DNA低于检测下限的CHB患者,其中35例(74.47%)血清HBV pgRNA为阳性,通过分析血清HBV pgRNA与肝脏组织学评分的关系,发现其与肝脏组织病理学有关。Wang等[17]对33例在治疗结束时HBV DNA低于检测下限的CHB患者血清HBV pgRNA进行检测发现,63.64%(21/33)的CHB患者血清HBV pgRNA仍呈阳性,观察发现所有患者在治疗结束后24周内出现病毒学反弹。然而,在12例未检测出HBV pgRNA的CHB患者中,仅3例出现病毒学反弹,表明HBV pgRNA水平可能与停止NAs治疗后病毒复发有关,其他两项研究也支持这一结论[7,18]。
本研究纳入185例经ETV或TDF单药抗病毒治疗且HBV DNA<20 IU/ml的CHB患者,发现56.22%(104/185)患者血清HBV pgRNA为阳性,与上述研究结果一致,说明仅检测HBV DNA来评估患者抗病毒疗效有一定的局限性。本研究比较了经NAs治疗不同疗程(48周、144周、244周)患者的血清HBV pgRNA检出率及血清HBV pgRNA和HBsAg水平,发现HBV pgRNA检出率随着治疗时间增长而逐渐下降,抗病毒治疗244周时仍有一部分患者可检测出HBV pgRNA。因此,CHB患者即使经NAs治疗5年,在通过检测HBV DNA、HBsAg、HBeAg去评估抗病毒疗效或指导患者停药时,建议同时检测HBV pgRNA。本研究中144周组和240周组患者血清HBV pgRNA水平均低于48周组,240周组患者血清HBV pgRNA水平低于144周组,而240周组患者HBsAg水平低于48周组,间接说明在NAs抗病毒治疗过程中,运用血清HBV pgRNA连续监测抗病毒疗效可能优于HBsAg。
Van Campenhout等[10]的研究发现,HBeAg状态是与HBV pgRNA水平独立相关的最强因素。其他相关研究结果发现血清HBV pgRNA水平可作为预测NAs治疗HBeAg阳性患者血清学反应的新型标志物[19-20]。本研究结果发现HBeAg阳性组患者HBV pgRNA检出率和水平均显著高于HBeAg阴性组,与其他学者的研究结果一致[21],可能是因为与HBeAg阴性患者相比,HBeAg阳性患者的cccDNA转录活性更高。
本研究发现经NAs治疗的CHB患者HBV pgRNA水平与HBsAg水平呈正相关,且主要体现在HBeAg阳性患者中,而在HBeAg阴性患者中则两者相关性消失,与其他研究相似[9-10,12,22]。一种可能的解释为在HBeAg阴性患者中,HBsAg可能不仅来自cccDNA,且还来自整合的HBV DNA片段。Liao等[23]通过对57例长期接受NAs抗病毒治疗的患者进行随访研究,发现HBV pgRNA水平与HBsAg水平无相关性。研究结果不同的原因可能与纳入样本量大小和HBV pgRNA检测方法不同有关。值得注意的是,本研究中经NAs治疗的CHB患者HBV pgRNA水平与HBsAg水平虽然呈正相关,但相关程度并不高,较弱的相关系数可能与病毒变异的积累和临床研究宿主遗传背景的多样性有关。Luo等[19]通过对接受NAs抗病毒治疗平均时间超过7年的患者进行研究,发现约50%的患者肝组织中未检测到cccDNA,仅有1例患者血清HBsAg转阴。本研究纳入的185例患者HBV DNA均为阴性,一部分患者血清HBV pgRNA为阳性,未发现HBsAg完全清除患者,说明运用HBsAg来评估抗病毒疗效并指导患者停药具有一定的局限性,可能造成患者接受不必要的抗病毒治疗,与其他研究结果一致[24-25]。
综上所述,当HBV DNA低于检测下限时,血清HBV pgRNA可作为一种新型标志物用于临床,以持续监测肝脏内cccDNA水平。遗憾的是由于大多数患者对肝脏穿刺组织病理检查存在抗拒,因此本研究未纳入相关的肝脏组织学标本,未能直接评估cccDNA与HBV pgRNA的相关性,且本研究是一项横断面研究,研究病例数较少,结果可能存在一定偏倚。血清HBV pgRNA能否作为监测HBV患者病毒学应答、疗效观察及指导停药的新型标志物,需要前瞻性大样本试验进一步探究。
