香芹酚-壳聚糖纳米颗粒的制备及抑菌活性研究
2022-11-29邢承宇王璐陈星光陆健吴殿辉
邢承宇,王璐,陈星光,陆健*,吴殿辉*
1(粮食发酵与食品生物制造国家工程研究中心(江南大学),江苏 无锡,214122)2(工业生物技术教育部重点实验室,生物工程学院(江南大学),江苏 无锡,214122)3(江苏省生物活性制品加工工程技术研究中心,江苏 无锡,214122)
禾谷镰刀菌(Fusariumgraminearum)是引起谷物赤霉病(fusarium head blight,FHB)的主要微生物[1],在侵染谷物时会产生脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)等真菌毒素[2]。DON对人和动物均具有高危害性,会引起腹痛、腹泻、肠胃炎等疾病[3]。为了保障食品的安全性,可以通过抑制产毒真菌的生长来降低谷物污染[4]。目前抑制谷物中真菌生长和毒素积累的方法主要有化学法、物理法和生物脱毒法。化学法是向采后谷物喷洒咪唑类、硫氰酸类等人工合成杀菌剂,这些杀菌剂在后期加工过程中有显著残留且难以降解,并且有致癌、致畸形的风险[5]。物理法包括辐照法、高温脱毒处理法等[6],虽然物理法不会引入有毒物质,但是在处理谷物过程中会降低谷物的营养价值。生物法包括酶解去毒技术、微生物代谢解毒法等[7]。采用生物法抑制产毒真菌的生长不会破坏谷物中的营养物质,但是有可能引入其他微生物造成二次污染[8]。因此,开发新型的绿色抗菌剂仍然是控制粮食霉变和保障食品安全的重要途径之一。
作为天然产物,植物精油具有多样的抗菌特性,同时在使用过程中不会污染环境[9]。香芹酚是一种单萜酚,是百里香和牛至等植物精油的主要活性成分[10],具有抑制或者杀死微生物的特性[11]。因其天然安全性和良好的抑菌活性已被美国和欧洲批准为食品添加剂[12],世卫组织表明适量浓度的香芹酚可用于食品保鲜,且不会对身体健康产生负面影响[13]。王新伟等[14]采用纸片扩散法及双倍稀释法研究了香芹酚对黑曲霉和面包酵母的抑菌效果,结果表明香芹酚在0.125 μL/mL时抑制了面包酵母的生长,在0.062 5 μL/mL时抑制了黑曲霉的生长,是一种良好的食品抗菌剂。然而,与其他精油一样,香芹酚是挥发性化合物,在食品加工、药物配制和抗菌膜制备等过程中容易蒸发或分解[15]。近年来,新兴的纳米封装技术已被广泛应用于生物活性物质的包埋和递送,为了克服香芹酚在加工和贮存过程中的敏感性,可以通过纳米封装技术提高其稳定性。
壳聚糖是甲壳质的脱乙酰形式,对真菌、革兰氏阳性菌和革兰氏阴性菌均具有不同抗菌活性[16]。由于其无毒、吸附性强、可降解、生物活性高等特点,壳聚糖已广泛应用于食品、医药、环境和农业等领域[17]。HOSSEINI等[18]研究了壳聚糖和苯甲酸制成的纳米凝胶对百里香精油的包封作用。在密封条件下,百里香精油壳聚糖纳米凝胶对黄曲霉的最低抑制质量浓度为300 mg/L,而游离百里香精油在>400 mg/L时才能完全抑制黄曲霉的生长。ALTAN等[19]成功制备了负载丁香油的壳聚糖纳米颗粒,对单核细胞增生李斯特菌(Listeriamonocytogenes)和金黄色葡萄球菌(Staphylococcusaureus)有很高的抗菌活性,负载丁香油的壳聚糖纳米颗粒的抑菌圈明显大于游离的丁香油,说明纳米颗粒的制备可以显著提高丁香油的抑菌特性。
壳聚糖经纳米化后具有更小的粒径和更高的比表面能,可以提高纳米壳聚糖的生物活性。采用壳聚糖纳米颗粒包埋天然植物精油或其抑菌成分可以提高抑菌物质的稳定性、控制释放速率、屏蔽浓度过高的气味,达到缓释长效抑菌效果,从而拓宽天然精油的应用范围。本研究选取抑菌性能较好的香芹酚,通过乳化交联法制备香芹酚-壳聚糖纳米颗粒,优化香芹酚-壳聚糖纳米颗粒的制备工艺,通过冷场扫描电镜(field emission scanning eletron microscope,FESEM)、傅里叶红外扫描(Fourier transformed infra- red,FTIR)进行壳聚糖纳米颗粒的微观结构分析,测定了香芹酚-壳聚糖纳米颗粒的抑菌稳定性,并初步探讨了香芹酚-壳聚糖纳米颗粒的抑菌机制,以期为壳聚糖-纳米颗粒在食品中的应用提供理论支持。
1 材料与方法
1.1 实验材料
1.1.1 菌株
禾谷镰刀菌(Fusariumgraminearum)Fg-4为实验室保藏,分离自感染赤霉病的大麦。
1.1.2 试剂及仪器
香芹酚、高分子量壳聚糖(脱乙酰度75%~80%),麦克林生化科技有限公司;三聚磷酸钠(tri- polyphosphate,TPP),阿拉丁(试剂)有限公司;吐温80、乙酸,国药集团化学试剂有限公司;碘化丙啶PI染液,上海源叶生物科技有限公司。
Nano-ZSE纳米粒度及zeta电位分析仪,英国马尔文仪器有限公司;Quanta200扫描电子显微镜(scanning electron microscope,SEM),荷兰FEI公司;T30k手持式匀浆机,上海班诺生物科技有限公司;Nicolet is 10傅里叶变换红外光谱仪,美国赛默飞世尔科技(中国)有限公司。TGA/DSC1/1100SF热重分析仪,梅特勒-托利多国际贸易(上海)有限公司;D2-PHASER X-射线衍射,德国布鲁克AXS有限公司;真空冷冻干燥机,宁波新芝生物科技股份有限公司;Ti-U倒置荧光显微镜,日本尼康公司。
1.1.3 培养基
马铃薯葡萄糖培养基(potato dextrose agar,PDA):取土豆200 g,去皮切块放入锅中,加入1 L蒸馏水,蒸煮土豆至绵而不烂(约20~30 min),纱布过滤,滤渣弃去,滤液加入葡萄糖20 g,琼脂15~20 g,溶解后蒸馏水定容至1 L,121 ℃灭菌20 min;
绿豆培养基(mung bean agar,MBA):40 g的绿豆加入1 L蒸馏水,煮沸30 min,纱布过滤,滤液加入15~20 g的琼脂,定容至1 L后121 ℃灭菌20 min;
羧甲基纤维素钠培养基(sodium carboxymethyl-cellulose,CMC):取15.0 g CMC用热水溶解,加入1.0 g KNO3,1.0 g NH4H2PO4,0.5 g MgSO4·7H2O,1.0 g酵母粉,定容至1 L,121 ℃灭菌20 min。
1.2 实验方法
1.2.1 香芹酚-壳聚糖纳米乳液的制备
参考HOSSEINI等[18]的方法制备香芹酚-壳聚糖纳米乳液并稍作修改。
吐温80添加量对香芹酚-壳聚糖纳米乳液稳定性的影响:将0、200、400、600、800、1 000 μL吐温80作为表面活性剂分别加入40 mL壳聚糖溶液中,并在室温下搅拌2 h,得到均匀的壳聚糖水溶液。将0.36 g香芹酚逐滴滴入上述40 mL壳聚糖水溶液中,使用手持均质机18 000 r/min下均质10 min,得到水包油乳液。向制得的水包油乳液中逐滴滴入40 mL 2 mg/mL的TPP溶液,滴加完成后用磁力搅拌器持续搅拌30 min,最后超声处理10 min,超声功率为100 W。
壳聚糖与香芹酚质量比对香芹酚-壳聚糖纳米乳液稳定性的影响:其他制备工艺参数不变,考察壳聚糖与香芹酚质量比(1∶0.7、1∶0.9、1∶1、1∶1.2、1∶1.4、1∶1.6)对香芹酚-壳聚糖纳米乳液稳定性的影响,确定最适的壳聚糖与香芹酚质量比。
三聚磷酸钠浓度对香芹酚-壳聚糖纳米乳液稳定性的影响:其他制备工艺参数不变,考察TPP质量浓度(0.5、1、1.5、2、2.5、3、3.5 mg/mL)对香芹酚-壳聚糖纳米乳液稳定性的影响,确定最适的TPP浓度。
超声时间对香芹酚-壳聚糖纳米乳液稳定性的影响:其他制备工艺参数不变,考察超声时间(0、4、8、12、16、20 min)对香芹酚-壳聚糖纳米乳液稳定性的影响,确定最适的超声时间。
1.2.2 香芹酚-壳聚糖纳米乳液粒径测定
参考WAN等[20]的方法采用Zetasizer Nano ZS激光衍射仪的动态光散射技术测量平均粒径。测量前,所有样品均通过0.22 μm滤膜过滤,所有测量均在25 ℃下进行3次扫描。
1.2.3 包封率测定
参考HOSSEINI等[18]的方法测量香芹酚-壳聚糖纳米乳液的包封率。将香芹酚-壳聚糖纳米乳液 5 mL 于4 ℃、9 000 r/min下离心10 min,取0.1 mL上清液,95%乙醇定容至5 mL,定容后在其最大吸收峰下测定吸光值,包封率为包封香芹酚的质量与原始质量之比,根据公式(1)计算:

(1)
1.2.4 香芹酚-壳聚糖纳米颗粒制备
将600 μL吐温80作为表面活性剂加入到40 mL壳聚糖溶液中,并在室温下搅拌2 h,得到均匀的壳聚糖水溶液。将0.48 g香芹酚逐滴滴入上述40 mL壳聚糖水溶液中,使用手持均质机18 000 r/min下均质10 min,得到水包油乳液。向制得的水包油乳液逐滴滴入40 mL 2.5 mg/mL的TPP溶液,滴加完成后用磁力搅拌器持续搅拌30 min,超声处理16 min,超声功率为100 W。将得到的香芹酚-壳聚糖纳米乳液在4 ℃,9 000 r/min条件下离心30 min,取沉淀,用去离子水洗涤3次,超声5 min,将纳米粒子分散在去离子水中,得到均匀的悬浮液。最后,将形成的悬浮液在-80 ℃预冻10 h,放入真空冷冻干燥机,冻干完成将干燥的香芹酚-壳聚糖纳米颗粒取出放入棕色密闭玻璃瓶,于4 ℃贮藏备用。不含香芹酚的壳聚糖纳米颗粒同香芹酚-壳聚糖纳米颗粒的制备方法相似,即在壳聚糖纳米乳液的制备过程中不添加香芹酚。
香芹酚-壳聚糖纳米颗粒的微观结构分析:参考SOTELO-BOYS等[21]的方法使用FESEM观察香芹酚-壳聚糖纳米颗粒的微观结构。在硅片上滴1滴样品悬液于阴凉处自然干燥,测试时直接将硅片置于样品仓,放大倍数为20~100 k。
香芹酚-壳聚糖纳米颗粒的化学组成分析:参考TASTAN等[22]的方法,使用Nicolet is 10红外光谱仪测定香芹酚-壳聚糖纳米颗粒的FTIR。分辨率为1 nm,在500~3 500 cm-1扫描/采样200次。
1.2.5 香芹酚-壳聚糖纳米颗粒的抗菌稳定性分析
将禾谷镰刀菌作为测试菌株,禾谷镰刀菌Fg-4从实验室大麦原料中分离获得。
参考WAN等[20]等的方法采用微孔稀释法测定香芹酚和香芹酚-壳聚糖纳米颗粒抑制镰刀菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。
为了评价香芹酚-壳聚糖纳米颗粒在贮藏期间的稳定性,将香芹酚-壳聚糖纳米颗粒和香芹酚分别置于35 ℃恒温箱加速贮藏50 d,分析贮藏期间第0、10、20、30、40、50天时2×MIC当量的香芹酚-壳聚糖纳米颗粒和香芹酚对禾谷镰刀菌Fg-4菌株的菌丝抑制率。
向装有30 mL灭菌的PDA液体培养基的锥形瓶中分别加入香芹酚和香芹酚-壳聚糖纳米颗粒使其终质量浓度为60 μg/mL,向液体培养基中加入50 μL菌丝,然后将锥形瓶置于30 ℃,140 r/min的摇床内培养48 h,待锥形瓶内长出菌丝球后用定量滤纸过滤去掉培养基和抑菌物质,得到菌丝。菌丝放置于烘箱内,在105 ℃下烘干2 h,待其恒重后称量菌丝质量,重复称重3次,每次质量之差不超过0.005 g,取平均值作为最终干菌丝质量,计算菌丝抑制率如公式(2)所示:

(2)
1.2.6 香芹酚-壳聚糖纳米颗粒对菌丝体的破坏作用
接种1块禾谷镰刀菌菌饼于PDA平板中央,27 ℃下培养4 d进行活化,用打孔器于菌落边缘打一新鲜菌饼,复接种于新鲜PDA平板中央,27 ℃下培养60 h。取2 mL香芹酚质量浓度为40 mg/mL香芹酚-壳聚糖纳米颗粒加至菌落边缘,灭菌的乙酸盐缓冲液作为空白对照,27 ℃下继续培养36 h。参考WU等[23]的方法,使用SEM观察香芹酚-壳聚糖纳米颗粒对真菌菌丝体的破坏作用。
2 结果与分析
2.1 香芹酚-壳聚糖乳液制备
不同因素对香芹酚-壳聚糖乳液稳定性的影响如图1所示,当吐温80添加量从0增加到2.5%(体积分数),粒径从480 nm降低到101 nm,吐温80的乳化和包埋作用增强。这可能是因为当表面活性剂质量分数较高时,大量的表面活性剂在油-水界面吸附,其吸附速率随浓度增加,并会使界面张力显著降低,从而更有利于小乳滴形成。吐温80添加量为1.5%(体积分数)时,包封率最大,包封率为49%,粒径<150 nm,因此,吐温80的添加量选择为1.5%(体积分数)。
当壳聚糖与香芹酚质量比从1∶0.5增加到1∶1.6时,粒径从110 nm增加到180 nm,随着壳聚糖与香芹酚质量比的增加,包封率先增加后减小,这是由香芹酚的负载量饱和所致。当壳聚糖与香芹酚质量比为1∶1.2时,包封率最大,包封率为55%,粒径<200 nm。因此,壳聚糖与香芹酚的质量比选择为1∶1.2。
当TPP质量浓度从0.5 mg/mL增加到3.5 mg/mL,粒径从101 nm增加到450 nm,这是因为TPP与壳聚糖发生了静电相互作用,使得粒径增大,当TPP质量浓度> 2.5 mg/mL时,包封率明显下降,这是因为当TPP浓度过大时,凝絮沉淀,包封率降低。因此TPP的最适质量浓度为2.5 mg/mL。
超声时间对包封率的影响较小,超声时间由0 min 增加至20 min,包封率在40%~45%变化,随着超声时间的增加,粒径先降低后增加,粒径的降低是因为随着超声时间的延长,部分聚集的较大液滴得到有效破坏。而当超声时间过长时,香芹酚-纳米乳液液滴粒径稍有增加,这意味着乳液的再聚集。FLORIS等[24]报道中等时间的超声处理会使乳液的液滴粒径下降至最小值,较长时间的超声处理反而导致液滴粒径出现小幅度增加。因此,制备香芹酚-壳聚糖纳米乳液的最佳超声时间为16 min。
香芹酚-壳聚糖纳米乳液的最佳制备工艺为:吐温80的添加量为1.5%(体积分数),糖酚质量比为1∶1.2,TPP质量浓度为2.5 mg/mL,超声时间为16 min。
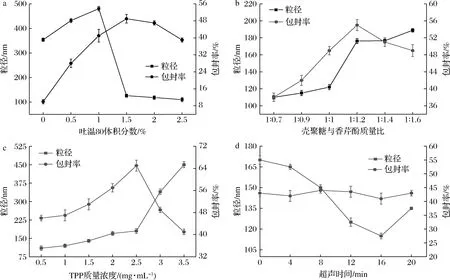
a-吐温80添加量;b-壳聚糖与香芹酚质量比;c-TPP质量浓度;d-超声时间图1 不同反应条件对香芹酚-壳聚糖乳液粒径和包封率的影响Fig.1 Effect of different reaction conditions on the particle size and encapsulation efficiency of carvacrol-loaded chitosan emulsion
2.2 香芹酚-壳聚糖纳米颗粒的微观结构分析

2.3 香芹酚壳聚糖纳米颗粒的化学组成分析
图3显示了壳聚糖粉末、壳聚糖纳米颗粒、香芹酚和香芹酚-壳聚糖纳米颗粒的FTIR图谱。壳聚糖粉末在2 851 cm-1(—CH拉伸)、1 641 cm-1(苯基)、1 080 cm-1(C—O—C拉伸)、53 cm-1(吡喃侧环拉伸)显示出特征峰(图3中b曲线)。对于壳聚糖纳米颗粒来说,苯基的峰值从1 632 cm-1移动到1 641 cm-1,而且在1 540 cm-1(氨基Ⅱ)处和1 028 cm-1(葡萄糖环的C—O—C拉伸)没有出现峰值,表示纳米颗粒内壳聚糖的NH3基团和TPP的磷酸基团之间通过静电相互作用形成复合物。香芹酚精油中的特征峰1 618(C—H弯曲)、1 242(C—O—C拉伸)、941 cm-1(C—H拉伸),均出现在香芹酚-壳聚糖纳米颗粒的光谱中,波数相同,表明香芹酚与壳聚糖纳米颗粒之间没有修饰或相互作用。图3的2 926 cm-1和2 851 cm-1C—H伸展振动强度增加,这是由于包埋香芹酚后C—H含量急剧上升,从而进一步证明香芹酚的包埋成功。

a-壳聚糖纳米颗粒;b-香芹酚-壳聚糖纳米颗粒图2 壳聚糖纳米颗粒及香芹酚-壳聚糖纳米颗粒FESEM图谱Fig.2 FESEM pattern of chitosan nanoparticles and carvacrol-loaded chitosan nanoparticles
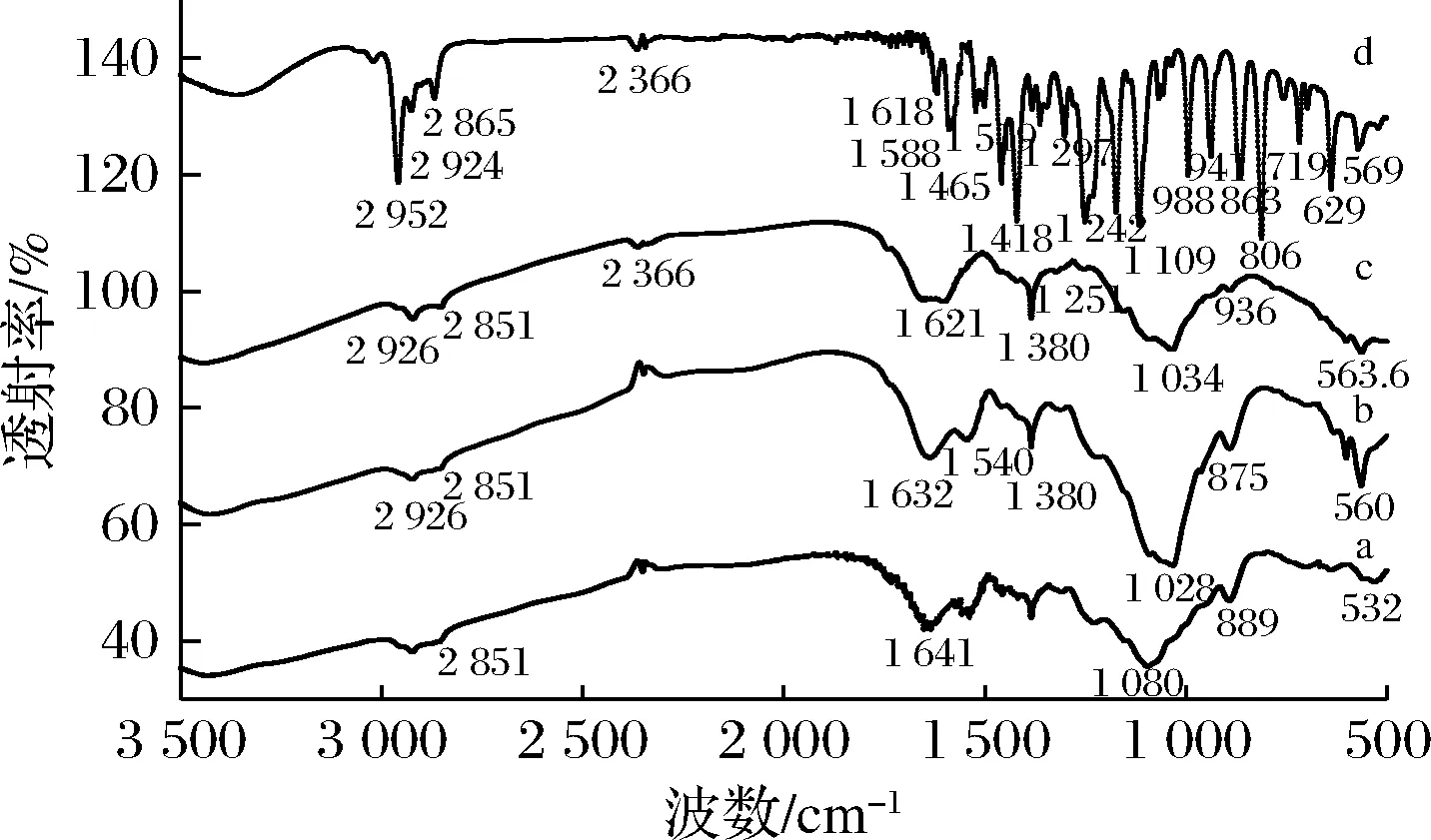
a-壳聚糖纳米颗粒;b-壳聚糖;c-香芹酚-壳聚糖纳米颗粒;d-香芹酚图3 壳聚糖、壳聚糖纳米颗粒、香芹酚-壳聚糖纳米颗粒及香芹酚的傅里叶红外光谱Fig.3 FTIR pattern of chitosan, chitosan nanoparticle,carvacrol-loaded chitosan nanoparticles and free carvacrol
2.4 香芹酚-壳聚糖纳米颗粒的抗菌稳定性分析
通过微孔稀释法测定了香芹酚和香芹酚-壳聚糖纳米颗粒对禾谷镰刀菌的MIC,香芹酚和香芹酚-壳聚糖纳米颗粒的MIC分别为250 μg/mL和125 μg/mL(表1),研究结果表明,香芹酚的包埋不会影响其抑菌活性,相比游离香芹酚,香芹酚-壳聚糖纳米颗粒的MIC值更低,说明壳聚糖纳米颗粒的包埋能够改善香芹酚的抗菌活性。
图4 比较了香芹酚-壳聚糖纳米颗粒和香芹酚在储存期间抑菌稳定性的变化,贮存第0天时,香芹酚的抑菌效果大于香芹酚-壳聚糖纳米颗粒的抑菌效果,这是因为香芹酚-壳聚糖纳米颗粒此时发挥抑菌作用主要依靠游离在香芹酚-壳聚糖纳米颗粒表面的香芹酚以及香芹酚-壳聚糖纳米颗粒释放出的部分香芹酚。在35 ℃贮藏30 d后,香芹酚的菌丝抑制率下降至56.3%,而香芹酚-壳聚糖纳米颗仍保持较高的抑菌能力,菌丝抑制率为61.4%,表明在贮藏过程中,纳米颗粒具有保护芯材的作用。随着贮藏时间的继续延长,香芹酚和香芹酚-壳聚糖纳米均表现出抑菌能力下降的趋势,但是差异增大,在贮藏第50天时,香芹酚-壳聚糖纳米颗粒仅降至47.7%,而香芹酚降至25.1%,表明香芹酚-壳聚糖纳米颗粒提高了香芹酚的抑菌稳定性。

表1 香芹酚和香芹酚-壳聚糖纳米颗粒对禾谷镰刀菌的MICTable 1 MIC of free carvacrol and carvacrol-loaded chitosan nanoparticles against F.graminearum

图4 香芹酚-壳聚糖纳米颗粒和香芹酚在贮存期间的抑菌稳定性Fig.4 Antifungal stability of carvacrol-loaded chitosan nanoparticles and free carvacrol before and after storage
2.5 香芹酚-壳聚糖纳米颗粒对菌丝体的破坏作用
由图5 SEM结果可知,未经香芹酚-壳聚糖纳米颗粒抑菌处理的霉菌菌丝较挺直,具有一定的支撑能力,细胞膜表面较为完整光滑,但是经过香芹酚-壳聚糖纳米颗粒抑菌处理的霉菌菌丝表面皱缩,菌丝弯曲,菌丝形态改变,表明细胞壁和细胞膜的完整性遭到破坏。SEM结果表明,香芹酚-壳聚糖纳米颗粒通过破坏菌丝细胞膜,使其菌丝皱缩,生长停滞,抑制产孢结构生成的方式,从而抑制禾谷镰刀菌的生长。

a-未经处理的禾谷镰刀菌菌丝生长状况;b-经香芹酚-壳聚糖纳米纳米颗粒处理的禾谷镰刀菌菌丝生长状况图5 香芹酚-壳聚糖纳米颗粒处理前后禾谷镰刀菌菌丝生长状况SEM照片Fig.5 SEM of mycelial growth of F.graminearum before and after treatment by carvacrol-loaded chitosan nanoparticles
3 结论
本研究采用乳化交联法制备了香芹酚-壳聚糖纳米乳液,最佳制备条件为:吐温80的添加量为1.5%(体积分数),壳聚糖与香芹酚质量比为1∶1.2,TPP质量浓度为2.5 mg/mL,超声时间为16 min。此时粒径为180 nm,包封率为62%,并展现出良好的贮藏稳定性。FESEM分析表明香芹酚-壳聚糖纳米颗粒的形成,纳米颗粒均匀分布,呈规则球状,粒径大小为80 nm。FTIR进一步证明壳聚糖对香芹酚的包埋是成功的。通过在贮藏期间比较香芹酚和香芹酚-壳聚糖纳米颗粒的抑菌稳定性,随着贮藏时间的延长,香芹酚的菌丝抑制率由82.2%降至25.1%,而香芹酚-壳聚糖纳米颗粒的菌丝抑制率仍为47.7%。扫描电镜观察的结果表明,香芹酚-壳聚糖纳米颗粒处理破坏了禾谷镰刀菌的细胞壁和细胞膜的完整性,从而抑制其菌丝生长。综上所述,将香芹酚包埋至壳聚糖纳米颗粒提高了香芹酚的抑菌稳定性,拓宽了香芹酚的使用范围,为未来防治粮食霉变,控制粮食中真菌毒素含量提供了可靠的理论基础。
