假俭草EoNLA基因克隆与其转基因拟南芥在不同磷水平下的表型鉴定
2022-11-29何青青刘传强李建建王晶晶周圣浩王浩然
何青青,刘传强,李建建,王晶晶,姚 祥,周圣浩,陈 英*,王浩然*
(1. 南京林业大学杨树种质创新与品种改良重点实验室,南方现代林业协同创新中心,江苏 南京 210037;2. 江苏省中国科学院植物研究所,江苏 南京 210014;3. 江苏省泰兴市农村能源技术开发服务站,江苏 泰兴 225400)
假俭草(Eremochloaophiuroides)植株低矮、抗逆性强,是蜈蚣草属中唯一可用作草坪草的一个种[1],也是世界公认起源于中国的最好的暖季型草坪草,有“中国草坪草”的美誉[2]。假俭草可粗放管理,是建植各类绿地草坪及高速公路边坡草坪、堤坝护埂、固土护坡、绿化建设、治理水土流失的理想材料[3]。其广泛分布于我国长江流域及其以南地区[4],是我国南方酸土区的一些极度缺磷贫瘠的强酸性土壤上重要的优势种及建群种。磷元素作为植物必需的大量营养元素,是植物细胞内核酸和细胞膜脂质的结构组成部分,参与植物体内各种代谢过程,在植物的生长发育中发挥着重要作用[5]。虽然在包括磷匮乏的酸性土壤在内的大多数类型土壤中,磷元素的实际总含量水平不低;但是由于土壤中的磷素流动性低且易被铝固定为非有效态磷,往往造成实际能够被植物吸收利用的有效磷含量偏低,因而磷素是最难以被植物吸收利用的营养元素之一,成为限制植物生长发育的重要因素[6-8]。因此,探索假俭草这类天然适应低磷土壤条件植物的磷素调控相关分子机制,对磷高效定向育种具有重要的指导意义。
植物对磷的吸收和利用均依赖于磷转运蛋白(phosphate transporters,PTs)[9-10]。以往的研究表明,一系列具有磷转运活性的蛋白参与了植物根系对磷素的吸收以及磷素在细胞器、细胞或组织器官间的运输分配。有多种机制调控这些磷转运蛋白,其中泛素化是在蛋白水平上调控磷转运蛋白的重要过程[9]。泛素化是一种主要由泛素介导的蛋白降解机制,参与许多细胞事件的调控,如信号转导、细胞周期调节等[11-12]。其中,可以特异性识别靶蛋白的泛素连接酶(E3)则是泛素化途径中最关键的一类酶。NLA(nitrogen limitation adaptation)蛋白作为一种RING型E3泛素连接酶参与关键蛋白的泛素化,在调节植物磷素平衡方面起着至关重要的作用[9,13]。NLA分别位于质膜和细胞核两个不同的亚细胞结构中,包含4个不同的域:①RING域,介导质膜上磷酸盐转运蛋白的降解;②SPX域,促进NLA与磷酸盐转运蛋白的相互作用;③位于RING和SPX域之间的链接器域;④C末端结构域,与接头区域一样,其功能未知[12]。有研究表明,NLA编码蛋白质的N末端SPX结构域,可调节酵母中磷的感应和摄取[14-16]。根据对模式植物拟南芥的研究,NLA蛋白是RING-HCa-Type E3泛素连接酶家族的成员[17],其SPX域在磷酸盐依赖性途径中介导蛋白质间相互作用[18-20],控制PHT1家族的磷转运蛋白泛素化降解过程[21]。 因此,NLA被认为是植物磷素稳态的关键调节因子。此外,最近的一项研究发现,NLA还介导了质膜定位硝酸盐转运蛋白NRT1.7的转换[22],表明NLA在调节植物中氮和磷酸盐含量方面具有更加广泛的作用。
本研究以假俭草为研究材料,通过RACE方法克隆获得了一个假俭草NLA泛素连接酶的基因,命名为EoNLA。通过生物信息学分析确定该基因的全长序列及编码氨基酸序列,利用原生质体瞬时表达体系确定其膜定位,采用qRT-PCR方法分析该基因在低磷诱导下的表达模式,并转化拟南芥进行基因功能鉴定。通过研究假俭草EoNLA的磷高效转运分子机制,为草坪草适应酸性土壤生境的磷高效转运分子育种和栽培调控提供理论依据。
1 材料与方法
1.1 供试材料
基因克隆和表达分析所用材料为假俭草(E.ophiuroides)的酸土抗性品系E041,采集自江苏省中国科学院植物研究所草坪草种质资源苗圃。转基因和原生质体分离转化所用材料为拟南芥(Arabidopsisthaliana)Col-0盆栽苗,生长条件为:温度23 ℃,16 h光照、8 h黑暗环境。
大肠杆菌(Escheriachiacoli)菌株Top10、农杆菌(Agrobacterium)菌株EHA105购自天根(北京)公司 (Tiangen Biotech, Beijing, China);pMD19-T载体购自宝生物工程(大连)有限公司(TaKaRa, Dalian, China);植物过量表达载体pBI121-3HA以及原生质体瞬时表达载体p2GWF7.0由南京林业大学杨树种质创新与品种改良重点实验室保存。
1.2 实验方法
1.2.1 假俭草EoNLA基因克隆
采用RNAprep Pure多糖多酚植物总RNA提取试剂盒(Tiangen)提取假俭草总RNA。根据假俭草转录组测序数据(未公开)筛选获得EoNLA基因参照序列。选用大连宝生物公司的SMART RACE试剂盒进行基因全长克隆,所涉及的3′RACE和5′RACE引物见表1。扩增产物在琼脂糖凝胶上进行电泳分析,将大小正确的条带切下,利用天根公司的DNA凝胶回收试剂盒回收纯化,连接pMD19-T载体,转化大肠杆菌Top10,挑取阳性克隆委托测序公司(安徽通用生物)进行测序。
将所获得的3′和5′片段进行比对与拼接,获得EoNLA基因的全长cDNA序列。通过NCBI ORF Finder 在线程序查找序列的开放阅读框(ORF),设计EoNLA基因ORF片段的特异性引物(表1),进行PCR扩增并测序验证。

表1 假俭草EoNLA基因克隆及qRT-PCR引物
1.2.2EoNLA基因序列分析
利用NCBI数据库(http://www.ncbi.nlm.nih.gov)的 Blast P 进行比对检索,下载其他植物中EoNLA同源基因的氨基酸序列,使用 Clustal X 多序列比对软件,进行氨基酸序列的多重比对,预测其保守结构域。利用 MEGA软件对EoNLA及其同源蛋白构建系统发育进化树。利用 SMART 工具(http: //smart.embl-heidelberg.de/)预测假俭草EoNLA蛋白的功能结构域。ProtParam 在线工具(https://web.expasy.org/protparam/)预测分子量、等电点、不稳定系数。在线网站ProtScale(https://web.expasy.org/protsca/)预测蛋白质亲疏水性,蛋白的信号肽预测用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)分析,磷酸化位点预测采用NetPhos (http://www.cbs.dtu.dk/services/NetPhos/)分析,蛋白跨膜结构预测用TMHMM 2.0分析。SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白的二级结构预测。在线工具SWISS MODEL(https://www.swissmodel.expasy.org/)预测EoPHR2蛋白三级结构。
1.2.3 EoNLA蛋白的亚细胞定位
采用Gateway技术(Invitrogen)将EoNLA基因的ORF序列构建至植物瞬时表达载体p2GWF 7.0上,重组为EoNLA::GFP融合基因。采用植物原生质体制备及转化试剂盒(中科瑞泰),进行拟南芥原生质体的分离和瞬时转化。以Pro35S::GFP为正对照,在450~490 nm蓝光波长荧光显微镜下观测各样品中GFP绿色荧光表达部位。
1.2.4EoNLA基因的表达分析
基于假俭草水培体系[23]培养假俭草水培材料3周至最佳生长状态后,对假俭草材料的根、茎、叶组织分别采样(3个生物学重复),鲜样采集清洗后立即用液氮速冻并提取RNA,用于基因的表达分析。使用FastStart Universal SYBR Green Master Mix (Roche) 荧光定量试剂及ABI ViiA7荧光定量PCR仪(ABI)进行qRT-PCR实验,采用相对定量法[24]进行分析,管家基因Actin作为内参基因,该实验技术重复3次。相关引物见表1。
1.2.5EoNLA转基因拟南芥表型鉴定
采用Gateway技术(Invitrogens)将EoNLA基因的ORF序列构建至植物过量表达载体pBI121-3HA,质粒转化农杆菌EHA105。通过农杆菌介导的拟南芥花序浸润法转化拟南芥,筛选获得转基因T3代纯合体,并对转基因植株进行功能检测。
栽培基质为泥炭、蛭石与珍珠岩体积比为1∶1∶1的混合基质,预拌入1/10的大比例稀释MS营养液作为基肥。种子萌发后生长至4片叶状态的拟南芥野生型/ 转基因幼苗移栽入内,采用无营养的清水灌溉,继续培养3周后,观察盆栽苗的生长表型。
无菌种子苗培养及处理方式:采用MS固体培养基(pH 5.8,添加蔗糖20 g/L、琼脂9 g/L)作为基础,通过调整KH2PO4(P)母液的添加量控制磷元素浓度(同时,相应添加KCl母液补足钾元素至标准水平)模拟胁迫处理条件,分别为0 mmol/L P(无磷)、0.062 5 mmol/L P(低磷)、0.625 0 mmol/L P(半磷)和1.250 0 mmol/L P(全磷)。野生型及转基因纯合体,两个株系的拟南芥种子,消毒播种于培养基平板培养3周后,对表型进行观测。采用仪器扫描植株生长表型(WinRHIZO Pro 2017系统)。各处理条件下的野生型及转基因株系,分别取25株苗称量全株鲜质量。
2 结果与分析
2.1 假俭草EoNLA基因克隆及序列分析
根据假俭草转录组测序数据(未公开)筛选获得的EoNLA基因参照序列设计引物,并采用RACE技术(rapid amplification of cDNA ends)克隆获得假俭草EoNLA基因的全长cDNA序列。测序分析结果表明EoNLA基因全长为1 353 bp,含有217 bp的5′UTR和143 bp的3′UTR以及993 bp的开放阅读框(ORF),共编码331个氨基酸(图1)。

图1 EoNLA基因cDNA全长及相应氨基酸序列
利用ProtParam软件对EoNLA基因编码蛋白的理化性质进行预测,结果显示:EoNLA编码蛋白的分子质量为37 416.54 u,理论等电点为8.88,该蛋白的氨基酸组分为Leu (34 个,占比10.3%)、Ser (32个,9.7%)、Lys (30个,9.1%),以及组分占比低于9% 的其他氨基酸,不含 Pyl、Sec;该蛋白中带负电荷的碱基数为36 (Asp + Glu),带正电荷的碱基数为48 (Arg + Lys);不稳定系数58.89,推测该片段属于不稳定型蛋白;脂溶系数76.61,总平均亲水性为-0.265。利用ExPASY ProtScale进一步预测EoNLA蛋白氨基酸序列的亲疏水性,结果显示亲水性氨基酸数量大于疏水性氨基酸数量,这表明EoNLA蛋白可能为亲水性蛋白。
SMART预测蛋白结构域显示,EoNLA 蛋白具有典型的RING结构域和SPX结构域(图2A)。SOPMA预测蛋白二级结构结果显示,EoNLA编码的蛋白含有α-螺旋(alpha helix)、延伸链(extended strand)、随机卷曲(random coil)和β-转角(beta turn)等结构,其中α-螺旋所占比例最高为54.55%,随机卷曲所占比例为33.03%,延伸链所占比例是9.09%,β转角占比为3.33%(图2B)。利用SWISS MODEL进一步构建EoNLA蛋白的三维模型,预测的三维结构与其二级结构预测结果相符为探寻EoNLA在不同植物种间的同源性及系统进化关系,将假俭草EoNLA基因编码氨基酸序列提交到NCBI数据库进行同源比对,结果(图3)显示,其与高粱(Sorghumbicolor)、哈氏黍(Panicumhallii)、狗尾草(Setariaitalica)、日本水稻(OryzasativaJaponica group)、野生水稻(Oryzabrachyantha)、疣粒野稻(Oryzameyerianavar.)、二穗短柄草(Brachypodiumdistachyon)、大麦(Hordeumvulgare)、山羊草(Aegilopstauschiisubsp.)、硬粒小麦(Triticumturgidumsubsp.)等植物种具有较高的同源性,多重序列比对结果显示EoNLA基因编码蛋白序列的保守性较强,各植物种的NLA同源蛋白在氨基酸序列C端的226~274区域均具有保守的RING结构域(图3)。根据EoNLA基因的氨基酸序列,利用MEGA 6.0软件构建其与其他植物种同源基因的系统进化树(N-J邻接法),结果显示其在不同植物种间具有一定的保守性,其中,假俭草与高粱、哈氏黍、狗尾草构成一个高支持分支(99%);假俭草与高粱拥有最近的遗传距离,其亲缘关系最近;同为稻属的日本水稻、野生水稻、疣粒野稻在同一进化分支,而禾本科的二穗短柄草、大麦、山羊草和硬粒小麦则在另一分支(图4)。

图2 EoNLA氨基酸序列分析

红框标识为RING结构域。The red box represents the RING domain.

图4 EoNLA的系统进化树
(图2C)。此外,NetPhos的预测结果表明,EoNLA编码蛋白含有27个磷酸化位点[结果分值(score)>0.5],包含4 个酪氨酸位点、18 个丝氨酸位点、5 个苏氨酸位点(图2D)。
2.2 EoNLA的亚细胞定位及组织表达特异性分析
研究基因表达蛋白的亚细胞定位,可以帮助了解该基因在细胞中发挥作用的位置,从而为鉴定其生物学功能提供参考。通过SignalP 4.1预测分析EoNLA蛋白的氨基酸序列,结果显示EoNLA蛋白的分值(S-score)平均值为0.001 4,S-score平均值低于0.5表明该蛋白为非分泌型蛋白,因而应当进一步通过实验检测分析EoNLA蛋白的亚细胞定位。分离拟南芥原生质体,通过PEG介导将构建的EoPHR2-GFP融合载体导入原生质体中,使该基因下游的绿色荧光蛋白GFP得到表达,观察荧光表达部位即可确定该基因在细胞中发挥生物学功能的位置。显微镜下观测显示:原生质体细胞具有完整、规则的细胞形态,细胞内叶绿体自发荧光清晰,表明细胞状态正常;在488 nm激发光下,EoNLA-GFP融合蛋白的绿色荧光主要聚集在细胞膜;同时,在仅含GFP的对照中绿色荧光信号则没有明确的细胞定位,绿色荧光在全细胞范围弥散(图5)。由此判断EoNLA蛋白定位于细胞膜,这与其结合细胞膜上的磷转运蛋白进行泛素化的功能定位相符合。

图5 EoNLA蛋白在原生质体中的定位
通过分析基因表达的组织特异性,可以了解该基因在植物体中发挥作用的器官组织定位,是预测鉴定基因生物学功能的重要参考。利用实时荧光定量技术(qRT-PCR)对EoNLA基因在假俭草不同器官组织间的表达模式进行比较分析,结果显示EoNLA基因在根组织的表达量显著高于茎和叶,该基因具有根组织表达特异性(图6)。

**.P<0.01.
由此可以推断,EoNLA主要在根系组织发挥功能,该结果与以往在模式物种的相关研究报道相符。
2.3 EoNLA基因的转基因功能鉴定
为进一步分析基因功能,构建EoNLA基因的植物过量表达载体、转化拟南芥、迭代筛选并鉴定,获得T3代纯合体转基因株系,命名为EoNLA-OV(图7A)。在无营养的清水灌溉基质盆栽条件下,转基因拟南芥生长表型均劣于野生型(图7B),推测是EoNLA基因的过量表达负调控磷转运蛋白,从而抑制了植株对磷营养的吸收利用。
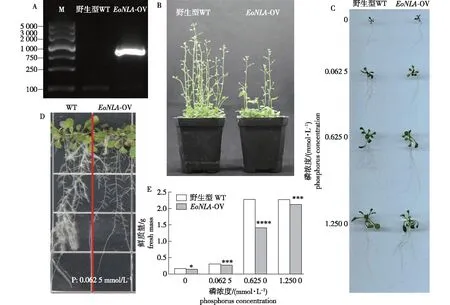
A.转基因植株鉴定identification of transgenic plants;B.园土基质盆栽植株表型phenotype of potted plants in garden soil matrix;C.不同磷浓度梯度处理下的植株表型plant phenotype under different phosphorus concentration gradient;D.低磷条件下的植株根表型plant roots phenotype under low phosphorus condition;E.不同磷浓度梯度处理下的植株鲜质量(25株)fresh weight of plants under different phosphorus concentration gradients (25 plants). *.P<0.05;***. P<0.001;****.P<0.000 1.
将野生型(WT)和转基因(EoNLA-OV)拟南芥分别播种于0 mmol/L P(无磷)、0.062 5 mmol/L P(低磷)、0.625 0 mmol/L P(半磷)和1.250 0 mmol/L P(全磷)4个磷浓度梯度条件下萌发培养3周后,观察其生长表型,并称量植株鲜质量,结果显示:在0 mmol/L P的无磷条件下,野生型及转基因拟南芥均表现出明显的生长抑制表型(图7C);在0.062 5 mmol/L P的磷匮乏条件下,转基因株系相对于野生型呈现出更加明显的生长抑制表型,其根系发育表型明显弱于野生型对照(图7C、7D);在0.625 0 mmol/L P的半磷浓度条件下,野生型拟南芥相较于转基因植株呈现出较明显的总体生长优势,野生型植株鲜质量明显高于转基因植株(图7C、7E);在1.250 0 mmol/L P的全磷浓度条件下,转基因拟南芥相较于野生型植株,生长表型及植株鲜质量则表现出明显的差异(图7C、7E)。此外,对野生型及转基因植株在不同磷浓度梯度下的植株鲜质量增量分别进行比较发现:野生型拟南芥的鲜质量数据在半磷浓度条件(0.625 0 mmol/L P)已经达到峰值,与全磷浓度(1.250 0 mmol/L P)条件的鲜质量数据基本一致;而过量表达EoNLA的转基因拟南芥鲜质量数据则随着半磷及全磷浓度条件的变化而呈现出递增趋势,直至全磷浓度条件下的鲜质量数据接近于野生型(图7E)。
3 讨 论
磷是植物生长发育必不可少的营养元素,但土壤酸化使其有效性低,成为最难被植物吸收利用的营养元素之一。早在2000年前后,我国的酸性土壤地区面积已经占全国陆地总面积的22.7%,遍及南方14个省份[25],而随着土壤酸化进程逐渐加速,酸性土壤区面积也呈现逐年递增趋势。土壤酸化后衍生的有效磷匮乏问题,则是酸土地区限制植物生长发育的主要营养因素[5,26]。假俭草作为我国南方地区的乡土植物,广泛分布于我国南方酸土区等低磷土壤条件地区,在极度缺磷贫瘠的强酸性土壤上更是重要的建群种。探索假俭草这类天然适应低磷土壤条件植物的低磷胁迫响应分子机制,进而指导培育适应低磷土壤条件的磷高转运植物品种,对缓解磷肥需求压力、提高贫瘠土地利用率以及改善贫瘠地区生态都具有重要意义。本研究首次从假俭草中克隆获得了一个磷调控相关基因,鉴定为AtNLA/OsNLA基因的直系同源基因,命名为EoNLA。
氮限制适应蛋白(NLA)是一种E3泛素连接酶,在氮及磷稳态调节中起重要作用。NLA会以不同的方式调节植物体的磷素动态平衡,其中包括转录后和翻译后水平的调控,以及通过蛋白质中相关的功能结构域[27-28]。基于模式植物拟南芥的研究发现,在磷营养供应充足的情况下,NLA通过其N端SPX结构域和C端RING结构域促进质膜上磷转运蛋白的降解[27];当磷营养受到限制时,NLA则受到microRNAs的调控抑制,从而减轻对质膜上的磷转运蛋白的负调节[22, 27-28]。然而,对单子叶植物模式植物水稻的研究则发现,OsNLA1基因并非 miR827(磷饥饿诱导microRNA)的靶基因,而是通过其他通路诱导水稻OsPHT1 磷转运蛋白家族若干成员(OsPT1/2/4/7/8/12)的降解来调控水稻对磷的吸收转运[29]。基于以往不同模式植物中对NLA基因的研究报道显示,该基因在植物的磷响应调控通路上发挥重要作用。假俭草作为缺磷贫瘠的酸性土壤上的优势植物,研究其磷营养相关的调控通路及机制,对于了解这类酸土植物的逆境适应机制具有重要意义。目前,有关假俭草NLA基因的研究还未见报道。本研究通过RACE方法从假俭草中克隆获得了EoNLA基因的完整全长序列,并对其功能进行了初步的鉴定。分析EoNLA的亚细胞定位及组织表达特异性,可以了解该基因在细胞以及器官组织中的功能位置,是鉴定基因生物学功能的重要参考。基于原生质体瞬时表达体系的亚细胞定位观测显示,EoNLA蛋白定位于细胞膜,这与相关研究报道中NLA结合细胞膜上的磷转运蛋白进行泛素化的功能定位相符合;进一步利用实时荧光定量技术(qRT-PCR)的基因表达组织特异性分析显示EoNLA基因具有根组织表达特异性,EoNLA的功能主要定位于根系组织,该结果与以往在模式植物的相关研究报道相符[27]。
本研究利用EoNLA基因过量表达的转基因拟南芥株系鉴定基因功能。根据前人的研究结果[27],NLA在磷营养充分的条件下介导磷转运蛋白的泛素化降解、限制磷素的吸收转运,在低磷条件下NLA则受到microRNAs的负调控抑制、释放磷转运蛋白的功能,进而调节植物体的磷素平衡。由此可以推测,过量表达NLA会提高植株对低磷胁迫的敏感性,进而抑制转基因植株在低磷条件下的生长表型。本研究的结果与该理论推测相符合,即在0.062 5 mmol/L P的磷匮乏条件以及0.625 0 mmol/L P的半磷浓度条件下,野生型拟南芥相较于EoNLA过表达的转基因植株呈现出生长优势;而在1.250 0 mmol/L P的全磷浓度条件下,不存在低磷胁迫压力,转基因拟南芥与野生型植株的生长表型没有表现出明显的差异。但值得注意的是,转基因植株对不同程度的低磷胁迫所呈现的表型不完全相同,在胁迫程度较严重的磷匮乏(0.062 5 mmol/L P)条件下,转基因株系在种子苗生长初期的根系生长发育表型明显弱于野生型对照;而在胁迫程度较轻的半磷(0.625 0 mmol/L P)条件下,野生型拟南芥相较于转基因植株则主要是在鲜质量方面体现了总体生长优势,而根系形态则未表现出较明显的差异。此外,对野生型及转基因植株在不同磷浓度梯度下的植株鲜质量增量分别进行比较发现,野生型拟南芥的鲜质量数据在半磷浓度条件(0.625 0 mmol/L P)已经达到峰值,与全磷浓度条件(1.250 0 mmol/L P)的鲜质量数据基本一致;而过量表达EoNLA的转基因拟南芥鲜质量数据则随着半磷及全磷浓度条件的变化而呈现出递增趋势,直至全磷浓度条件下的鲜质量数据接近于野生型,由此也可表明,过量表达EoNLA提高了转基因植株对低磷胁迫的敏感度。鉴于自然的土壤条件中有效磷水平往往较低[6],因而在本研究中观察到,相对于野生型,盆栽条件下,转基因植株的生长受到了明显的抑制。以上研究结果表明,EoNLA基因应当在植物体的磷素平衡调控中发挥着重要作用,但其相关的分子调控机制仍有待进一步的研究。
