邻苯二甲酸二(2-乙基己基)酯对3T3-L1前脂肪细胞成脂分化和脂肪分解的影响
2022-11-28欧阳碧云王俊程赵秀兰
欧阳碧云,王俊程,赵秀兰
(山东大学齐鲁医学院公共卫生学院,山东 济南 250012)
超重和肥胖是心血管疾病、高血压和糖尿病等多种慢性疾病的重要诱因,特别是肥胖现已成为广受关注的全球性公共卫生问题[1-2]。超重和肥胖为体内异常的脂肪累积,是由能量摄入与消耗失衡导致的。近年来研究表明,肥胖的发生亦与环境污染密切相关,许多环境污染物能够通过多种途径导致能量失衡[3]。邻苯二甲酸二(2-乙基己基)酯(diethylhexyl phthalate,DEHP)广泛用于生产食品包装材料、化妆品、医疗用品、建筑材料和儿童玩具,是目前使用量最大的增塑剂。人群流行病调查资料显示,DEHP暴露与胰岛素抵抗和肥胖代谢综合征相关[4]。本课题组动物实验研究表明,DEHP能够增加C57小鼠体重,并伴随C57小鼠皮下脂肪组织分解降低[5-6]。3T3-L1小鼠胚胎成纤维细胞(前脂肪细胞)具有分化为脂肪细胞的潜能,是目前研究脂肪细胞分化的常用模型[7]。本研究观察DEHP对3T3-L1前脂肪细胞成脂诱导分化和脂肪分解影响,进一步探讨DEHP对脂质代谢的影响及其可能的作用机制。
1 材料与方法
1.1 细胞、试剂和仪器
3T3-L1小鼠胚胎成纤维细胞,北京北纳创联生物技术研究院。DEHP、油红O、蛋白酶抑制剂、磷酸酶抑制剂、3-异丁-1-甲黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松和胰岛素,美国Sigma-Aldrich公司;DMEM细胞培养液、胎牛血清、青霉素和链霉素,美国Gibco公司;胰蛋白酶,美国Hyclone公司;甘油三酯(triglycerides,TG)检测试剂盒,南京建成生物工程研究所有限公司;BCA蛋白质浓度测定试剂盒,美国Pierce Biotechnology公司;兔抗小鼠磷酸化蛋白激酶A(phosphorylated protein kinase A,p-PKA)底物、激素敏感脂肪酶(hormone-sensitive triglyceride lipase,HSL)、Ser563位点磷酸化HSL(p-HSL Ser563)和p-HSL Ser660多克隆抗体,美国Cell Signaling Technology公司;兔抗小鼠解偶联蛋白1(uncoupling protein 1,UCP1)和脂肪TG脂肪酶(adipose triglyceride lipase,ATGL)单克隆抗体及Alexa Fluor 488标记山羊抗兔IgG抗体,美国Abcam公司;兔抗小鼠GAPDH多克隆抗体,美国Sigma-Aldrich公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG抗体,北京中杉金桥生物技术有限公司。Olympus BX 43正置显微镜,日本Olympus有限公司;EVOS FL荧光显微镜,美国Thermo Fisher Scientific公司;Infinite®M200 Pro多功能酶标仪,瑞士TECAN公司。
1.2 3T3-L1前脂肪细胞成脂分化诱导和DEHP处理
3T3-L1前脂肪细胞复苏后,采用含10%胎牛血清和1%青、链霉素的DMEM培养液在5%CO2,37℃恒温箱中培养。细胞融合度达90%时,采用鸡尾酒诱导法诱导成脂分化,即依次给予诱导液A(IBMX 0.5 mol·L-1、地塞米松 2.5 mmol·L-1和胰岛素2 mg·L-1)和诱导液B(胰岛素2 mg·L-1)分别诱导3和4 d,其后更换含10%胎牛血清和1%青、链霉素的DMEM培养液继续培养3 d(第10天)。诱导液A和诱导液B加入的同时给予DEHP暴露,DEHP终浓度分别为0(细胞对照组),3.125,6.25,12.5,25和50 μmol·L-1。DEHP采用DMSO溶解,细胞对照组给予等体积DMSO(终浓度为0.5%),各组设6复孔。诱导分化过程中,每天采用显微镜观察细胞内脂滴大小和数量的变化。
1.3 油红O染色检测诱导成脂分化细胞中脂滴形成
按1.2处理细胞,于第10天采用油红O对细胞内脂肪进行染色。细胞经4%多聚甲醛固定、蒸馏水洗涤和60%异丙醇润洗后,油红O室温避光染色,苏木素复染,镜下观察脂滴的大小和数量,细胞内油红O着色部分即为脂滴。
1.4 成脂分化细胞外TG水平和细胞内脂肪含量检测
按1.2处理细胞,于第10天取细胞培养液,用TG试剂盒测定培养液即细胞外中TG水平。TG水平(mmol·L-1)=(样本A546nm-空白A546nm)/(校准A546nm-空白A546nm)×校准品浓度(mmol·L-1)。收集细胞,进行油红O染色。染色后先用PBS洗涤,随后加异丙醇2 mL洗脱细胞脂肪染色,于562 nm处检测洗脱液吸光度(A562nm)值。A562nm值表示细胞内脂肪含量。
1.5 Western印迹法检测成脂分化细胞中脂肪分解相关蛋白的表达
按1.2处理细胞,于第10天弃培养液,用PBS洗涤后加入RIPA蛋白裂解液,冰浴中裂解30 min;4℃,12 000×g离心10 min,取上清,用BCA蛋白浓度试剂盒测定蛋白质含量并定量,随后加入等体积上样缓冲液,置金属浴中变性10 min。取20 μg变性蛋白进行SDS-PAGE,并转印至PVDF膜,5%脱脂奶粉封闭1 h。TBST洗膜后,分别加入抗p-PKA底物、HSL、p-HSL Ser563、p-HSL Ser660、UCP1和ATGL单克隆抗体(1∶1000)4℃孵育过夜,TBST洗膜;加入HRP标记山羊抗兔IgG抗体(1∶5000)室温孵育1 h,加入ECL发光液后感光X胶片,Image J软件进行积分吸光度分析。GAPDH为内参蛋白,以目标蛋白与内参蛋白积分吸光度比值表示待测蛋白相对表达水平。
1.6 免疫荧光实验检测诱导成脂分化细胞中UCP1表达
按1.2处理细胞,于第10天经4%多聚甲醛固定15 min,PBS洗涤,加入0.5%Triton X-100通透20 min;PBS洗涤,加山羊血清室温封闭30 min;加入兔抗小鼠UCP1单克隆抗体(1∶500)4℃孵育过夜;PBS洗涤后,加入Alexa Fluor 488标记山羊抗兔IgG抗体(1∶5000),室温避光孵育1 h;含DAPI防荧光猝灭剂封片,荧光显微镜下观察、拍照。细胞内呈现绿色荧光的细胞即为UCP1表达阳性细胞,采用Image J计数该细胞。
1.7 统计学分析
实验结果数据以±s表示,采用SPSS20.0软件单因素方差分析进行统计学分析,两组间比较采用LSD(方差齐)或Dunnett'sT3(方差不齐)分析。P<0.05为差异具有统计学意义。
2 结果
2.1 DEHP对3T3-L1诱导成脂分化细胞脂滴形成的影响
显微镜下观察发现,3T3-L1前脂肪细胞诱导脂肪分化第5天,DEHP 3.125~50 μmol·L-1组细胞内可见小脂滴,细胞对照组无脂肪滴出现(图1A)。诱导分化第6天,细胞对照组细胞内出现脂滴,DEHP 3.125~50 μmol·L-1组细胞内脂滴数量与细胞对照组相比明显增多(图1B);第10天,与细胞对照组相比,DEHP 3.125~50 μmol·L-1组油红O着色细胞增多,其中DEHP 12.5,25和50 μmol·L-1组脂滴数量增加较为明显,DEHP 50 μmol·L-1组细胞中可观察到含有较大脂滴和“指环”样脂肪细胞(图1C)。

Fig.1 Effect of diethylhexyl phthalate(DEHP)on formation of lipid drops in induced adipogenic differentiated 3T3-L1 cells(200×).The adipogenic differentiation of 3T3-L1 preadipocytes were induced by differentiation medium A(3-isobutyl-1-methylxanthine 0.5 mol·L-1,dexamethasone 2.5 mmol·L-1and insulin 2 mg·L-1)for 3 d,and differentiation medium B(insulin 2 mg·L-1)for 4 d followed by continuous culture for 3 d(the 10thday),which was simultaneous combined with DEHP 3.125-50 μmol·L-1treatment.A:morphology of 3T3-L1 differentiated adipocytes on the 5thday of induced differentiation;B:morphology of 3T3-L1 differentiated adipocytes on the 6thday of induced differentiation;C:morphology of 3T3-L1 differentiated adipocytes on the 10thday by oil red O staining.Arrows show the lipid droplets.
2.2 DEHP对3T3-L1诱导成脂分化细胞外TG水平和细胞内脂肪含量的影响
与细胞对照组相比,DEHP 3.125~50 μmol·L-1组3T3-L1前脂肪细胞成脂诱导分化后细胞外TG水平和细胞内脂肪含量均明显增加(P<0.01),其中DEHP 12.5 μmol·L-1组增加更为明显(图2),提示DEHP处理可明显增加3T3-L1成脂诱导分化。

Fig.2 Effect of DEHP on extracellular triglycerides(TG)level(A)and intracellular fat content(B)in induced adipogenic differentiated 3T3-L1 cells.See Fig.1 for the cell treatment.On the 10thday of induction,the TG level of culture medium was detected by TG assay kit and the cells were stained with oil red O.The stained cells were washed by PBS and eluted with 2 mL isopropanol,then the A562 nmof the elution was detected by spectrophotometry.±s,n=6.**P<0.01,compared with cell control group.
2.3 DEHP对3T3-L1诱导成脂分化细胞脂肪分解通路相关蛋白表达的影响
与细胞对照组相比,DEHP 12.5~50 μmol·L-1组细胞中ATGL蛋白表达水平明显下降(P<0.01),DEHP 3.125~50 μmol·L-1组p-PKA底物蛋白水平亦明显下降(P<0.01)(图3);DEHP 3.125~50 μmol·L-1组p-HSL Ser563和p-HSL Ser660蛋白表达水平均显著降低(P<0.01),总HSL蛋白表达水平无明显变化(图4)。

Fig.3 Effect of DEHP on protein expressions of phosphorylated protein kinase A(p-PKA)substrate and adipose triglyceride lipase(ATGL)in 3T3-L1 differentiated adipocytes by Western blotting.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.±s,n=6.**P<0.01,compared with cell control group.

Fig.4 Effect of DEHP on protein expressions of hormonesensitive triglyceride(HSL),phosphorylated HSL at Ser563(p-HSL Ser563)and p-HSL Ser660 in 3T3-L1 differentiated adipocytes by Western blotting.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.±s,n=6.**P<0.01,compared with cell control group.
2.4 DEHP对3T3-L1诱导成脂分化细胞UCP1表达的影响
Western印迹法结果(图5A)显示,与细胞对照组相比,DEHP 3.125~50 μmol·L-1组细胞中UCP1蛋白表达水平随DEHP浓度增加明显降低(P<0.01)。免疫荧光法检测结果(图5B)与上述结果变化趋势相似,DEHP 3.125~50 μmol·L-1组UCP1表达阳性细胞数目与细胞对照组相比亦明显减少(P<0.05,P<0.01)。
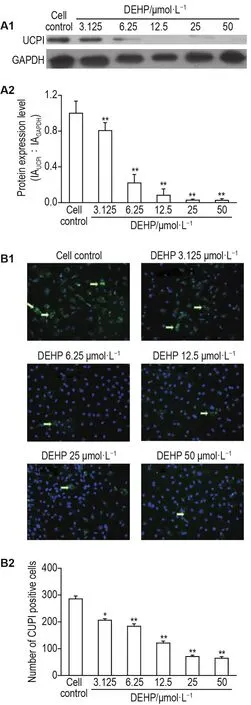
Fig.5 Effect of DEHP on protein expression of uncoupling protein 1(UCP1)in 3T3-L1 differentiated adipocytes by Western blotting and immunofluorescence assay.See Fig.1 for the cell treatment.A:the expression of UCP1 protein;B:the number of UCP1 positive cells,the arrows show the UCP1 positive cells(200×);A2 and B2 were the semiquantitative results of A1 and B1,respectively.±s,n=6.*P<0.05,**P<0.01,compared with cell control group.
3 讨论
塑料污染已引起全球关注。作为使用最为广泛的塑料添加剂,DEHP的健康效应引起广泛关注[8]。人群调查资料和动物研究显示,DEHP与肥胖密切相关,但确切的作用机制尚不明确[9-10]。脂肪细胞分化是肥胖发生发展的早期关键事件。3T3-L1前脂肪细胞是研究脂肪代谢紊乱最常用的细胞模型之一,通常采用诱导剂促进其分化为成熟脂肪细胞。Hao等[11]已报道,对3T3-L1前脂肪细胞采用单纯胰岛素诱导成脂分化的同时给予DEHP暴露,未观察到DEHP对3T3-L1细胞脂肪分化具有明显促进作用。本研究采用经典鸡尾酒法,即序贯加入IBMX、地塞米松和胰岛素组成的A液和含胰岛素B液进行成脂分化诱导,同时给予DEHP暴露。形态学结果显示,DEHP可使3T3-L1前脂肪细胞中脂滴出现更早,脂滴体积和数量也明显增加。对细胞内油红O着色的脂肪滴洗脱液脂肪含量和培养液中TG水平检测结果表明,DEHP可明显增加3T3-L1诱导成脂分化后细胞内脂肪含量和细胞外TG水平。已知DEHP进入体内后可代谢为邻苯二甲酸单(2-乙基己基)酯(mono-2-ethylhexyl phthalate,MEHP),MEHP是过氧化物酶体增殖物激活受体 γ(peroxisome proliferators-activated receptors,PPARγ)的激活剂[12],PPARγ是脂肪分化的关键调节因子[13]。本课题组采用PPARγ过表达的NIH-3T3小鼠胚胎成纤维细胞研究表明,与野生型NIH-3T3细胞相比,DEHP和MEHP均能明显促进PPARγ过表达细胞中脂滴形成,且MEHP的促进作用更强(待发表)。故推测DEHP对3T3-L1前脂肪细胞成脂分化的促进作用可能部分由于其在细胞内代谢形成MEHP并激活PPARγ所致。
脂肪细胞以TG的形式储存剩余能量,TG的分解与合成是生物体脂肪积累的重要调节因素。通常TG分解需经ATGL、活化的HSL和甘油单酯脂肪酶共同完成。ATGL首先将TG水解为甘油二酯和游离脂肪酸,甘油二酯随后可活化HSL水解生成甘油单酯和游离脂肪酸,甘油单酯继续在甘油单酯脂肪酶的作用下水解为甘油和游离脂肪酸。HSL的激活需在活性PKA作用下将563位点和660位点的丝氨酸磷酸化,组织中PKA活性一般由磷酸化PKA底物的水平表示[14]。通常刺激因素作用于脂肪细胞表面肾上腺素受体,激活细胞内腺苷酸活化酶,升高环磷酸腺苷水平,导致PKA活化,磷酸化激活HSL,参与甘油二酯水解[15]。本研究结果显示,DEHP降低了ATGL的表达,同时观察到DEHP处理后细胞中PKA的活性也明显降低,伴随HSL660和563位点丝氨酸磷酸化水平的明显下降,提示DEHP抑制了HSL的激活。Ellero-Simatos等[16]对人源皮下前脂肪细胞诱导成脂分化11 d,在成脂分化率达70%时加入 MEHP100 μmol·L-1作用48 h。结果表明,细胞内TG含量明显升高;但作用24 h时成脂分化和脂肪分解相关基因ATGL和HSL表达均上调。另有研究报道,3T3-L1首先给予DEHP暴露2 d,其后再常规诱导成脂分化,至第8天诱导完成时,细胞增殖明显提高,但细胞内TG含量明显降低[17]。本研究结果与上述研究结果不一致,可能与DEHP作用时间和作用方式不同所致。
UCP1是棕色脂肪组织线粒体中特异表达的解偶联蛋白质,该蛋白解偶联呼吸链、进而产热,能减少体内脂肪累积。研究显示,白色脂肪细胞向棕色脂肪细胞转化能增加全身能量消耗,并减少体内脂肪,该作用与UCP1表达密切相关[18]。本研究用Western印迹法和免疫荧光法检测3T3-L1诱导成脂分化细胞中UCP1表达水平。结果均显示,DEHP明显降低3T3-L1诱导成脂分化细胞内UCP1蛋白的表达,提示DEHP处理细胞脂肪含量增加也可能与UCP1表达降低相关。本课题组先前动物实验结果表明,雄性C57小鼠经灌胃分别给予DEHP 0.05 mg·kg-1(环境相关剂量)和500 mg·kg-1(导致明显生殖功能损伤剂量)连续13周,小鼠脂肪组织中UCP1、p-PKA底物、HSL及p-HSL Ser563和p-HSL Ser660蛋白表达水平均明显降低[6],与本研究体外实验结果一致。
考虑到无诱导剂时3T3-L1前脂肪细胞成脂能力低且成脂分化率不稳定,本研究未观察DEHP对非诱导细胞的成脂促进作用。同时,在DEHP>12.5 μmol·L-1时,也未观察到细胞外TG水平和细胞内脂肪含量具有明显的浓度依赖性。高浓度DEHP作用下,成脂分化细胞中脂滴较大但易脱落,推测该现象可能是高浓度时细胞内外脂肪含量无明显增加的原因之一。
综上,本研究结果表明,DEHP促进3T3-L1前脂肪细胞的成脂分化,并抑制脂肪分化细胞的脂肪分解,提示DEHP可能是促进肥胖发生的潜在危险因素,具体分子机制待深入探讨。
