敲除大麻素Ⅱ型受体影响APP/PS1小鼠前额叶皮质小胶质细胞功能与激活Pl3K/Akt/mTOR通路有关
2022-11-28袁蜜蜜刘坤璐陈美桦陈浩正史敬璞孙家广
袁蜜蜜,刘坤璐,陈美桦,陈浩正,史敬璞,李 锦,孙家广,王 勃
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;2.河北医科大学第四医院麻醉科,河北 石家庄 050000;3.邢台市人民医院麻醉科,河北 邢台 054000)
阿尔茨海默病(Alzheimer disease,AD)是一种常见的神经退行性疾病。据估计,AD患者占全世界痴呆病例的60%~70%。神经源性炎症是AD发病早期的一个重要原因[1],AD患者中炎症标志物水平升高及与天然免疫功能相关的AD风险基因的确认,均表明神经炎症在AD发病机制中发挥重要作用[2]。小胶质细胞是中枢神经系统的主要免疫细胞,在维持中枢神经系统稳态、调控神经发生和调节突触功能等方面发挥重要生理作用[3]。越来越多的研究表明,小胶质细胞及其参与的神经炎症在AD发生发展过程中发挥至关重要的作用[2,4],且小胶质细胞的不同表型在AD不同发展阶段可发挥不同的作用[5],通过调整AD不同发展阶段不同脑区小胶质细胞的表型以改善AD症状已成为治疗AD的一种策略[2]。
内源性大麻素系统(endocannabinoid system,EC)包括大麻素Ⅰ型受体(cannabinoid receptor type 1,CB1R)和CB2R、内源性大麻素及合成与分解这些化合物的酶[6]。CB2R主要存在于外周循环免疫细胞、脾细胞和巨噬细胞等。AD模型小鼠脑内出现炎症或应激损伤时,小胶质细胞CB2R特异性高表达[7-8]。
本课题组前期研究结果发现,CB2R激动剂JWH-015可通过调节小胶质细胞介导的脑内炎症反应,参与AD模型小鼠(APP/PS1小鼠)学习和记忆能力的改变[9]。本研究用敲除CB2R的APP/PS1小鼠模型探讨AD发病早期CB2R对AD模型小鼠学习与记忆能力的影响及其可能的分子机制,并尝试为AD的早期预防提供有益线索。
1 材料与方法
1.1 试剂和主要仪器
鼠尾裂解液和DNA Marker,北京博迈德公司;2×Taq PCR Master Mix,美国ApexBio公司;蛋白激酶K,美国Merck公司;琼脂糖,北京擎科生物公司;Star Green safe Nucleic Acid Dye,北京康润诚业公司;PCR引物,上海生工生物公司;人β淀粉样蛋白 1-40(amyloid β-protein 1-40,Aβ1-40)和人Aβ1-42ELISA试剂盒,美国Invitrogen公司;RNA提取试剂盒,德国Qiagen公司;逆转录试剂盒,日本TaKaRa公司;实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)预混液(Power Up SYBR Green Master Mix)试剂盒,美国Sigma公司;BCA蛋白浓度测定试剂盒,北京索莱宝公司;Triton-100、Alexa Fluor 488标记的山羊抗兔IgG抗体(二抗)和封片剂(含DAPI),北京中杉金桥公司;兔抗小鼠磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、磷酸化 Akt(phosphorylated-Akt,p-Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-mTOR、细胞外信号调节激酶1/2(extracellular signal-regulated kinase1/2,ERK1/2)、p-ERK1/2、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)、p-p38 MAPK和β肌动蛋白单克隆抗体(一抗)和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG抗体(二抗),美国CST公司;兔抗小鼠离子钙接头蛋白1(ionized calcium binding adapter molecule 1,Iba1)多克隆抗体(一抗),日本Wako公司。
Morris水迷宫实验系统(SLY-WMS),北京硕林苑公司;梯度PCR扩增仪(VeritiTM 96-Well Thermal Cycler),美国Thermo公司;实时荧光定量PCR仪(CFX96TMOptics Module),美国Bio-Rad公司;多功能酶标仪(Synergy H1),美国Bio Tek公司;恒温冰冻切片机(CM 1950),德国莱卡公司;激光共聚焦显微镜(LSM 880),德国Carl Zeiss公司。
1.2 实验动物
APP/PS1转基因小鼠(APPswe,PSEN1dE9)和全身性CB2R基因敲除(Cnr2tm1Dgen/J,CB2-/-)小鼠,雄性,体重24~26 g,均购自美国Jackson实验室。APP/PS1小鼠与CB2-/-小鼠交配获得APP/PS1*CB2-/-小鼠,野生型(wild type,WT)对照小鼠为C57BL6/J背景下非转基因同窝小鼠。小鼠由军事科学院军事医学研究院实验动物中心饲养繁殖,饲养环境温度20~22℃,湿度40%~60%,12/12 h明暗循环,光照时间8∶00~20∶00,小鼠每笼5~6只,自由摄食饮水。所有实验遵循军事科学院军事医学研究院实验动物伦理委员会的规定。
1.3 小鼠基因型鉴定
小鼠出生约21 d时,剪下2~3 mm鼠尾,加入鼠尾裂解液、20 g·L-1蛋白激酶K和β-巯基乙醇,55℃水浴过夜。逆转录PCR反应体系包括2×Taq PCR Master Mix,上、下游引物10 μmol·L-1和DNA模板。扩增条件:94℃预变性3 min;94℃变性30 s,58℃复性1 min,72℃延伸1 min,35个循环;72℃延伸2 min。基因引物序列见表1,扩增产物进行2%琼脂糖凝胶电泳分析。逆转录PCR扩增后基因型片段中CB2+/+引物扩增产物长度约为385 bp的为WT小鼠;CB2-/-引物扩增产物长度约为550 bp的为CB2-/-小鼠;β淀粉样前体蛋白(β-amyloid precursor protein,APP)引物扩增长度约为377 bp,早老素1(presenilin-1,PS1)引物扩增长度约为608 bp,同时377,385和608 bp 3条电泳条带均存在的为APP/PS1小鼠;而同时377,550和608 bp 3条电泳条带均存在的为APP/PS1*CB2-/-小鼠。

Tab.1 Primers used in reverse transcription PCR
1.4 实验分组
实验小鼠按照基因型分组,分为WT组、CB2R敲除组(CB2-/-)、模型组(APP/PS1)和模型+CB2R敲除组(APP/PS1*CB2-/-),每组10只。饲养到4月龄时进行Morris水迷宫实验。结束行为实验,各组小鼠在麻醉、生理盐水灌流后,分别取前额叶皮质和海马脑区,液氮速冻,-80℃保存,用于组织蛋白和基因表达水平的检测。
1.5 Morris水迷宫实验
连续5 d,每天4次将小鼠分别从Morris水迷宫4个象限边缘中点面壁放入水中,令其自由探索,寻找平台。在60 s内,若小鼠登上平台并停留10 s,视为成功登上平台,并记录潜伏期;若未能成功登上平台,则人工将小鼠引导至平台,并停留10 s,其潜伏期记录为60 s。小鼠每天进入水迷宫的象限随机且不同,计算每天4次训练的平均潜伏期。第6天时去除水下平台,从第Ⅲ象限将小鼠放入水池内,记录60 s内穿过原隐藏平台位置的次数和目标象限的停留时间[10]。
1.6 ELlSA检测小鼠前额叶皮质和海马A β含量
取冰冻的脑组织匀浆,4℃,5000×g离心5 min,取上清液,依照ELISA试剂盒说明书检测前额叶皮质和海马中Aβ1-42和Aβ1-40含量。
1.7 RT-qPCR检测小鼠脑内炎症因子IL-6,TNF- α和iNOS mRNA表达水平
用RNA提取试剂盒提取小鼠前额叶皮质和海马脑区的总RNA,逆转录为cDNA。RT-qPCR反应参照预混液使用说明进行,引物序列见表2。扩增条件:95℃预变性1 min;95℃变性45 s,60℃退火45 s,72℃延伸20 s,40个循环;72℃延伸10 min。用2-△△Ct法计算待测基因mRNA相对表达水平。

Tab.2 Primers used in real-time fluorescence quantitative PCR(RT-qPCR)
1.8 免疫荧光法检测小胶质细胞形态
行为学实验结束后,将小鼠麻醉,4%多聚甲醛灌流后取全脑。4%多聚甲醛固定6 h,蔗糖溶液梯度脱水,冰冻切片(厚度20 μm)。快速抗原修复液修复10 min,PBS洗3次,加兔抗小鼠Iba1抗体(1∶50)4℃孵育过夜,PBST洗3次,加Alexa Fluor 488标记的山羊抗兔IgG抗体(1∶100),室温避光孵育1 h,PBST洗3次,最后用含DAPI的封片剂封片固定,使用LSM 880激光共聚焦拍照。
1.9 Western印迹法检测小鼠脑内炎症信号通路相关蛋白表达水平
取小鼠前额叶皮质组织提取总蛋白,用BCA试剂盒进行定量,用10%SDS-PAGE电泳分离蛋白,转移到PVDF膜上,5%脱脂牛奶室温封闭1 h,加入一抗(抗 PI3K、p-Akt、Akt、p-mTOR、mTOR、p-ERK1/2、ERK1/2、p-p38 MAPK、p38 MAPK 和β肌动蛋白抗体,稀释比均为1∶5000)4℃孵育过夜。清洗后,加入HRP标记的山羊抗兔IgG抗体(1∶5000),室温孵育1 h,ECL显色,凝胶成像系统显影拍照,用Image J软件分析蛋白条带积分吸光度值。以目的蛋白条带与内参蛋白条带积分吸光度比值表示目的蛋白相对表达水平,以磷酸化蛋白条带与其总蛋白条带积分吸光度比值表示蛋白磷酸化水平。
1.10 统计学分析
采用Graphpad Prism 8.3.0软件进行实验结果数据的统计学分析和作图,计量数据用±s表示,采用双因素方差分析进行差异显著性检验,采用Turkey检验进行组间两两比较。P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠基因型鉴定结果
小鼠基因型鉴定结果如图1所示,1和2号小鼠出现385 bp的特异性条带,为WT小鼠;3和4号小鼠出现550 bp的特异性条带,为CB2-/-小鼠;5和6号小鼠分别出现377,608和385 bp的特异性条带,为APP/PS1小鼠;7和8号小鼠分别出现377,608和550 bp的特异性条带,为APP/PS1*CB2-/-小鼠。
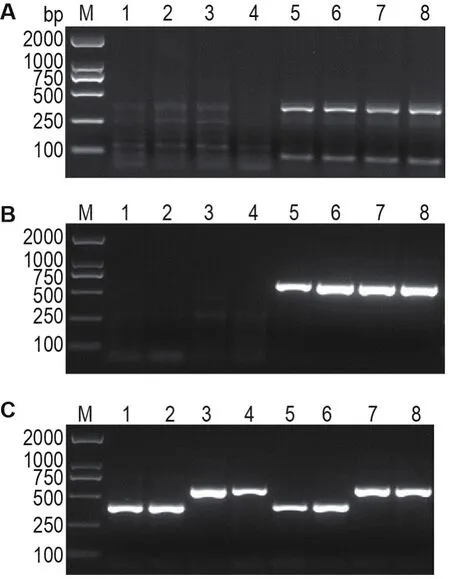
Fig.1 Genotype identification of mice by primers of APP(A),PS1(B)and CB2(C)by reverse transcription PCR.M:marker;lanes 1-2:mice of wild type mice;lanes 3-4:mice of CB2-/-mice;lanes 5-6:APP/PS1 mice;lanes 7-8:APP/PS1*CB2-/-mice.
2.2 CB2R敲除不影响APP/PS1小鼠空间学习与记忆能力
Morris水迷宫实验结果(图2)显示,与WT组相比,CB2-/-小鼠潜伏期、目标象限停留时间和穿越平台次数均无统计学差异;与APP/PS1组相比,APP/PS1*CB2-/-小鼠潜伏期、目标象限停留时间和穿越平台次数亦均无统计学差异。由此提示,CB2R敲除不影响APP/PS1小鼠的空间学习与记忆能力。

Fig.2 Effect of CB2R knockout on escape latency(A),percentage of total time spent in target quadrant(B)and numbers of platform crossing(C)in WT and APP/PS1 mice by Morris water maze test.±s,n=8.
2.3 CB2R敲除升高APP/PS1小鼠前额叶皮质A β 11--4422含量
ELISA结果(图3)显示,与WT小鼠相比,APP/PS1小鼠前额叶皮质和海马中Aβ1-42和Aβ1-40含量均显著升高(P<0.01);与 CB2-/-小鼠相比,APP/PS1*CB2-/-小鼠前额叶皮质和海马中Aβ1-42和Aβ1-40含量均显著升高(P<0.01);与APP/PS1小鼠相比,APP/PS1*CB2-/-小鼠前额叶皮质中Aβ1-42含量显著升高(P<0.05),海马中Aβ1-42和Aβ1-40含量无统计学差异。

Fig.3 Effect of CB2R knockout on contents of amyloid β -protein 1-42 (A β1-42) and A β1-40in prefrontal cortex(A)and hippocampus(B)of WT and APP/PS1 mice by ELlSA.x ± s,n=8. **P<0.01,compared with WT group;##P<0.01,compared with CB2-/-group;△ P<0.05,compared with APP/PS1 group.
2.4 CB2R敲除升高APP/PS1小鼠前额叶皮质IL-6 mRNA表达水平
RT-qPCR结果(图4)显示,与CB2-/-小鼠相比,APP/PS1*CB2-/-小鼠前额叶皮质IL-6mRNA表达水平显著升高(P<0.01);与APP/PS1小鼠相比,APP/PS1*CB2-/-小鼠前额叶皮质IL-6mRNA表达水平显著升高(P<0.05),海马IL-6,TNF-α和iNOSmRNA表达水平无统计学差异。
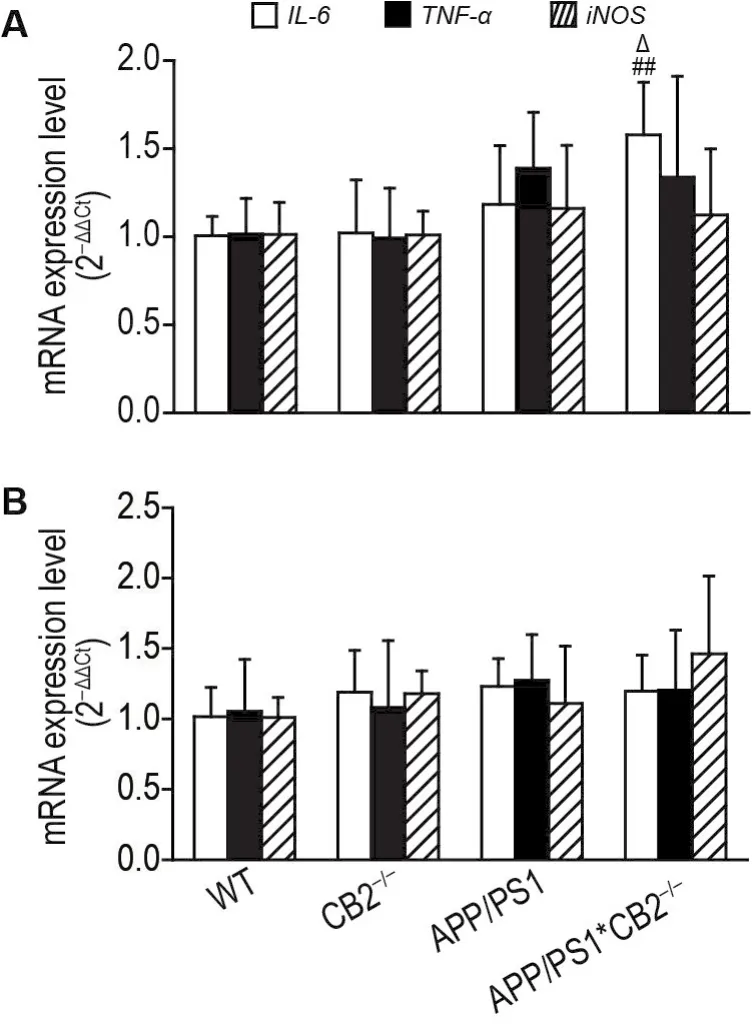
Fig.4 Effect of CB2R knockout on mRNA expressions of IL-6,TNF- α and iNOS in prefrontal cortex(A)and hippocampus(B) of WT and APP/PS1 mice by RT-qPCR.±s,n=8.##P<0.01,compared with CB2-/-group;△P<0.05,compared with APP/PS1 group.
2.5 CB2R敲除改变APP/PS1小鼠前额叶皮质小胶质细胞形态
免疫荧光检测结果(图5)显示,WT组小鼠前额叶皮质小胶质细胞胞体较小,突起呈现较长的分支状结构。CB2-/-组小胶质细胞形态无明显差异。APP/PS1组小胶质细胞的胞体较大,突起和分支变短变粗,呈现出阿米巴状样形态。APP/PS1*CB2-/-组小胶质细胞形态有明显差异,胞体较小,突起明显以细、长分支结构为主。

Fig.5 Effect of CB2R knockout on morphological changes in microglia in prefrontal cortex of WT and APP/PS1 mice by immunofluorescence assay.Green and blue represent Ionized calcium binding adapter molecule 1(Iba1)and DAPI.
2.6 CB2R敲除升高APP/PS1小鼠前额叶皮质中Pl3K蛋白水平及Akt和mTOR磷酸化水平
Western印迹结果(图6)显示,与WT相比较,CB2-/-组小鼠前额叶皮质PI3K蛋白水平及Akt,mTOR,ERK1/2和p38 MAPK蛋白磷酸化水平均无统计学差异。与CB2-/-组相比,APP/PS1*CB2-/-组小鼠前额叶皮质PI3K蛋白表达显著升高(P<0.01),Akt和mTOR蛋白磷酸化水平显著升高(P<0.05,P<0.01);与 APP/PS1 组相比,APP/PS1*CB2-/-组PI3K蛋白表达显著升高(P<0.05),Akt和mTOR蛋白磷酸化水平显著升高(P<0.05),ERK1/2和p38 MAPK蛋白磷酸化水平无统计学差异。

Fig.6 Effect of CB2R knockout on expression level of phosphoinositide 3 kinase(Pl3K) protein and phosphorylation levels of protein kinase B(Akt),mammalian target of rapamycin(mTOR),extracellular signal-regulated kinase 1/2(ERK1/2)and p38 mitogen-activated protein kinase(p38 MAPK)protein in prefrontal cortex of WT and APP/PS1 mice by Western blotting.A2 and A3 were the semi-quantitative results of A1.B3 was the semi-quantitative result of B1 and B2.±s,n=8.#P<0.05,##P<0.01,compared with CB2-/-group;△P<0.05,compared with APP/PS1 group.
3 讨论
Morris水迷宫实验通过定位航行潜伏期和目标象限探索时间及穿台次数,可以有效评价啮齿类动物空间学习记忆能力[11],其中涉及到多个脑区的共同参与,包括海马[10-12]和前额叶皮质[13],而海马脑区在空间学习记忆中发挥关键的作用。本研究结果表明,与4月龄APP/PS1小鼠相比,敲除CB2R并未影响APP/PS1小鼠的空间学习与记忆能力。但与APP/PS1小鼠相比,4月龄敲除CB2R的APP/PS1小鼠前额叶皮质Aβ1-42含量明显升高,Aβ1-40含量也有升高的趋势,而海马脑区Aβ1-42和Aβ1-40含量无显著改变,表明CB2R可能与脑内Aβ沉积的病理改变有关,尤其在前额叶皮质脑区更显著,具有明显的脑区特异性。文献报道,Aβ1-42和Aβ1-40含量的变化最早发生在大脑皮质[14],这与本研究结果一致。因此推测,在AD早期,CB2R在前额叶皮质脑区的特异性作用不能显著影响APP/PS1小鼠空间学习与记忆能力。为证明该假设,本研究进一步检测了前额叶皮质区小胶质细胞形态和促炎细胞因子表达水平的变化。同样发现,与APP/PS1小鼠相比,敲除CB2R后APP/PS1小鼠前额叶皮质IL-6mRNA表达水平明显增加,海马未发现此变化,进一步表明CB2R介导的炎症反应具有脑区特异性。本研究采用免疫荧光检测小胶质细胞形态发现,4月龄APP/PS1小鼠前额叶皮质脑区小胶质细胞呈阿米巴样形态,这与文献[15]报道一致;敲除CB2R后小胶质细胞形态发生明显改变。小胶质细胞的活化与多种细胞因子的产生和分泌有关,M1表型小胶质细胞释放促炎细胞因子,包括介导神经毒性的IL-6和TNF-α[16]。因此推测,在AD早期,CB2R可通过调节前额叶皮质小胶质细胞形态和释放促炎因子,参与AD神经源性炎症病理过程。
PI3K/Akt/mTOR通路在调节神经元树突和轴突延伸、调节突触可塑性及在神经退行性疾病中调控自噬和清除蛋白聚集物方面均发挥重要作用。据报道,AD患者脑内PI3K/Akt/mTOR通路处于失调状态,具体表现为颞叶皮质神经元Akt活性增加,mTOR在丝氨酸残基2448位点的磷酸化水平增加[17]。本研究发现,4月龄CB2R敲除的APP/PS1小鼠前额叶皮质中PI3K蛋白水平及Akt和mTOR蛋白磷酸化水平均显著升高。AD患者脑组织p-ERK1/2活性异常升高可能与AD多方面潜在病理改变有关,包括Aβ形成、tau蛋白磷酸化和神经炎症[18]。与APP/PS1小鼠相比,4月龄CB2R敲除的APP/PS1小鼠前额叶皮质p-ERK1/2表达水平有升高趋势,提示CB2R介导的炎症信号通路与MAPK家族中ERK1/2可能相关。有文献报道,6月龄APP/PS1小鼠脑组织中Aβ聚集可进一步激活p38 MAPK,p-p38 MAPK可诱导tau过度磷酸化、NF-κB活化、谷氨酸兴奋性毒性、突触可塑性破坏和神经细胞凋亡[19]。但本研究结果表明,与APP/PS1小鼠相比,4月龄CB2R敲除的APP/PS1小鼠前额叶皮质中p-p38 MAPK表达水平并无显著性差异,推测p-p38 MAPK表达水平可能与APP/PS1小鼠疾病进程相关。
综上所述,在AD早期,CB2R主要通过影响前额叶皮质脑区小胶质细胞功能调控脑内炎症反应,其中PI3K/Akt/mTOR通路主要参与CB2R介导的神经源性炎症病理改变。基于CB2R发挥调节神经源性炎症的重要作用,本研究可为CB2R作为AD早期预防炎症的靶标提供实验依据。
