辽宁新宾人参根腐病病原真菌的分离与鉴定
2022-11-28孙文松沈宝宇张天静
刘 坤,孙文松,沈宝宇,张天静
(1辽宁省经济作物研究所,辽阳 111000;2辽宁省农业科学院药用植物研究所,辽阳 111000;3中国医学科学院药用植物研究所辽阳研究中心,辽阳 111000)
0 引言
人参(Panax ginsengC.A.Meyer)是五加科人参属、多年生草本药用植物,主要药用部位为干燥根,性甘、微苦,归脾、肺和心经[1]。辽宁林地广阔,栽培历史悠久[2]。当前生产上,人参病害主要有黑斑病、灰霉病、根腐病、锈腐病和菌核病等[3],其中根腐病是一种土传的真菌性病害,根际土壤带菌量大,随栽培年份增加,危害逐年加重。人参根腐病主要危害根和根茎部位,造成根部变褐、潮湿腐烂[4-5],患病植株地上部分明显矮化、萎蔫,后期枯死。早期的研究表明,吉林[6]、湖北[7]等地人参根腐病的主要病原菌为镰刀菌(Fusarium sp.)。一直以来,人们也普遍认为人参根腐病病原菌为腐皮镰刀菌(Fusarium solani)。2013年,关一鸣等[8-9]从各地人参根腐病株中又分离鉴定到了尖孢镰刀菌(Fusarium oxysporum)、腐皮镰刀菌(Fusarium solani)、锐顶镰刀菌(Fusarium acuminatum)、克地镰刀菌(Fusarium cerealis)、半裸镰刀菌(Fusarium incarnatum)、层出镰刀菌(Fusarium proratum)和芬芳镰刀菌(Fusarium redolen)。在实际生产中,防控人参病害主要是在长期实践经验基础上采用化学防治,而长期高剂量单一用药,导致多菌灵等化学药剂的土壤残留量上升、防效下降和病原菌抗药性上升的恶性循环,以及土壤微生态平衡的破坏[10],严重影响了人参的品质、产量和产业的绿色发展。因此,明确人参产区根腐病病原微生物的种类,能够为后续抗病育种、精准用药、生物防治等研究提供理论基础。本研究采用琼脂培养法,开展人参根腐病致病性测定,以期为其他植物根部病害研究提供理论基础。
1 材料与方法
1.1 试验材料
参试材料:辽宁新宾2~5年生人参根腐病病株、新购2年生人参种苗(用于致病性测定)。
培养基:马铃薯葡萄糖琼脂培养基(PDA)、康乃馨叶片培养基(CLA)、6‰琼脂培养基。
1.2 试验方法
1.2.1 分离与纯化 采用组织分离法,将病根表面用70%酒精消毒3次、10~20 s/次,无菌水冲洗干净,除去表皮,将其剪成3~5 mm2左右小块组织并用灭菌镊子夹取放入PDA平板上,轻轻按压。每皿2~5块,摆放均匀。将培养皿翻转放置于恒温培养箱,25℃恒温培养3~5天。制板期间,每皿可加入农用链霉素30~40 mg,以排除细菌污染[11]。
挑选由分离材料上长出的典型而无杂菌的菌落,在菌落边缘用移菌针挑取带有菌丝的培养基一小块,转入试管斜面培养基或PDA平板中央,于25℃恒温培养箱中培养,以备后用。排除细菌污染方法同上。
1.2.2 致病性测定 按照柯赫氏法则,采用琼脂培养基培养法[12-14],对病原菌进行致病性测定。即,无菌条件下,将经消毒处理的人参幼株置于300 mL三角瓶(内含150 mL无菌琼脂培养基)中,每瓶3株。参苗放置之前,用无菌挑针每株刺伤3~5个点。本次试验共设2组处理,分别为对照组(CK)、处理组,每组处理3瓶,每瓶3株2年生参苗。其中,对处理组参苗沿根部注入事先制备好的PDB菌液20 mL/瓶,为对照组参苗注入等量无菌水。20℃、12 h光照和4000 lx条件下培养5天后,开始观察植株发病情况,此后逐日观察。
1.2.3 病原菌鉴定 根据《真菌鉴定手册》及文献报道,通过特异性培养基诱导培养,观察所分离病原菌菌丝组织、孢子和产孢器等特异性结构,对病原菌进行形态学鉴定和描述[15];结合rDNA-ITS和特异性遗传序列TEF延长因子对比分析[16-17],从分子生物学角度辅以形态学鉴定结果,进一步明确菌株的分类地位。样品送北京鼎国生物技术公司进行测序。
1.2.4 分级标准 本研究依据改良的根部病害标准,将人参根腐病的严重程度分为0~6级共7个等级[18-20],具体指标如表1所示。

表1 人参根腐病严重度分级标准
2 结果与分析
2.1 分离与纯化
采用组织分离法,本试验前期共分离纯化疑似致病菌株10株,通过比较菌落形态、颜色等指标,并结合显微观察发现,其中6株与菌株JS64-1表现一致,4株与菌株JS64-3表现一致,选取菌株JS64-1和JS64-3,用于下一步研究。
将2株真菌分别接种于PDA平板上,25℃恒温暗培养。6天后,菌株JS64-1铺满全皿,菌落正面白色、规则圆形,菌丝絮状,贴近培养基表面生长、菌丝茂盛,背面淡黄色、有轮纹,后期棕黄色(如图1A);在接种10天后菌株JS64-3长满全皿,菌落正圆形,正面白色至淡粉色、絮状,菌丝粗壮,气生菌丝较发达,背面紫色、无轮纹(如图1B)。
2.2 致病性测定
依据表1分级标准,由图2和表2参照可知,采用琼脂培养法接种10天后,空白对照(CK)植株正常发芽生长,茎叶已经伸出瓶口,株高(茎基部以上)达到(11.5±1.9)cm,叶片即将完全展开(如图2①);经菌株JS64-1处理的植株新发茎叶瘦小、萎蔫腐烂,表面着生大量白色菌丝,茎基部及根部见病,内部软化、表皮分离,轻轻挤压有异味,整体偏矮(如图2②),平均株高(3.5±1.3)cm,发病等级为4级;经菌株JS64-3处理的植株发病症状与JS64-1相似,但整体偏轻,新芽、茎基部和根部见病,根部表皮分离、轻微软化,表面着生淡粉色菌丝,部分新芽出现萎蔫、腐烂现象(如图2③),平均株高为(6.2±2.4)cm,发病等级为3级。

图2 菌株JS64-1和JS64-3室内接种发病情况

表2 接种14天后各处理株高及发病情况统计表
对回接发病株再次进行组织分离,得到菌株与原接种菌株一致(如图3所示)。
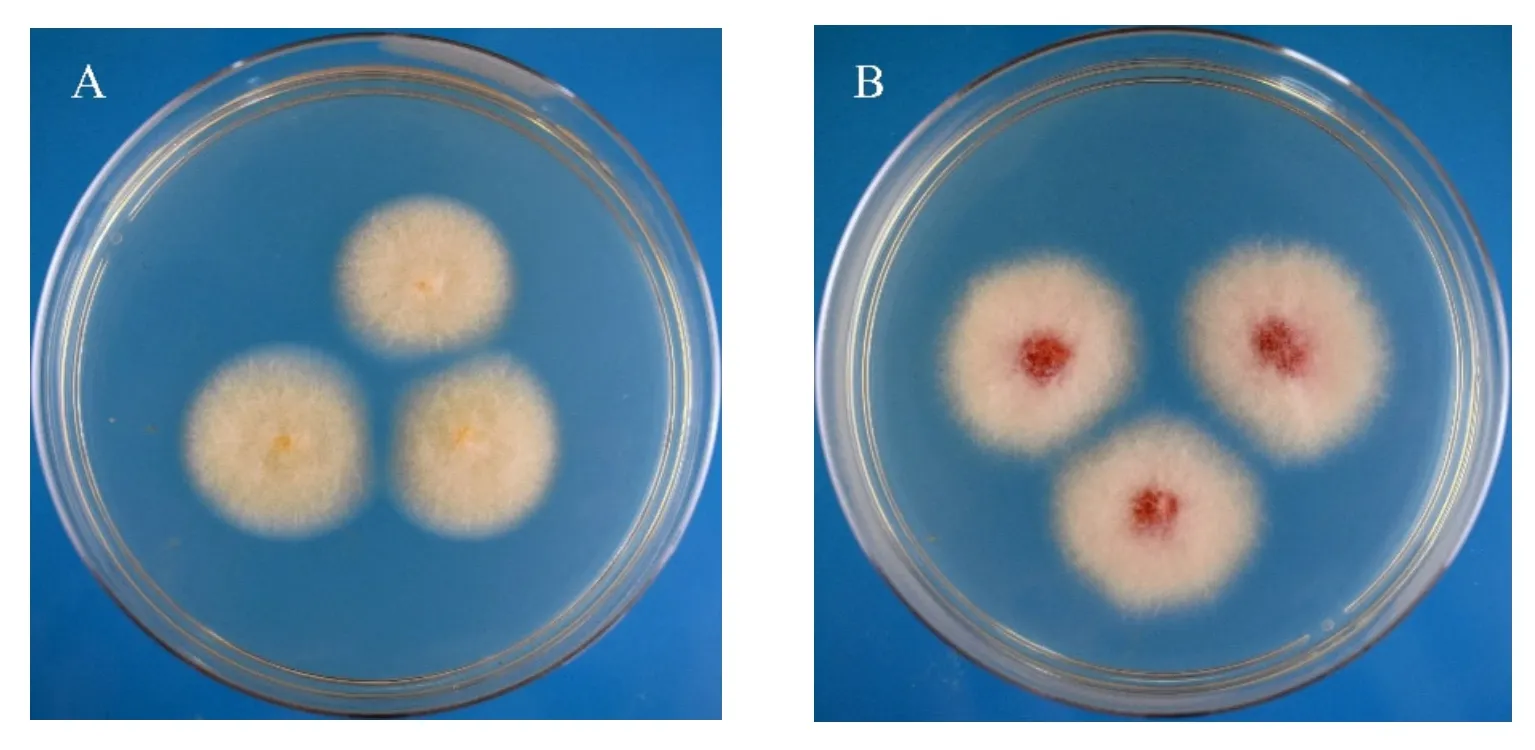
图3 回接发病植株上分离的菌株在PDA上的菌落形态
综上,按照柯赫氏法则,经致病性测定,明确了菌株JS64-1和JS64-3的侵染能够导致人参发生根腐病,二者确系辽宁人参主产区人参根腐病的病原真菌[21-22]。
2.3 病原菌鉴定
2.3.1 形态学鉴定 将菌株接种于CLA培养基上,25℃恒温暗培养5~30天,菌株JS64-1可产生大、小2种分生孢子和厚垣孢子:其中,大型孢子镰刀状,3~5个分隔,18~38 μm×3~5 μm,小型孢子卵圆形或肾形,1~2个分隔,5~15 μm×3~4.5 μm(如图4A);厚垣孢子近球形,菌丝或分生孢子均可形成,淡黄色,间生、顶生或串生(如图4B箭头所示)。菌丝有隔(如图4C)。通过形态学特征,将菌株JS64-1鉴定为腐皮镰刀菌(Fusarium solani)。
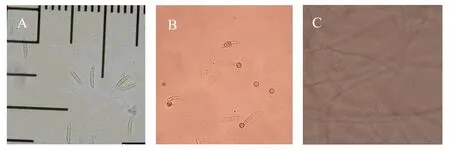
图4 CLA上JS64-1分生孢子(A)、厚垣孢子(B)和菌丝(C)的形态特征
在CLA培养基上25℃恒温暗培养10~30天,菌株JS64-3可产生大、小2种分生孢子和厚垣孢子,其中:大型孢子无色,镰刀状、略弯曲,两端细胞尖锐,3~6个分隔,大小20~50 μm×3~5 μm;小型分生孢子无色,卵圆形或椭圆形、微弯,具1~2个分隔,大小6~18 μm×3~5 μm(如图5A);厚垣孢子椭圆形或近圆形,无色或淡黄色,间生或串生,分生孢子和菌丝均可形成(如图5B、C箭头所示)。菌丝有隔(如图5C)。通过形态学特征,将菌株JS64-3鉴定为尖孢镰刀菌(Fusarium oxysporum)。
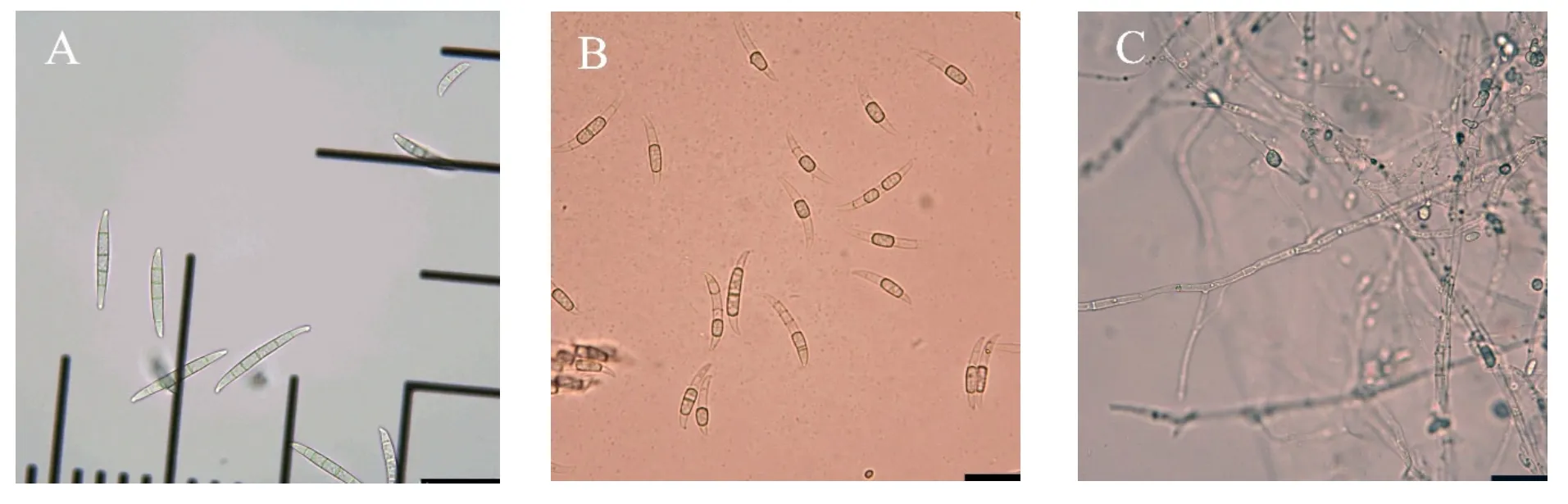
图5 CLA上JS64-3分生孢子(A)、厚垣孢子(B)和菌丝(C)的形态特征
2.3.2 分子生物学鉴定 通过Genbank数据库比对,发现菌株JS64-1的rDNA-ITS序列与MH477738、MT180477和MH536522等7株相似度达到99%以上,利用软件MEGA7.0采用N-J法构建系统发育树进行分析,其与腐皮镰刀菌MH477738处于同一分支(如图6A);翻译延长因子EF-1α序列对比结果显示,其与MT152326、MK560275和JF923745等8个菌株相似度达到99%以上,采用上述方法构建系统发育树进行分析,发现其与腐皮镰刀菌MT152326处于同一分支(如图6B)。
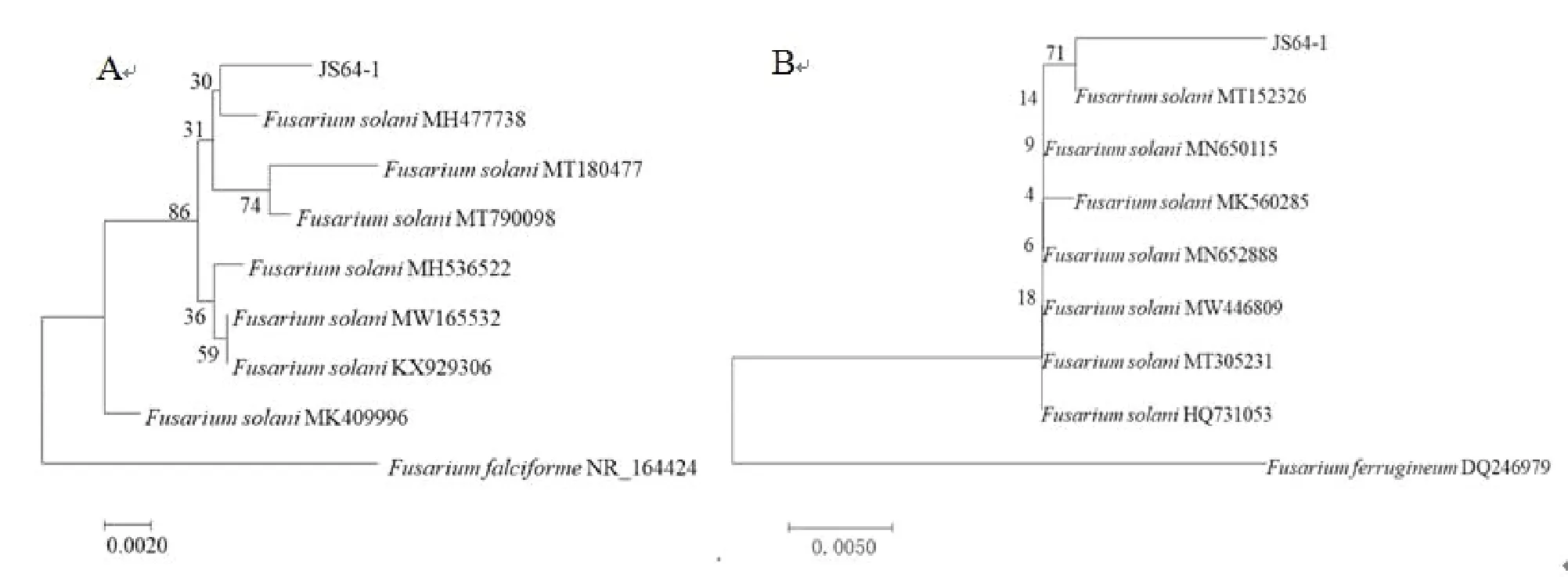
图6 分别基于ITS序列(A)和EF-1α序列(B)构建菌株JS64-1的系统发育树
方法同上,JS64-3的rDNA-ITS序列与MT323123、MF356597和KM817208等8株相似度达到99.6%以上,采用MEGA7.0软件N-J法构建系统发育树(如图7A),显示其与尖孢镰刀菌KM817208等Fusarium oxysporum菌株处于同一类群;翻译延长因子EF-1α序列对比结果显示,其与MK962137、KF918544和KM065854等8株相似度达到99%以上,相同方法构建系统发育树(如图7B),显示其与Fusarium oxysporumMK962137处于同一分支。

图7 分别基于ITS序列(A)和EF-1α序列(B)构建菌株JS64-3的系统发育树
综上,通过对2个遗传序列的对比分析,都将菌株JS64-1和JS64-3与其他镰刀菌区分开,并将二者分别与Fusarium solani和Fusarium oxysporum在同一类群。结合形态学特征,最终鉴定菌株JS64-1为腐皮镰刀菌(Fusarium solani)、JS64-3为尖孢镰刀菌(Fusarium oxysporum)。
3 结论和讨论
本研究通过组织分离法、琼脂培养法以及形态学和分子生物学鉴定等技术,对辽宁新宾人参产区人参根腐病的病原菌进行了致病性测定和种属分类地位鉴定,最终明确了辽宁人参主产区人参根腐病的主要病原菌为镰刀菌属的腐皮镰刀菌(Fusarium solani)和尖孢镰刀菌(Fusarium oxysporum),为后续开展抗病育种、绿色防控等研究奠定了一定基础。
近几十年来镰刀菌属种分类研究发生了巨大的变化,分子生物学的应用澄清了该属种间、种内关系,以及主要基因位点分析的引入,为研究该属内种间自然关系发挥着越来越重要的作用[23-24]。因此,本研究在对病菌开展分子生物学鉴定中,除了传统的ITS序列分析外,结合了其翻译延伸因子(translation elongation factor,TEF)基因片段EF-1α序列分析[25]。在通过Genbank进行序列比对过程中发现,干扰菌明显较少,证明该基因位点的可信度较高,在后续分类鉴定研究中值得进一步应用。
此外,在组织分离过程中发现,大多数参试病株中可以同时分离到上述两种致病菌,说明上述两种病原菌复合浸染现象在辽宁地区的人参根腐病田间发生较为普遍。但同时发现二者在对人参根部的致病力仍存在一定差异,即,Fusarium solani的致病力略强于Fusarium oxysporum。这与张晶晶等[26]在2020年通过人参叶片过敏性反应结果推断出来的结论基本一致,但本研究致病性测定所采用的改良琼脂培养法,通过植株表现、根腐病病级等指标可以直接反映出病原菌的致病性和致病力强弱。相较于针刺接种法[27]、孢子悬液注射法[28]、根部切伤法和菌土法[29]等,该方法操作简便,耗时较短,且结果直观准确,可为后续相关研究奠定一定基础。
受试验对象和研究范围所限,本研究目前仅就上述2种致病菌的接种方法进行了初步改良和优化,琼脂培养法在其他作物根部病原菌致病性测定上的具体应用,将在后续研究中进一步完善。
