响应辣椒疫霉菌诱导的CaWRKY转录因子筛选及其信号通路分析
2022-11-28徐晓美徐小万王恒明
徐晓美,李 颖,衡 周,徐小万,李 涛,王恒明
(广东省农业科学院蔬菜研究所,蔬菜新技术研究重点实验室,广州 510640)
0 引言
WRKY转录因子是植物最大转录因子家族之一,因含有保守的WRKY结构域而得名,该结构域由约60个氨基酸组成,靠近氨基(N)末端的7个保守氨基酸残基WRKYGQK是该结构域的核心序列[1]。WRKY转录因子不仅参与植物花粉发育[2]、种子成熟和萌发[3]、植株叶片衰老[4]等生理过程,还在植物抗病、抗逆防御反应中发挥至关重要的作用[5]。
尽管,最早在甘薯中鉴定的植物WRKY转录因子基因SPF1的生物学功能是调控糖信号途径的建立[6],然而,随后的大量研究工作证实众多WRKY转录因子蛋白主要参与了植物从基础免疫到获得性抗性的多种抗病反应之中,通过调控多通路多层次的抗病信号转导途径影响植物对病原物的生理反应,在植物与病毒、细菌、真菌、线虫以及昆虫的相互作用过程中发挥重要作用[7]。DONG等[8]对72个拟南芥WRKY基因的表达谱进行分析,发现其中有49个基因受含无毒基因的病原菌或SA的诱导。在水稻中,45个被检测的WRKY基因中有15个受稻瘟菌诱导后显著表达上调,并且其中12个同时受白叶枯病菌不同程度诱导表达,信号通路检测发现,OsWRKY45和OsWRKY62受SA诱导表达上调;OsWRKY10、OsWRKY82和OsWRKY85受JA诱导表达上调;OsWRKY30和OsWRKY83同时响应SA和JA上调表达[9]。除拟南芥和水稻等模式植物外,随后的研究发现在棉花[10]、油菜[11]、大麦[12]等大宗作物和辣椒[13]、大白菜[14]等蔬菜作物中均有发现WRKY转录因子响应病原菌诱导反应。
辣椒是一种重要的经济作物,在世界范围内广泛种植。目前,已公布的辣椒参考基因组有两个,分别为“遵辣1号”[15]和墨西哥地方品种CM334[16]。基于这2个参考基因组,刁卫平等[17]利用生物信息学方法鉴定出71个CaWRKY基因。考虑到两个不同辣椒材料自身基因组序列的不同以及各自测序可能带来的拼装错误等因素,两个不同辣椒基因组中的CaWRKY基因并非一一线性对应关系,因此,两个不同基因组中的CaWRKY基因放在一起进行命名及染色体定位作图会带来诸多困扰。基于“遵辣1号”参考基因组,ZHENG等[18]鉴定出62个CaWRKY基因,目前还没有基于CM334参考基因组全面鉴定CaWRKY基因的报道。CM334是一个高抗辣椒疫病材料,对目前已报道的所有辣椒疫霉菌生理小种均具有抗性[19]。本研究基于CM334参考基因组及其RNA-seq数据,全基因组鉴定CaWRKY基因并分析其在辣椒疫霉菌处理下的基因表达情况,筛选出关键CaWRKY基因并对其可能参与的抗病相关信号通路进行检测和分析,为后续探究CaWRKY基因参与抗病防御反应的分子机制奠定基础。
1 材料和方法
1.1 CaWRKY基因的鉴定
从辣椒基因组网站(http://peppergenome.snu.ac.kr/)下载参考基因组和基因模型注释文件,而后利用HISAT软件[20]构建参考基因组索引,结合RNA-seq数据并使用HISAT将配对末端clean reads与参照基因组比对,基于基因模型注释文件生成拼接连接的数据库,获取基因信息(如基因id/名称、所在染色体、基因位置和注释信息等),从中挑选出全部WRKY基因。以“Novel”开头的基因ID为StringTie软件[21]预测得到的新基因。
1.2 材料种植及处理
抗病材料CM334和感病对照材料NMCA10399均受赠于美国墨西哥大学Paul W.Bosland教授[19]。试验材料均在育苗杯中种植,每杯播种5粒种子,于植物培养室育苗。育苗条件为:26±2℃的温度下光照14 h,黑暗10 h交替进行,湿度为70%。幼苗生长至6片真叶时分别进行接菌处理和喷洒激素处理。
接菌处理详见文献报道[22]。在6片真叶期分别以5 mmol/L的SA和100 μmol/L的MeJA溶液(均溶解于10%的乙醇溶液中)喷洒抗病材料CM334幼苗叶片,分别在喷洒后0、6、12、24、48 h取植株根部以上部分固定于液氮中,置于-80℃冰箱中保存备用。
1.3 接菌后的CaWRKY基因表达分析
接种辣椒疫霉菌后的RNA-seq及其数据处理详见文章[22],基因相对表达量以FPKM(Fragments Per Kilobase of transcript sequence per Millions base pairs sequenced)值体现,在此基础上,调出全部已鉴定WRKY基因的表达数据,利用Microsoft Office Excel 2010对数据进行分析。当任意两个基因的相对表达量差异达到 2倍以上,即log2FoldChange≥1或log2FoldChange≤-1则被认为是显著上调或下调表达基因。
1.4 RNA提取及qRT-PCR
Total RNA提取采用Ambion公司生产的TRI Reagent Solution(TR118)RNA分离试剂并按照说明书进行操作,通过浓度和完整性检测后用于逆转录。逆转录成cDNA采用Vazyme公司生产的HiScript QRT SuperMix for qPCR试剂盒。
根据基因ID在辣椒参考基因组数据库(http://peppergenome.snu.ac.kr/)下载目标基因的CDS序列,按照qRT-PCR引物设计要求,利用引物设计软件Primer Premier6.0设计引物并交由生工生物工程(上海)股份有限公司合成,引物经过检测合格后用于后续qRT-PCR反应,所用引物见表1。

表1 qRT-PCR所用引物信息
qRT-PCR所用试剂盒ChamQ SYBR qPCR Master Mix 为 Vazyme公司生产,反应体系20 μL:2×qPCRmix 10 μL,上游和下游引物(浓度10 pmol/uL)各0.5 μL,cDNA 模板 2.0 μL,无菌水 7.0 μL。反应程序为:95℃预变性10 min;95℃ 10 s,60℃ 60 s,40个循环;熔点曲线程序:95℃ 5 s,60℃ 5 s,95℃ 5 s。以辣椒IF4G基因为内参基因[22],每个反应设置3个重复孔,每个样本含有3个生物学重复,qRT-PCR反应均在StepOnePlusTM Real-Time System(ABI,美国)荧光定量PCR仪上进行。基因相对表达量采用2-ΔΔCt法[23]进行分析。
2 结果与分析
2.1 WRKY基因鉴定及染色体定位
基于辣椒参考基因组信息及RNA-seq数据并利用HISAT软件,共鉴定出69个CaWRKY基因,分别分布于12条染色体上,从第1号染色体上的第一个CaWRKY基因开始,依次命名为CaWRKY1-CaWRKY69(表2)。其中位于第2、4、6和10号染色体上 的CaWRKY12、CaWRKY27、CaWRKY35和CaWRKY57为新注释的CaWRKY基因,在本研究参考的辣椒基因组数据库(http://peppergenome.snu.ac.kr/)中未被预测到。根据刁卫平等[17]的报道及NCBI数据库上比对验证,发现位于第9号染色体上的3个连续基因ID(CA09g11930、CA09g11940、CA09g11950)编码的是同一个CaWRKY基因的不同片段,本研究依次将其命名为CaWRKY52。

表2 辣椒全基因组WRKY转录因子家族基因

续表2

续表2
2.2 辣椒疫霉菌侵染后的基因表达分析
在接种辣椒疫霉菌0、12、36 h后,对抗病材料CM334和感病材料NMCA10399的根茎部进行RNA-seq,通过qRT-PCR实验验证及相关系数分析表明,RNA-seq数据是可靠的[22],可用于后续分析。对69个CaWRKY基因的RNA-seq数据分析表明,有11个基因(CaWRKY23、CaWRKY24、CaWRKY30、CaWRKY32、CaWRKY 35、CaWRKY 46、CaWRKY 54、CaWRKY 66、CaWRKY 67、CaWRKY 68和CaWRKY 69)在各时间点的FPKM值均小于1,即为超低量表达基因,不予进行后续分析。剩下的58个CaWRKY基因,在抗、感病材料接种辣椒疫霉菌0、12、36 h后的基因相对表达情况见图1。



图1 辣椒疫霉菌侵染后CaWRKYs基因表达分析
深入分析表明,在接菌后12 h,抗病材料CM334中有4个基因(CaWRKY19、CaWRKY45、CaWRKY49和CaWRKY65)显著上调表达,3个基因(CaWRKY50、CaWRKY59和CaWRKY60)显著下调表达;感病材料NMCA10399中有3个基因(CaWRKY27、CaWRKY45、CaWRKY49)显著上调表达,无显著下调表达基因(表3),即在接菌后12 h,抗病亲本中有更多的基因表现出差异表达。在接菌后36 h,抗病亲本中有11个基因(CaWRKY10、CaWRKY19、CaWRKY21、CaWRKY25、CaWRKY27、CaWRKY31、CaWRKY45、CaWRKY49、CaWRKY52、CaWRKY63和CaWRKY65)显著上调表达,2个基因(CaWRKY60和CaWRKY64)显著下调表达,而在感病亲本中,显著上调表达的基因多达18个(CaWRKY1、CaWRKY4、CaWRKY5、CaWRKY9、CaWRKY10、CaWRKY16、CaWRKY19、CaWRKY21、CaWRKY22、CaWRKY27、CaWRKY29、CaWRKY31、CaWRKY45、CaWRKY49、CaWRKY52、CaWRKY57、CaWRKY63和CaWRKY65),同时也有 4个基因(CaWRKY43、CaWRKY59、CaWRKY60和CaWRKY64)显著下调表达(表3),即在接菌后36 h,感病亲本中显著差异表达的基因比抗病亲本多。另外,纵观接菌后12 h和36 h两个时间点,在抗病亲本CM334中有2个(CaWRKY25和CaWRKY50)特有的显著差异表达基因,而在感病亲本NMCA10399中,特有的显著差异表达基因有 9个(CaWRKY1、CaWRKY4、CaWRKY5、CaWRKY9、CaWRKY16、CaWRKY22、CaWRKY29、CaWRKY43和CaWRKY57)(表3)。

表3 显著差异表达基因分析
2.3 SA和MeJA处理后关键基因表达分析
如上所述,在抗病亲本CM334接菌后12 h,有7个CaWRKY基因(CaWRKY19、CaWRKY45、CaWRKY49、CaWRKY50、CaWRKY59、CaWRKY60、CaWRKY65)快速应答,表现出显著差异表达。另外,在CM334中还有2个特有的差异表达基因CaWRKY25和CaWRKY50(表3),推测这8个CaWRKY基因(9个基因中有一个是重复的)是辣椒抗疫病反应过程中的关键基因。为检测其抗病相关信号通路,笔者对CM334幼苗叶片进行了SA和MeJA喷洒处理,并对8个基因进行转录表达分析。研究表明,CaWRKY19和CaWRKY65受SA诱导上调表达,均在SA处理6 h后极显著上调表达(P<0.0001),并在处理12 h后达到最高,随后开始下调;CaWRKY50受MeJA诱导上调表达,在MeJA处理6 h后极显著上调表达(P=0.004),随后开始下调并在处理12 h后降到最低;CaWRKY25受SA诱导上调表达,在SA处理6 h后略微上调表达,并12 h后达到显著上调表达(P=0.015),随后表达量持续下调到最低,CaWRKY25同时受到MeJA抑制下调表达,在MeJA处理6 h后开始持续下调表达,在处理后48 h后达到极显著下调表达(P=0.002);而CaWRKY49同时受到SA和MeJA抑制下调表达,在SA和MeJA处理6 h后均表达极显著下调(P=0.0002和P=0.002),并在随后表达量均开始回调,处理后24 h均回调到无显著差异水平。其他3个基因均不受SA或MeJA诱导或抑制(图2)。

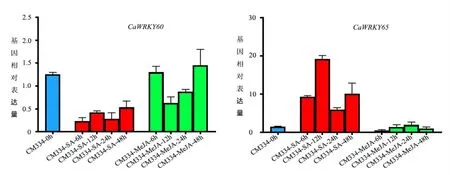
图2 关键CaWRKY在SA和MeJA处理下的转录表达分析
3 讨论与结论
辣椒基因组测序工作完成于2014年,分别测得贵州朝天椒“遵辣1号”(http://peppersequence.genomics.cn)[15]和墨西哥地方品种CM334(http://peppergenome.snu.ac.kr/)[16]的基因组序列,这给辣椒组学相关研究带来了极大便利。刁卫平等[17]对两个参考基因组数据库进行搜索,鉴定出71个CaWRKY基因。基于“遵辣1号”参考基因组,ZHENG等[18]鉴定出62个CaWRKY基因,其中57个CaWRKY基因分布于辣椒12条染色体上,还有5个基因未能定位。本研究基于CM334参考基因组及其RNA-seq数据挖掘到69个CaWRKY基因,这和刁卫平等[17]鉴定的基因个数相当,仅相差2个,但和ZHENG等[18]鉴定出的基因个数相差较大,相差7个,推测这和参考基因组质量及鉴定时所设置的搜索参数有关。另外,由于两个已测序辣椒材料自身基因组序列差异以及各自测序可能带来的拼装错误等因素,两个不同辣椒参考基因组中的CaWRKY基因并非一一线性对应关系,不同参考基因组中的CaWRKY基因放在一起进行命名以及染色体定位作图将给读者及后续研究带来困扰,因此,基于不同参考基因组独自对CaWRKY基因进行研究会更合适。
本研究中,辣椒幼苗接种辣椒疫霉菌后0、12、36 h的CaWRKY基因表达结果显示:接菌后12 h,抗病材料CM334和感病材料NMCA10399中分别鉴定出7个和3个显著差异表达CaWRKY基因;接菌后36小时,抗、感材料中分别鉴定出13和22个显著差异表达CaWRKY基因。该研究结果可以看出,在病原菌进行攻击后,抗、感材料均能做出持续反应,而在发病早期,抗病材料能够调动更多的CaWRKY基因参与到防御反应中来,这与LI等[22]的研究结果一致。类似的研究结果在番茄中也有报道:接种青枯病菌后24 h,在抗病材料中检测出的差异表达基因是感病材料中检出的2倍多,分别为1986和972个,而接种青枯菌后48 h,感病材料中检出的差异表达基因略多于抗病材料,分别为2887和2684个[24]。从以上研究结果推测,抗病材料对于病原菌刺激的反应快于感病材料,能够在发病早期快速调动更多的抗病相关基因进行应答,这可能对植株抗病防御反应至关重要。
SA和JA信号途径是与抗病相关的常见信号通路。DANG等[25]研究发现CaWRKY27在抗青枯病菌辣椒品种中受青枯病菌诱导表达上调,同时,CaWRKY27受SA、MeJA和ET诱导表达上调,在烟草中过量表达CaWRKY27后提高了对青枯病菌的抗性,且病程相关基因和SA、JA和ET相关基因表达上调,表明CaWRKY27在抗病防御中通过SA、JA和ET介导的信号途径起正调控作用。基因序列(CDS)比对发现,上述研究中的CaWRKY27与本研究中的CaWRKY15相似性最高(相似度达99.67%),不同的是,本研究中CaWRKY15未受辣椒疫霉菌显著诱导。另一报道中表明CaWRKY40通过SA、JA和ET信号通路在辣椒和烟草中协同调控植株应对青枯病菌攻击和热应激反应[13],同样经过基因序列(CDS)比对发现,该报道中的CaWRKY40与本研究中的CaWRKY25高度相似(相似度达99.72%)。本研究结果发现,接种辣椒疫霉菌后,CaWRKY25在抗病材料CM334中特有显著差异表达(表3),且受SA诱导上调表达同时受到MeJA抑制下调表达,推测该基因可能通过SA和JA信号通路协同调控辣椒植株应对辣椒疫霉菌防御反应,与前人报道的研究结果一致。
本研究基于辣椒(CM334)基因组全面鉴定了69个CaWRKY基因,在辣椒疫霉菌侵染后(包含12和36小时),抗、感材料中分别有15和22个差异表达CaWRKY基因,表明WRKY转录因子在植物抗病防御反应中发挥了重要作用。另外,从表3可以看出,相比感病材料,抗病材料对疫霉菌的应激反应更快速。信号通路分析表明,8个关键CaWRKY基因中有5个基因受SA(或MeJA)诱导(或抑制)表达,从而可以推测SA和JA信号途径是CaWRKY基因参与辣椒抗病防御反应的主要途径。本研究是在基因转录表达水平对CaWRKY基因的功能进行鉴定,因基因转录表达后还要经历翻译、修饰等过程才能行使功能,因此,转录表达水平上对基因功能的鉴定具有一定的局限性,要想进一步明确CaWRKY基因功能及其参与抗病防御反应的分子机制,还有望做基因沉默、过表达等进一步深入研究才可能实现。
