富马酸替诺福韦二吡呋酯致肾损伤的主动监测与危险因素分析Δ
2022-11-28王亚亚丁丽史国琴滕月鹏李彩东郭文娟缪苗苗魏秋芳古殿杰兰州市第二人民医院药剂科兰州730046兰州市第二人民医院肝病研究所兰州730046
王亚亚,丁丽,史国琴,滕月鹏,李彩东,郭文娟,缪苗苗,魏秋芳,古殿杰(.兰州市第二人民医院药剂科,兰州 730046;.兰州市第二人民医院肝病研究所,兰州 730046)
富马酸替诺福韦二吡呋酯(tenofovir disoproxil fu‐marate,TDF)属于核苷酸(nucleotide analogues,NAs)类抗病毒药物,于2008年被美国FDA批准用于治疗慢性乙型肝炎(chronic hepatitis B,CHB)。国家食品药品监督管理总局于2014年批准TDF可用于治疗CHB。TDF是《慢性乙型肝炎防治指南(2019年版)》推荐的主要抗病毒药物之一,因其具有迅速抑制乙型肝炎病毒(hepati‐tis B virus,HBV)复制、口服方便、耐药率低和安全性良好等特点被临床广泛使用[1-2]。由于TDF长期服用甚至终身服用的用药特点,其相关的肾脏不良反应报道逐渐增加[3-4]。现有关于TDF相关肾损伤的研究数据大多来自临床注册试验,其纳入的患者通常有严格的入组标准,或者来源于临床个案报道,缺乏真实世界的临床研究报道数据。真实世界研究具有样本量较大、耗时短、经费需求少、获取数据相对完善、医嘱信息完整、能获得院内用药数据、实验室检查数据准确性高的优势。本研究利用中国医院药物警戒系统(China Hospital Pharma‐covigilance System,CHPS),收集兰州市第二人民医院(以下简称“我院”)2019年1月1日至2021年12月31日使用TDF的真实世界样本数据,开展TDF致肾损伤的主动监测研究,对出现肾功能异常的患者进行临床特征分析,再由临床药师评价不良反应相关性并进一步确认TDF致肾损伤的阳性患者,然后探讨使用TDF后出现肾功能异常的可能相关因素,旨在为指导临床安全使用TDF提供参考。
1 资料与方法
1.1 数据来源
所有数据来源于2019年1月至2021年12月在我院住院就诊的患CHB且给予TDF抗病毒治疗的患者。通过CHPS,收集纳入患者的基本信息(性别、年龄、民族),用药时长(月),首次使用TDF前后肾功能相关实验室检查指标[血肌酐、估测肾小球滤过率(estimated glomeru‐lar filtration rate,eGFR)、胱抑素C、尿酸、尿素、尿蛋白],用药前后肝功能指标(总胆红素、谷丙转氨酶、谷草转氨酶、碱性磷酸酶)和血糖、血磷水平,患者肝病进展情况(诊断),合并疾病及合用药物情况。本研究经我院伦理委员会审查批准。
1.2 患者的纳入与排除标准
本研究患者的纳入标准为:(1)符合《慢性乙型肝炎防治指南(2019年版)》[1]的诊断标准;(2)使用TDF 3个月以上,且可追溯到首次使用TDF的时间;(3)TDF用药前后肾功能指标血肌酐、eGFR、胱抑素C、尿蛋白检查记录完整。排除标准为:(1)患者既往疾病包含慢性肾衰竭、糖尿病肾病、高血压肾病、肾移植等任何已经明确可造成肾损伤的原发性或继发性肾病;(2)使用TDF前肾功能指标基线值异常者[eGFR<60 mL/(min·1.732)或尿蛋白异常或胱抑素C高于正常值上限];(3)用药前观察指标缺失者;(4)合并肝衰竭终末期、肝恶性肿瘤中晚期、全身感染性疾病等严重疾病者。
1.3 药物性肾损伤阳性的判定标准
根据美国卫生及公共服务部常见不良反应术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0[5]和《慢性肾脏病评估及管理临床实践指南》[6],患者使用TDF后出现下列情况之一的评定为肾损伤阳性患者:(1)eGFR<60 mL/(min·1.732);(2)尿蛋白2+及以上;(3)胱抑素C高于正常值上限。根据药品不良反应评价标准,参照诺氏评估量表法,评价TDF与患者肾损伤的相关性,纳入评价结果为“肯定(≥9分)”“很可能(5~8分)”“可能(1~4分)”的患者。
1.4 CHPS主动监测方案的建立及数据收集方法
利用CHPS“药品评价系统”,建立TDF致肾损伤主动监测方案,数据来源时间段设置为2019年1月1日至2021年12月31日,患者来源设置为我院住院就诊的患CHB且给予TDF抗病毒治疗的患者,肾损伤标准设置为使用TDF前后肾功能相关检查指标(血肌酐、eGFR、胱抑素C、尿蛋白等)异常和肾损伤症状关键词(尿路症状异常、肾性水肿、肾损伤等),对TDF致肾损伤疑似患者进行主动监测。临床药师对CHPS主动监测发现的疑似患者逐一进行不良反应相关性评价,确认TDF致肾损伤的阳性患者,计算TDF致肾损伤的发生率(TDF致肾损伤的阳性患者数量/纳入患者数量×100%)。eGFR采用慢性肾病流行病学合作研究(CKD-EPI)公式计算[7]。
1.5 数据处理
采用Excel 2016软件对数据进行整理。统计分析利用SPSS 23.0软件。符合正态分布的计量资料采用±s表示,不符合正态分布计量数据采用M(P25,P75)表示;用药前后指标比较使用配对t检验,不符合正态分布或方差不齐者采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。通过对患者的性别、民族、年龄、用药时长、疾病进展(诊断)、合并疾病和联合用药数量等方面展开分层分析,探索TDF致肾损伤的可能危险因素,多组间比较采用χ2检验,组间两两比较采用α分割法。检验水准α=0.05。若同一因素有3个水平,则新的检验水准α=0.05/3=0.017,即P<0.017表示有统计学差异;若同一因素有4个水平,则新的检验水准α=0.05/4=0.012 5,即P<0.012 5表示有统计学差异。
2 结果
2.1 纳入患者的基本特征
2019年1月1日至2021年12月31日期间,共有1 859例住院患者使用TDF,根据排除标准排除633例患者,最终纳入患者1 226例。在纳入患者中,男性886例,女性340例,年龄主要集中在45~60岁,民族以汉族占比最多,其次为回族、东乡族、藏族;用药时长主要集中在13~24个月;有72例患者有高血压病史,55例患者有糖尿病史。数据详见表1。

表1 纳入患者的基本特征
2.2 TDF致肾损伤的阳性患者情况
在1 226例患者中,通过CHPS主动监测到血肌酐高于正常值上限、eGFR<60 mL/(min·1.732)、胱抑素C高于正常值上限、尿蛋白2+及以上的患者数量分别为136、60、367、41例;未监测到符合肾损伤症状关键词条件的患者。经CHPS主动监测,发现TDF致肾损伤疑似患者160例;经临床药师进一步评价,确认TDF致肾损伤的阳性患者64例(很可能23例,可能41例),TDF致肾损伤发生率为5.22%。数据详见表2。

表2 1 226例纳入患者中TDF致肾损伤的监测结果
2.3 TDF致肾损伤阳性患者用药前后检查指标分析
与用药前相比,TDF致肾损伤阳性患者用药后血肌酐、胱抑素C水平和尿蛋白2+及以上患者比例均显著升高(P<0.001),eGFR和血磷水平均显著降低(P<0.001),其余指标差异均无统计学意义(P>0.05)。数据详见表3。

表3 64例肾损伤阳性患者使用TDF前后主要观察指标比较
2.4 TDF致肾损伤相关因素分析
分层分析结果显示,用药时长超过36个月、疾病进展为肝硬化失代偿期、合用药物超过10种均与TDF致肾损伤有显著相关性(P<0.05或P<0.012 5)。数据详见表4。
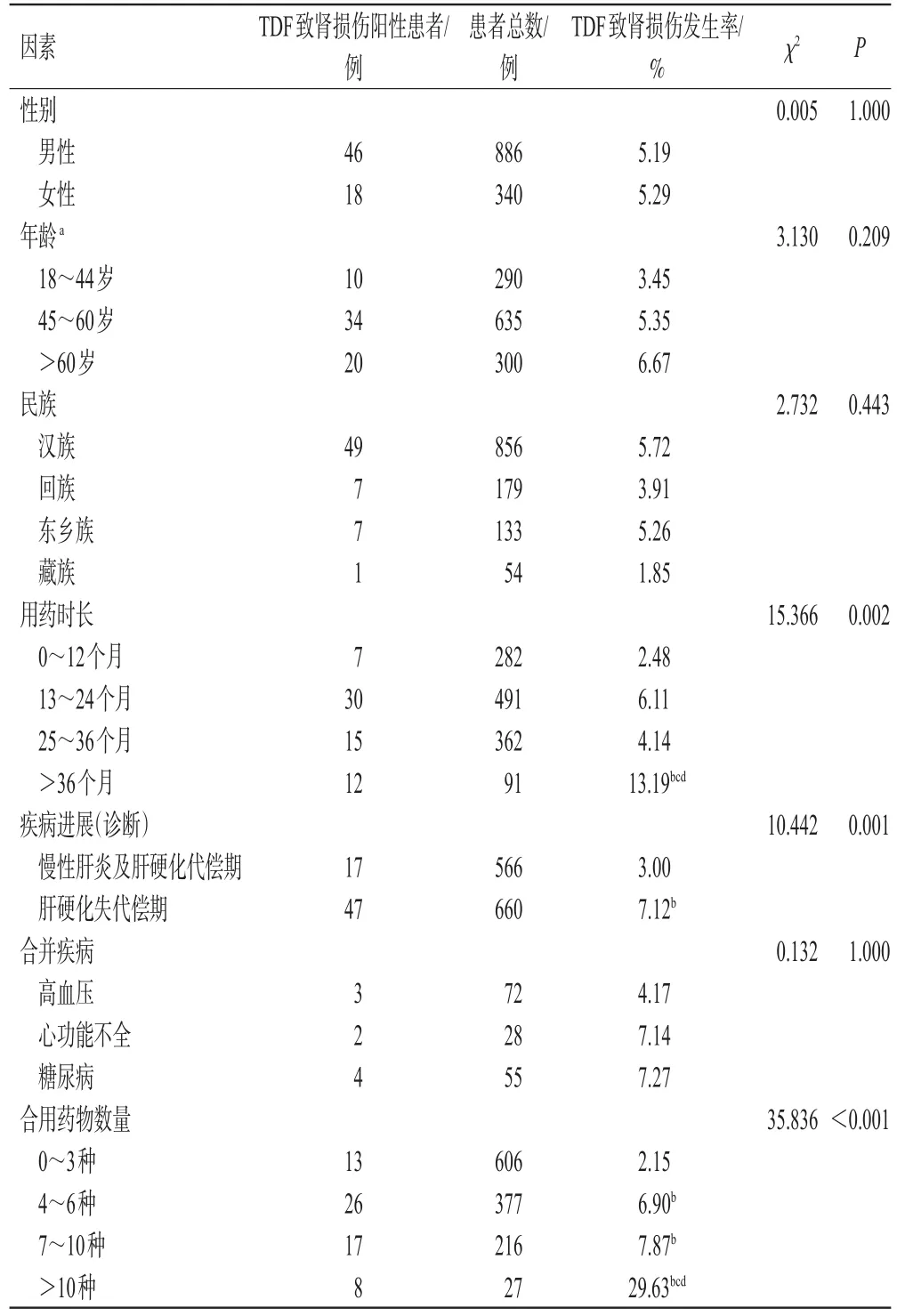
表4 TDF致肾损伤的危险因素分析
3 讨论
据WHO报道,截至2018年,全世界约有HBV感染者2.57亿,中国HBV感染者约7 000万例,其中CHB患者2 000万~3 000万例[8]。2005年至2009年全国乙型肝炎报告平均病发率为0.852 6‰,而甘肃省的平均病发率为2.303 8‰,可见甘肃省属于乙型肝炎高发地区[9]。NAs类药物是当前CHB患者抗病毒治疗的主要药物,长期服用可最大限度地抑制HBV复制,减轻肝脏炎症坏死及肝脏纤维组织增生,减少失代偿性肝硬化、肝衰竭和肝癌的发生。TDF因抗病毒作用强、耐药屏障高被临床广泛应用。由于HBV在体内无法被彻底清除,大多数接受NAs类药物治疗的CHB患者需要长期甚至终身服药,因此NAs类药物短期和长期的临床安全性不可忽视。Koklu等[10]发现,与基线eGFR相比,TDF较其他常用NAs类药物更容易降低eGFR。目前也有不少关于TDF致肾损伤的报道[4],因此探索TDF致肾损伤的危险因素对临床安全用药具有重要意义。
TDF作为前药,用于CHB患者的常规治疗剂量为300 mg,qd,口服后在体内水解为替诺福韦,替诺福韦在体内主要以肾小球滤过和肾小管主动分泌相结合的形式通过肾脏排泄[4]。TDF属于NAs类药物(由戊糖、碱基和磷酸构成),分子量较核苷类药物(由戊糖和碱基构成)大,其在肾脏的滤过速度较核苷类药物慢,这可能是TDF较核苷类药物致肾损伤发生率高的原因之一[11]。此外,有研究报道TDF致肾小管损伤的可能机制有:(1)基因缺陷导致外排转运蛋白缺失,使得进入肾小管细胞的药物难以外排至管腔,肾小管细胞内药物浓度过高致肾小管损伤;(2)由于CHB治疗的长期性,细胞内TDF浓度超过标准阈值时,人体内DNA聚合酶γ活性被抑制从而造成线粒体损伤,进而致肾小管损伤[12]。
TDF说明书中一项成人CHB和代偿性肝病受试者临床试验共纳入585例受试者,结果显示,约有2%的受试者出现血肌酐升高的现象;说明书中另一项成人CHB和失代偿性肝病受试者临床试验共纳入45例受试者,结果显示,有9%的受试者出现血肌酐升高的现象。一篇分析汇总了26项关于TDF安全性的研究,涉及3 566例患者,发现口服TDF后致肾功能异常的有57例,发生率约为1.6%[4]。Mak等[13]汇总文献发现TDF致肾损伤发生率约为2.6%。本研究结果显示,TDF致肾损伤发生率为5.22%,该值略高于前期文献研究报道,低于说明书中失代偿期肾损伤发生率,分析原因可能是:(1)本研究为住院患者真实世界的回顾性不良反应研究,疾病进展为肝硬化失代偿期患者占比高,且前期文献报道[14]及本研究相关因素分析结果均显示,疾病进展为肝硬化失代偿期是TDF致肾损伤的危险因素之一,因此本研究结果TDF致肾损伤发生率高于前期文献报道数据;(2)TDF说明书中的失代偿组发生率高除了与纳入患者疾病进展为肝硬化失代偿期有关外,还可能与样本量小有关。
本研究基于真实世界的临床数据,先经CHPS主动监测TDF致肾损伤疑似患者,再通过人工确认TDF致肾损伤阳性患者,探索真实世界中TDF致肾损伤的危险因素。结果显示,CHPS主动监测具有省时、省力、高效的特点,很大程度上减轻了人工筛选的负担;同时发现,用药时长超过36个月、疾病进展为肝硬化失代偿期、合用药物超过10种均是TDF致肾损伤的危险因素。此外,从本研究纳入的64例TDF致肾损伤阳性患者用药前后的检验指标对比结果还发现,与用药前相比,使用TDF除了会明显影响患者肾功能检验指标(血肌酐、eGFR、胱抑素C、尿蛋白)外,还能显著降低患者的血磷水平,这与已有报道一致[15-16],其具体机制有待进一步研究,但也从一定程度提示临床在使用TDF时应关注患者的血磷水平。
本研究仍存在以下局限性:(1)CHB患者药物性肾损伤的判定受多种因素影响,可能出现假阳性情况,如疾病自身因素,肝病患者可能会出现乙型肝炎相关性肾炎等;(2)本研究对象为住院患者,存在合并用药情况,可能出现潜在的药物间相互作用;(3)因随访时间仅为3年,且研究对象仅为我院住院患者,阳性组患者较少,可能存在阳性患者遗漏的情况。
