珊瑚礁生态系统病毒研究进展
2022-11-26余克服
陈 飚,余克服,*
1 广西大学广西南海珊瑚礁研究重点实验室,南宁 530004
2 广西大学珊瑚礁研究中心,南宁 530004
3 广西大学海洋学院, 南宁 530004
珊瑚礁是地球上最具生物多样性的生态系统,其仅占据约0.5%的海洋面积,却为近30%的海洋生物提供了栖息地,故被誉为海洋中的“热带雨林”[1—2]。病毒是珊瑚礁生态系统中数量最多的生物学实体,其数量约是珊瑚礁中其它微生物的10倍[3—4]。作为珊瑚礁生态系统中的一种特殊生命形式,病毒可以通过快速的水平基因迁移与编码辅助代谢基因的方式促进珊瑚礁生物进化[5—6]。此外,病毒也是珊瑚礁中生物地球化学循环的重要组成部分,其可通过感染裂解微生物的方式向珊瑚礁碳库贡献大量的溶解无机碳[4,7—8],并塑造微生物群落结构与整个生态系统的营养循环过程[7,9—11]。但是,与在人类社会中快速传播并危害公共卫生安全的病毒(例如当下全球蔓延的新型冠状病毒[12—13])相似,珊瑚礁生态系统中的病毒也会导致珊瑚产生严重的传染性疾病,例如“白色瘟疫”[14—16]、白带病[17]以及黄斑病(yellow blotch)[18]等,并导致活珊瑚覆盖度下降、生态系统快速退化等后果[19]。因此,病毒是影响珊瑚礁生态功能与健康状况的“双刃剑”。
南海珊瑚礁位于世界珊瑚多样性中心“珊瑚三角区”的北缘[20],从近赤道的曾母暗沙(4°N)至雷州半岛与涠洲岛(20—21°N)均有分布[21]。南海北部的大亚湾、防城港以及东山岛等亚热带气候控制区亦发育有未成礁的珊瑚群落(21—23°N)[22—24]。但是,受气候变化的影响,南海珊瑚礁发生快速衰退,整体退化速率甚至超过全球平均值[25]。但迄今为止,我国还未开展过关于珊瑚礁生态系统病毒学的相关研究,对南海珊瑚礁病毒的分布特征、生态功能以及环境响应知之甚少。因此,本文通过综述国际上珊瑚礁生态系统中病毒的相关进展,以促进我国珊瑚礁病毒学研究,为我国珊瑚礁生态系统的保护、珊瑚疾病的防治以及生物多样性维持等提供新的思路。
1 珊瑚礁病毒多样性与分布特征
国际病毒分类学协会(International Committee on the Taxonomy of Viruses,ICTV)现公认发现的病毒超过7个门,104个科,410属[4]。截止目前,科学家在全世界珊瑚礁中共发现超过60个病毒科,数量占已发现的所有病毒科数量的58%[4]。因此,珊瑚礁生态系统极具的病毒丰富度与多样性,是海洋中重要的病毒资源库。
1.1 珊瑚礁水体中的病毒多样性
珊瑚礁水体中的病毒数量约为106—108个/mL,其数量要高于珊瑚礁水体中的其它微生物一个数量级以上[3—4]。珊瑚礁水体中病毒的早期研究多基于透射电子显微镜技术(transmission electron microscopy,TEM)[26],其从病毒的形态与感染宿主类型的角度,将珊瑚礁水体中发现的大量类病毒颗粒(virus-like particles,VLPs)进行归类:
(1)噬菌体(Phage)。以细菌为宿主的类病毒颗粒被称为噬菌体,其在珊瑚礁水体的病毒群落中占据主导,主要类型包括:长尾噬菌体科(Siphoviridae)、短尾噬菌体科(Podoviridae)以及肌尾噬菌体科(Myoviridae)[27]。这些噬菌体类型也同样存在于珊瑚体内[28]。
(2)真核生物病毒(Eukaryotic viruse)。珊瑚礁水体中的真核生物病毒主要由藻类脱氧核糖核酸病毒科(Phycodnaviridae)、疱疹病毒科(Herpesviridae)以及双生病毒科(Geminiviridae)组成[4]。其中,藻类脱氧核糖核酸病毒科和疱疹病毒科能够存在于珊瑚及其它刺胞动物体内,而双生病毒科则在珊瑚体内十分罕见。
(3)古菌噬菌体 (Archaea phage)。小纺锤形噬菌体科(Fuselloviridae)和Salterproviridae以古菌为感染对象,其广泛分布于珊瑚礁的水体之中,但却未存在于珊瑚组织内[4]。这可能与珊瑚体内的古菌丰度较低有关。
但是,上述体系是基于透射电镜观测下类病毒颗粒的衣壳形态所进行的分类,并未从分子分类与系统进化分析的角度准确识别珊瑚礁水体中病毒。随着测序技术的发展,扩增子测序与宏基因组学被广泛运用到海洋病毒的检测中,相应地识别了珊瑚礁水体中的双链DNA病毒(dsDNA virus)、单链DNA病毒(ssDNA virus)以及单链RNA病毒(ssRNA virus):
(1)双链DNA病毒。该病毒包括以细菌为宿主和以真核生物为宿主2类。前者,即珊瑚礁水体中的噬菌体,主要由微小噬菌体科(Microviridae)、肌尾噬菌体科、短尾噬菌体科以及长尾噬菌体科组成[29—30]。后者,即珊瑚礁水体中的真核生物病毒,主要以浮游藻类为宿主。多样化的核质巨DNA病毒家族(nuclecytoplasmic large DNA viruses,NCLDVs)在此真核生物病毒群落中占据主导,包括巨型病毒科(Megaviruses)、藻类脱氧核糖核酸病毒科、虹彩病毒科(Iridoviridae)、拟菌病毒科(Mimiviridae)等[14,28—29,31—32]。
(2)单链DNA病毒。关于珊瑚礁水体中的单链DNA病毒的研究与数据解析相对匮乏,目前较为明确的仅有圆环病毒科(Circoviridae)[14]。圆环病毒科在珊瑚礁水体中的具有多样化的类型,并且能够感染礁区的真核生物。据报道,美属维尔京群岛(The United States Virgin Islands)珊瑚礁暴发的珊瑚疾病(白色瘟疫)与此病毒存在紧密的关联。
(3)单链RNA病毒。Culley等[33]基于病毒RNA聚合酶基因(Viral RNA polymerase gene)扩增与“鸟枪法”测序(Shotgun sequencing)等手段,发现了单链RNA病毒存在于热带珊瑚礁水体中,其主要由小核糖核酸病毒科(Picornaviridae)所组成。该科中许多病毒成员具备感染真核生物的能力[33—34]。
1.2 珊瑚共生功能体的病毒多样性与分布特征
珊瑚共生功能体中也含有大量的病毒,但其以类病毒颗粒的形式首次在刺胞动物(Cnidaria)体内被发现则是在珊瑚的近亲物种海葵(Actiniaria)体内。Wilson等[35]通过透射电镜技术,观察到海葵组织中存在大量直径约为60 nm的类病毒颗粒,形状多为二十面体,并且能够感染海葵的相关组织细胞(图1)。
(1)珊瑚组织。与珊瑚礁水体相似,早期关于珊瑚体内病毒的研究也是基于透射电镜观察的方法,其检测到丰富的类病毒颗粒的存在于珊瑚组织之中(图1)[36,38]。高温胁迫实验的结果表明:在25℃的条件下,珊瑚组织内的类病毒颗粒直径大多为30—40 nm与50—60 nm;但在32℃高温条件下,珊瑚组织内的类病毒颗粒直径整体增大,直径介于40—50 nm与60—80 nm之间,且病毒形态相比于正常条件下更为丰富多样[38]。因此,热压力与病毒感染、珊瑚白化之间存在着直接的联系。高温条件下,珊瑚组织体内的大直径病毒具备感染珊瑚共生虫黄藻(Symbiodiniaceae)的能力[38]。
(2)珊瑚黏液层(Surface mucus layer,SML)。珊瑚黏液层或珊瑚表面微层(Coral surface microlayer,CSM)是一个分割珊瑚与外环境的薄层,通常为5—170 μm[39]。珊瑚黏液层主要由珊瑚所分泌的黏液所构成,其中存在高比例富含碳氮的有机质,这为微生物的生长与繁殖提供了温床。据统计,珊瑚黏液层中的微生物极为丰富,其数量大约是海水的100倍[40]。许多研究发现,珊瑚黏液层中的类病毒颗粒的多样性显著高于珊瑚组织(图1)[37,41],这表明珊瑚黏液层对周围环境中的病毒具有显著的富集作用[36]。澳大利亚大堡礁的相关研究显示,2属17个亚类群的类病毒颗粒与珊瑚黏液层存在密切的关联,直径介于30—60 nm之间的多面体形态的类病毒颗粒在珊瑚黏液层中占据主导[4]。珊瑚黏液层中的许多类病毒颗粒与噬菌体、古菌病毒具有紧密的亲缘关系[42]。因此,存在于珊瑚黏液层中的病毒可能具有保护宿主免受病原菌感染、入侵的作用。
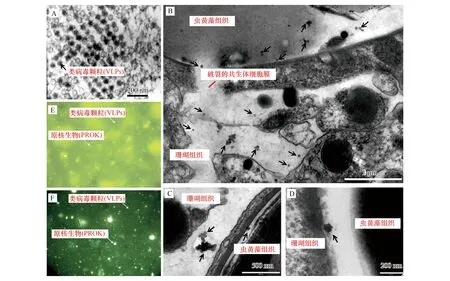
图1 海葵组织、珊瑚组织以及珊瑚黏液层的类病毒颗粒(VLPs)
与珊瑚礁水体的研究类似,早期关于珊瑚共生功能体中病毒研究也多是基于透射电镜观测与流式细胞术所开展的,而这些方法仅能为病毒的形态学分类提供证据。但由于病毒衣壳的大小与形态极具的变异性,因而上述方法可能会错误的将具有保守表型、但遗传物质差异很大的病毒归为一类[4]。因此,仅基于形态学观测的研究方法并不能完全解析珊瑚共生功能体内病毒的分类学特征(例如科或属水平)[28]。但随着基因组学、宏转录组学、蛋白质组学以及扩增子测序的发展与应用,珊瑚礁生态系统中病毒的分类特征已逐步明朗,珊瑚共生功能体的病毒多样性与群落结构得以被认识[30,43—46]。
1.3 珊瑚核心病毒组
最新的研究显示,珊瑚拥有一个核心病毒组,包含9—12个科并分属3个主要的病毒家系,分别为双链DNA病毒、单链DNA病毒,以及单链逆转录病毒[28]。
(1)双链DNA病毒。有尾噬菌体目(Caudovirales)在珊瑚共生功能体的核心病毒组中占据主导,并以长尾噬菌体科、短尾噬菌体科以及肌尾噬菌体科最为常见[4,28]。除噬菌体外,藻类脱氧核糖核酸病毒科、拟菌病毒科、痘病毒科(Poxivrirdae)、虹彩病毒科、疱疹病毒科以及囊泡病毒科(Ascoviridae)也是核心病毒组重要成员[28,47]。值得注意的是,属于核质巨DNA病毒家族的藻类脱氧核糖核酸病毒科与拟菌病毒科几乎存在于所有珊瑚体内,且痘病毒科、虹彩病毒科、疱疹病毒科也在90%以上的珊瑚样本中被发现[4]。另外,异疱疹病毒科(Alloherpesviridae)、疱疹病毒科、软体动物疱疹病毒科(Malacoherpesviridae)中的许多非典型病毒类型(atypical viruses)也在核心病毒组中具有较高的丰度[28]。这些特殊的疱疹病毒类型在珊瑚组织细胞的细胞核中不显示出病毒的典型复制过程,且形态与传统疱疹病毒存在明显的差异[28]。
(2)单链DNA病毒。单链DNA病毒是珊瑚核心病毒组的重要成员[4]。但是,在早期涉及组学的研究中,珊瑚病毒分离技术与组学数据解析等方法尚不完善,这导致了至少在90%的样本中的单链DNA病毒是被研究者所忽略[28—29,43]。例如:由于受宏转录组测序深度不足与mRNA聚腺苷酸化的影响,以往的珊瑚宏转录组研究未检测到小型圆环单链DNA病毒(Small circular ssDNA viruses,SCSDVSs),而此病毒却在经纯化的珊瑚宏基因组文库中被发现[4,14]。
(3)单链逆转录病毒(Retrovirus)。除双链DNA病毒与单链DNA病毒外,珊瑚核心病毒组中还存在单链逆转录病毒。但早期的宏转录组研究无法通过成熟的生物信息学分析手段识别所获得的序列是否属于正确的病毒序列或逆转录因子,这造成研究者难以准确注释珊瑚共生功能体内的逆转录病毒[4,29]。而最新的研究发现,在珊瑚共生功能体的宏转录组测序数据中,有一部分的逆转录序列属于逆转录病毒[28,31,48]。因此,需要对珊瑚已有的病毒组学数据进行重新解析或采用多组学连用的技术手段,才能有效判断此类病毒是否确实属于珊瑚核心病毒组中重要成员。
2 珊瑚礁病毒的生态功能
感染宿主是病毒体现其生物学特征与生态功能的主要形式。病毒能够通过感染活动直接或间接地影响珊瑚礁生态系统中的生物进化与生物地球化学循环。
2.1 珊瑚礁病毒感染宿主方式
珊瑚礁病毒感染宿主的方式一般分为感染裂解与溶原作用[4,9]。以噬菌体为例,烈性噬菌体的感染裂解细菌通常分为5个阶段,即吸附、侵入、复制与生物合成、装配以及裂解,该过程可在短时间内连续完成[49]。而温和噬菌体则可通过将自身基因组整合至宿主基因组上的方式,随宿主基因组的复制而产生同步复制,且不造成宿主细胞裂解[49—50]。
珊瑚礁水体中含有丰富的烈性噬菌体,其可通过感染裂解细菌宿主的方式,向水体中释放大量的有机和无机营养物质,供未被感染或无法被感染的其它礁区生物使用[4]。Knowles等[9]对全球223个珊瑚礁水体样本的检测结果发现,珊瑚礁水体中含有丰富的病毒(9.03×105—3.86×107类病毒颗粒/mL)与细菌(8.08×104—6.75×106细菌/mL),且病毒的数量要显著高于细菌。此外,珊瑚礁水体中病毒单日能够感染裂解的细菌量极高,如法属波利尼西亚珊瑚礁水体中每日裂解的细菌量是库存细菌量的24%—367%[7],此过程能够为珊瑚礁区水体提供1.0—62.0 μg/天的溶解有机碳(dissolved organic carbon,DOC)[7]。因此,病毒感染裂解细菌是珊瑚礁区碳库的重要物质来源,对珊瑚礁生态系统的生物地球化学循环起到重要影响。
除烈性噬菌体外,温和噬菌体则是通过溶原作用的途径感染宿主。Bouvy等[10]研究发现,在南太平洋阿赫环礁和塔卡罗阿环礁(位于土阿莫土群岛)区域,有2.5%—89.9%的细菌受温和噬菌体感染转变为溶原性细菌(lysogenic bacteria)。最新针对太平洋和大西洋的24个珊瑚礁病毒组的研究显示,珊瑚礁中微生物的生物量越高则温和噬菌体的比例越大,并在某些情况下病毒的感染方式能够由感染裂解转变为溶原作用[8]。这一发现打破了以往研究者所认为的病毒-宿主生物动力学模式,即“Kill-the-Winner”(杀死-胜利)模式,而“Piggyback-the-Winner”(依附-胜利)病毒-宿主动力学模式可能更适用于珊瑚礁生态系统[4,9]。因此,相比于烈性噬菌体,温和噬菌体对珊瑚礁微生物群落的塑造作用更强。
2.2 促进生物进化
珊瑚礁生态系统中,温和噬菌体的溶原作用会通过水平基因迁移或传导的方式改变细菌宿主的基因组成,从而实现细菌物种的进化[4—5,51]。据报道[52—55],病毒可以编码宿主辅助新陈代谢的相关基因(auxiliary metabolic gene,AMG),例如:光合系统、碳代谢、核酸代谢等,此过程能够增强宿主的生长速率,并调控宿主的健康状况。Paul等[56]研究发现,温和噬菌体可通过抑制细菌宿主新陈代谢的方式促使其在寡营养的海域长期生存。相反,在营养水平较高的珊瑚礁区域,温和噬菌体则会通过溶原作用提高细菌宿主的新陈代谢功能[4]。此外,由病毒所主导的水平基因迁移还能改变细菌宿主群落的毒力水平。已有研究发现,珊瑚病原菌溶珊瑚弧菌(Vibriocoralliilyticus)基因组中存在被温和噬菌体所编码的毒力基因,且位于染色体毒力岛上的毒力因子基因也在溶珊瑚弧菌的一些菌株中被检测到[6]。因此,珊瑚礁病毒可以介导礁栖微生物遗传物质的快速迁移,并在珊瑚礁微生物的进化与毒力水平的增加中起到重要作用。
另外,病毒的感染活动在珊瑚礁生态系统中极为活跃,其不仅会引发高的水平基因迁移速率,还会塑造微生物宿主群落多样性与组成[4]。虽然,珊瑚礁生态系统中由病毒介导的水平基因迁移速率还未被精确测定,但在其他的海洋环境中已经得到了验证。以位于美国佛罗里达坦帕湾(Tampa Bay)的河口区域为例,病毒在该亚热带区域具有更高水平的感染活动,其所介导水平基因迁移数高达1014次/a,水平基因传递速率高于热带区域6个数量级[52]。Rodriguez-Brito等[57]通过检测4个不同盐度海洋环境的病毒与细菌时发现,病毒能够塑造细菌的多样性与群落组成,病毒与细菌的的种群规模可以在稳定的海洋生态系统中进行短期、快速波动。
2.3 生物地球化学循环
碳循环是珊瑚礁中重要的生物地球化学循环过程[8,21,58—59],而病毒则可以通过感染裂解异养细菌的方式向珊瑚礁水体中释放DOC,进而影响贫营养的珊瑚礁中的碳循环过程[7]。Payet等[7]分析奥普诺湖湾珊瑚礁水体中的DOC时发现,病毒感染裂解细菌的产物可以贡献2%—15%的DOC含量(假定珊瑚礁生态系统中的平均DOC含量为68 μM[60]),并为珊瑚礁生态系统中的异养细菌提供DOC和相关营养来源。该过程所贡献的DOC含量大约是寡营养的极地生态系统的1—90倍[61—62]。病毒所贡献的DOC的含量在珊瑚礁的不同地貌带之间也存在差异,其与病毒产物量的空间变化规律相一致。礁后区域的日病毒产物量最低(11.8×109病毒/L),岸礁区域的日病毒产物量最高(6.1×109病毒/L)[7]。而礁后和岸礁区域病毒每日感染裂解细菌的DOC释放量则分别为4.2 μg/L与 7.8 μg/L[4,7]。生物因素(如:浮游植物、低核酸细菌、高核酸细菌等)和非生物因素(如:溶解态活性磷酸盐、溶解无机碳)可以部分解释珊瑚礁不同地貌带病毒感染裂解产物量的差异,且一般认为控制病毒产物量的主要生物因素为低核酸细菌量,而非生物因素则为溶解态活性磷酸盐[7]。但基于距离线性模型(Distance-based linear model,DistLM)方法的分析结果仅能解释病毒产物量47%的变化规律(生物因素:28%;非生物因素:19%)[7],因此,后续的研究还需结合不同的统计学模型和更多的生物、非生物因素进行深入探索。另外,许多研究发现,珊瑚礁病毒的感染活动还为底栖生物提供了大约10%的总固碳量[4,63—64],这表明珊瑚礁中的病毒对大型生物的碳循环过程也具有显著的影响。
除碳循环外,珊瑚礁还是进行高效氮循环的海域[25]。珊瑚礁中氮的迁移转化不仅对其本身生态系统的初级生产力至关重要[65—66],而且还影响着整个海洋生态系统中氮的生物化学循环[66—68]。目前,国际上的研究尚不清楚病毒能否影响珊瑚的氮循环过程,但是,可以明确的是病毒可以感染参与珊瑚礁氮循环过程的浮游藻类[4]。以夏威夷欧湖岛的珊瑚礁为例,Culley等[69]以病毒DNA聚合酶基因为分子标记(病毒DNA合成必须的酶)发现了藻类脱氧核糖核酸病毒科具有很高的病毒多样性,且该科中的许多新型单链DNA病毒已经感染了欧湖岛卡内奥赫湾珊瑚礁区的浮游藻类。如果珊瑚礁浮游藻类受病毒爆发影响发生大规模的消亡,势必会影响到珊瑚礁生态系统的氮循环过程与初级生产力。此外,已有研究在热带海洋的水体中发现了多样化的类小核糖核酸病毒(Picornavirus)和类藻类脱氧核糖核酸病毒序列,这些病毒可能会感染生存于水体中的甲藻、硅藻以及其他原生动物,并进一步影响珊瑚礁生态系统的氮循环过程[4]。
3 珊瑚礁病毒对全球气候变化的响应
3.1 热压力
全球海洋变暖是导致珊瑚大规模白化与死亡的直接原因[21,70—72]。虽然许多珊瑚共/附生微生物组成员(例如虫黄藻和细菌)应对热胁迫时的生态功能已被阐明[24,73—76],但在热胁迫期间病毒对珊瑚健康状况的影响机制却尚不明确。已有研究显示,珊瑚在受到热胁迫时,其所分泌黏液中的病毒含量可增加约10倍,且感染活动异常频繁,这能够有效调整热胁迫条件下珊瑚黏液层的微生物群落结构[41]。Vega Thurber等[44]通过室内升温实验发现,在适宜温度条件下(珊瑚生长状态健康),扁缩滨珊瑚(Poritescompressa)体内病毒群落主要由23%的杆状病毒科(Baculoviridae)和30%的多脱氧核糖核酸病毒科(Polydnaviridae)成员组成,而在热胁迫条件下(升温5℃,珊瑚处于亚健康状态),疱疹病毒科(图2)则在珊瑚体内病毒群落中占据主导(相对丰度为70%)。据报道,疱疹病毒科中的许多成员具备感染无脊椎动物(例如:人工养殖的双壳类)的能力[78]。因此,由热压力所引发的疱疹病毒丰度的增加可能会破坏珊瑚及其它刺胞动物的免疫系统健康[44,79],并威胁珊瑚礁生态系统的稳定性。

图2 4种典型的珊瑚礁真核生物病毒
另外,病毒还介导了热压力条件下珊瑚-虫黄藻共生体系的崩溃过程[31,80—81]。Correa等[31]从受热胁迫(31.5℃,12小时)的Montastraeacavernosa的共生虫黄藻细胞中分离出了核质巨DNA病毒与单链RNA病毒。进一步分析发现,藻类脱氧核糖核酸病毒科(图2)在M.cavernosa的病毒群落中占据主导,其丰度约为69%[31],此病毒能够感染虫黄藻并破坏珊瑚-虫黄藻共生体系的稳定性[4,31,77]。此外,M.cavernosa的病毒群落中还包含与异甲藻单链RNA病毒(ssRNAHeterocapsacircularisquamavirus)具有很高同源性的新型病毒序列[31],这对热压力影响下的珊瑚-虫黄藻共生体系而言可能是一个全新的威胁。另外,在热压力条件下,新型病毒的丰度会显著增加,并影响珊瑚-虫黄藻共生体系的健康状况。据大堡礁的相关研究显示[28],在自然海区受高温胁迫的多孔鹿角珊瑚(Acroporamillepora)体内检测到了直径为300—500 nm新型的核质巨DNA病毒(图2),其同样具备感染裂解虫黄藻细胞的能力。因此,珊瑚的热白化过程与病毒活动存在紧密的关联。然而,病毒是否会通过感染裂解作用调控珊瑚共生虫黄藻的切换与重组尚未可知,值得深入探索。
3.2 珊瑚疾病
除热压力外,珊瑚疾病也是导致珊瑚礁大规模退化的主要原因之一[79,82]。据统计[20,83—85],自20世纪70年代以来,受气候变化的影响,珊瑚疾病的发生规模与发病率持续增加,累计感染疾病的珊瑚106种,范围涉及全球54个国家的珊瑚礁。虽然,许多的珊瑚疾病是由病原菌感染所致,例如引发珊瑚黑带病的病原体是由硫酸盐还原菌(Desulfovibriospp.)、硫化物氧化菌(Beggiatoaspp.)以及氰细菌(Phormidiumcorallyticum)所组成的细菌团[85—86]。但是,对珊瑚极具威胁的“白色瘟疫”、黄斑病、白带病等疾病则与病毒直接感染珊瑚宿主细胞存在紧密的关联[19,44]。
以具有较高发病率的“白色瘟疫”为例,该疾病的感染、扩散速率极快(损伤扩散速度为0.3—20 cm/天)[15—16],并能够在同个礁区的珊瑚个体之间实现传播[15],对珊瑚礁造成极大的破坏。“白色瘟疫”可依据发病过程划分为3个类型,分别为白色瘟疫-I、白色瘟疫-II以及白色瘟疫-III。其中,白色瘟疫-II是由于珊瑚受耗氧异养型微生物橙单细胞菌(Aurantimonascoralicida)的感染所致[87—88],但白色瘟疫-I和白色瘟疫-III两个类型的病原体至今尚不明确。因此,许多研究认为,病毒可能是导致珊瑚罹患“白色瘟疫”的主要原因[4,14]。Soffer等[14]通过透射电镜与454焦磷酸测序技术分析发现,在罹患“白色瘟疫”的Montastraeaannularis组织中,存在大量能够感染真核生物的小型圆环单链DNA病毒(图2),而病原菌则未存在于珊瑚组织内。相较于其它类型病毒,圆环病毒科是罹患“白色瘟疫”珊瑚体内丰度最高的病毒类型,且健康珊瑚体内圆环病毒的丰度要显著低于疾病珊瑚[4]。此外,多种不同类型的病毒可能会共同参与介导 “白色瘟疫”。许多研究显示,藻类脱氧核糖核酸病毒科和疱疹病毒科也在罹患“白色瘟疫”的珊瑚体内具有极高的丰度,这些病毒能够分别感染共生虫黄藻与珊瑚细胞,并造成珊瑚共生功能体的生理功能的紊乱[4,14,77,89]。另外,珊瑚宏转录组的最新研究也表明[90],噬菌体和真核生物病毒在波多黎各受“白色瘟疫”暴发影响的Orbicellafaveolata体内具有最高的转录子丰度,这进一步证实了病毒在“白色瘟疫”爆发期间具有活跃的感染活动。但是,在珊瑚“白色瘟疫”的发病过程中,不同病毒类型感染活动的激活条件、感染活动发生的先后顺序以及宿主(珊瑚与虫黄藻)细胞的免疫应答机制尚不清楚,这对全面揭示病毒介导“白色瘟疫”的致病机理至关重要,需要更为深入的研究与探索。
病毒所介导的疾病可通过水体实现跨珊瑚物种的传播,进而引发整个礁区的珊瑚疾病暴发。已有的研究表明,疑似由病毒所介导的 “白色瘟疫”[14—15]、白带病[17]以及黄斑病[19]均具有传染性。Patten等[91]对大堡礁赫伦岛与利泽德岛爆发“白色综合征”(疑似“白色瘟疫”)珊瑚疾病的礁区水体开展相关研究发现,疾病珊瑚上方水体中的病毒含量是周围水体的4倍。另外,由于珊瑚黏液层具有富集水体中病毒作用[36],这可能会加快病毒在珊瑚群体之间的传播。Nguyen-Kim等[41]对越南芽庄珊瑚礁的病毒研究发现,珊瑚黏液层是病毒感染活动的热点区域,其病毒丰度(3.9×107病毒/mL)、每小时病毒产物量(1.9×106病毒/mL)以及溶原细胞生成率(8.5%)均显著高于礁区水体(病毒丰度:1.5×107病毒/mL;每小时病毒裂解产物:0.2×106病毒/mL;溶原细胞生成率:3.8%)。因此,水体中的病毒可能是通过珊瑚黏液的富集作用进入珊瑚体内,进而感染珊瑚宿主细胞。
4 展望
病毒作为地球上重要的生物学实体,其在珊瑚礁中的生物进化、生物地球化学循环以及全球环境响应中起到了关键作用。随着气候变化进程的加剧,全球珊瑚礁将面临着热压力激增与珊瑚疾病大规模爆发的威胁[44,92],而病毒活跃的感染活动会直接影响到整个生态系统的健康水平与环境适应性。目前,国际上关于珊瑚礁病毒的研究尚处于初步阶段,仅对珊瑚礁病毒的分布特征、生态功能以及环境响应机制开展了零星工作,而国内目前还未开展过关于珊瑚礁病毒的相关研究。
南海珊瑚礁总面积约为30000 km2,约占世界珊瑚礁总面积的2.57%[93],其对南海生物多样性的维持与生态资源的供给具有极为重要的作用[25]。但是,在气候变化的持续影响下,南海珊瑚礁处于快速退化的处境之中,其速率甚至高于全球其它区域的珊瑚礁[21]。基于活珊瑚覆盖度[94—95]、虫黄藻密度[96]等生态指标的分析显示,终年受高温影响的南沙群岛珊瑚礁已处于亚健康状态。朱志雄等[97]对西沙群岛的珊瑚主要疾病的研究也发现,该区域存在9种不同症状的珊瑚疾病,且珊瑚疾病在西沙群岛具有较高的发病率。而上述生态现象的出现必然伴随着活跃的病毒感染活动及其对珊瑚礁生物地球化学循环过程的影响。因此,揭示病毒在南海珊瑚礁生态系统中的分布特征、生态功能以及环境响应机制,将为科学评估气候变化背景下,南海珊瑚礁的健康状况与环境适应性提供重要依据。
结合国际上关于珊瑚礁病毒的研究进展与南海珊瑚礁的生态现状,建议从以下几个方面开展相关研究:
(1)南海珊瑚礁生态系统中病毒的时空分布特征及其变化规律。相比于珊瑚礁中的其它微生物(例如虫黄藻、细菌、古菌、真菌等),关于病毒分子生态学的研究依旧十分匮乏。可通过深入分析病毒多样性、群落组成、潜在宿主、交互作用的时-空变化特征,揭示南海珊瑚礁中病毒的功能特征及其生态影响。
(2)病毒对南海珊瑚热白化、珊瑚疾病的介导作用及其与气候变化的关系。通过野外调查和室内实验相结合的研究方式,针对与气候变化相关特征指标,深入分析高温、富营养化、酸化等对病毒活动的诱导作用,明确由病毒所引发珊瑚疾病的类型。建议采用多组学(宏基因组、宏转录组以及蛋白质组)联用、酶联荧光原位杂交(Catalyzed reporter deposition fluorescent in situ hybridization,CARD-FISH)等新一代分子技术手段,对南海珊瑚共生功能体的宏病毒组开展系统研究。
(3)病毒对南海珊瑚礁生物地球化学循环的贡献。可从南海珊瑚及其它礁栖生物的分泌物入手,并结合水体、沉积物等多类型样本,探索病毒在珊瑚礁生物地球化学循环中所起的作用,完善珊瑚礁生态系统的碳循环与氮循环框架。
