体外循环心脏瓣膜置换术患者术后心肌酶谱变化及其与心肌损伤及预后的关系
2022-11-26李思晨叶建明范庆浩费苏鹏郑盛弘张玉梅
李思晨 叶建明 范庆浩 费苏鹏 郑盛弘 赵 涵 张玉梅
浙江省金华市人民医院心胸外科,浙江金华 321000
体外循环心脏瓣膜置换术是现阶段先天性、后天性心脏病主要治疗手段之一,其作为一项成熟的心外科手术技术,术后患者多数能达正常寿命,但部分患者会出现心肌持续受损、心功能恢复不佳等表现,且以心脏瓣膜病变最为显著[1-3]。体外循环心脏瓣膜置换术操作期间需建立体外循环,其利用特殊装置引出回心静脉血,并进行其他交换、温度调节、过滤等操作,再将其输送回主动脉。随着医学技术的不断进步,不断有研究发现,体外循环虽能为心外科手术提供一个无血手术空间和相对安全手术时间,但患者心脏此时需承受长时间停止搏动和血液供应,出现非搏动性灌注、控制性低血压、体温大幅升降等,故该操作会在一定程度上导致心肌缺血再灌注损伤,同时手术也会对心肌造成一定损害[4,5]。近年来有部分研究发现,心脏瓣膜置换术心肌损伤可能是因心肌酶谱异常所致,且该指标上升对患者的预后也有一定预测作用[6,7]。因此,本研究对浙江省金华市人民医院实施体外循环心脏瓣膜置换术患者术前及术后各时段心肌酶谱变化情况进行统计,分析其与心肌损伤及预后之间的关系,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选择2017 年2 月至2019 年2 月于浙江省金华市人民医院住院并接受体外循环心脏瓣膜置换术治疗的98 例患者。纳入标准:①首次实施体外循环心脏瓣膜置换术,且手术前后均接受心肌酶谱检查;②符合美国麻醉师协会(American Society of Anesthesiologists,ASA)[8]分级标准中Ⅱ、Ⅲ级标准;③符合纽约心脏协会(New York Heart Association,NAHY)[9]分级标准中Ⅱ、Ⅲ、Ⅳ级标准;④入组患者临床病历及随访资料均完整,能准确获得研究所需全部信息。排除标准:①姑息性或二次开胸手术;②手术过程中转为其他手术、术中死亡等;③因多种原因导致术后未接受心肌酶谱检测;④术前合并严重肝肾功能不全、糖尿病、凝血功能障碍等。依据临床心肌损伤分组根据瓣膜学术联盟(valve academic research consofiium,VARC)标准[10]分为损伤组(n=52)和对照组(n=46)。损伤组男30 例,女22 例;年龄55~84 岁,平均(75.36±6.84)岁;麻醉分级Ⅱ级32 例,Ⅲ级20 例,心功能分级Ⅱ级25 例,Ⅲ级21 例,Ⅳ级6 例。对照组男26 例,女20 例;年龄54~82 岁,平均(76.01±6.33)岁;麻醉分级Ⅱ级29 例,Ⅲ级17 例,心功能分级Ⅱ级23 例,Ⅲ级19 例,Ⅳ级4 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已通过浙江省金华市人民医院伦理委员会审核批准(伦理审批号:2017-007)。
1.2 方法
1.2.1 心肌酶谱检测 观察入组患者均于术前、术后1 d、术后7d、术后14d 分别抽取外周静脉血5ml,离心(3000 转/min,10min)后取血清置于-20℃冰箱保存,使用Vitros DT system 型自动分析仪检测心肌酶谱指标变化情况,包括谷草转氨酶(aspartate aminotransferase,AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)、α 羟丁酸脱氢酶(α-hydroxybutyrate dehydrogenase,α-HBDH);对比分析两组患者术前及术后各时间段心肌酶谱指标变化情况。
1.2.2 预后统计 入组患者术后均实施为期2 年(截止至2021 年2 月)随访调查(门诊随诊、家访随诊、电话随诊等),包括患者出院后的治疗效果、病情变化、恢复情况,并给予一系列专业性指导意见及建议,同时观察两组患者的死亡情况。
1.3 统计学方法
采用SPSS 17.0 统计学软件对数据进行分析和处理,计量资料以均数±标准差()表示,两组间比较采用t检验,多样本采取单因素方差分析;计数资料以例数(百分率)[n(%)]表示,无序分类资料采用χ2检验;均采取为双侧检验,并以P<0.05为差异有统计学意义。生存分析采用Kaplan-Meier法进行生存期比较并绘制生存期曲线,采用Log-rank 检验损伤组与对照组间统计学差异;使用受试者工作特征(receiver operating characteristic,ROC)曲线分析心肌酶谱术后峰值(术后1d)各项指标对患者临床结局预测效应,并计算曲线下面积(area under the cure,AUC)、95%可信区间,计算约登指数,即:约登指数=敏感度-(1-特异性)。
2 结果
2.1 入组全部患者术前及术后各时段心肌酶谱变化情况
入组98 例手术患者心肌酶谱(AST、LDH、CK、CK-MB、α-HBDH)均于术后1d 升高(P<0.05),并于术后7d、14 d 逐渐下降(P<0.05),见表1。
表1 入组全部患者术前及术后各时段心肌酶谱变化情况(,U/L,n=98)

表1 入组全部患者术前及术后各时段心肌酶谱变化情况(,U/L,n=98)
注:*P<0.05
2.2 损伤组和对照组术前及术后各时段心肌酶谱变化比较
损伤组和对照组手术患者心肌酶谱(AST、LDH、CK、CK-MB、α-HBDH)均于术后1d 升高(P<0.05),并于术后7d、14d 逐渐下降(P<0.05),且损伤组术后1d 升高明显高于对照组(P<0.05),见表2。
表2 损伤组和对照组术前及术后各时段心肌酶谱变化比较(,U/L)

表2 损伤组和对照组术前及术后各时段心肌酶谱变化比较(,U/L)
注:同组间比较,*P<0.05;与损伤组比较,#P<0.05
2.3 损伤组和对照组随访2 年生存结局
98 例患者术后生存率为85.71%(84/98),其中损伤组生存率为78.85%(41/52),对照组生存率为93.48%(43/46),Log-rank 检验计算P=0.35,见图1。
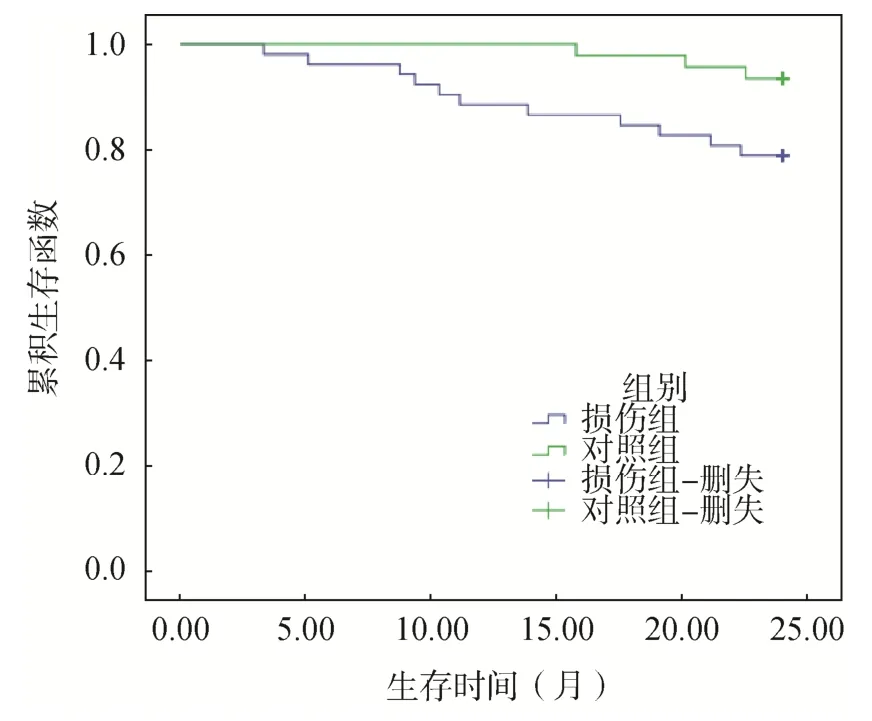
图1 损伤组和对照组随访2 年生存期曲线
2.4 术后1d心肌酶谱指标对患者预后预测价值分析
ROC 曲线分析结果显示:术后1d 血清AST 的AUC 为0.725(95%CI:0.615~0.824)、LDH 的AUC 为0.685(95%CI:0.567~0.798)、CK 的AUC 为0.653(95%CI:0.526~0.766)、CK-MB的AUC 为0.867(95%CI:0.753~0.934)、HBDH的AUC 为0.624(95%CI:0.502~0.745),见表3、图2。

图2 术后1d 心肌酶谱指标对患者预后预测价值ROC 曲线分析
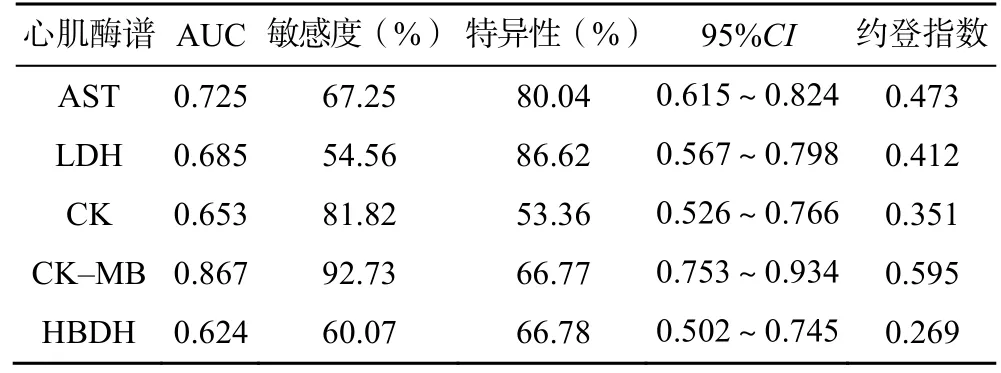
表3 术后1d 心肌酶谱指标对患者预后预测价值ROC 曲线分析
3 讨论
近年来随着医学技术的不断发展,心脏介入手术日渐增多,冠状动脉搭桥手术逐渐减少,但对于心脏瓣膜疾病患者而言,外科手术仍为其最佳且唯一有效的治疗方案[11]。体外循环心脏瓣膜置换术作为心脏瓣膜疾病患者主要的治疗方法之一,部分研究显示其术后患者心肌损伤发生率相对较高,严重影响手术效果;也有部分研究发现,心脏手术患者术后心肌损伤与心肌酶谱间关系密切[12-15]。因此。本研究选择浙江省金华市人民医院体外循环心脏瓣膜置换术患者进行研究,结果显示,患者术前及术后1、7、14d 心肌酶谱分析显示,损伤组、对照组患者心肌酶谱均于术后1d 升高,并于术后7d、14d逐渐下降,但总体仍高于术前,与张亮等[16]的研究结果类似。本研究还将损伤组、对照组各指标进行对比分析发现,心肌损伤患者术后1d 各指标升高明显高于对照组,可能是由于术中心肌做功与氧供失衡所致。体外循环心脏瓣膜置换术主要是通过体外循环技术直视心脏瓣膜,但该手术易导致患者出现血流动力学剧烈波动,机体重要器官灌注出现相对不足、缺氧状态;在此期间低体温会降低器官代谢率,且随着复温的持续,组织器官代谢逐渐活跃,需氧量相对增加,复温至心脏复跳,故此过程中可能会造成心肌损伤,导致术后出现心肌酶谱变化[17-19]。
文小霞等[20]研究证实,心脏手术患者术后心肌损伤对其预后影响严重,本研究结果也显示心肌损伤患者 2 年生存率低于未损伤患者 78.85% vs 93.48%。为进一步探讨心肌酶谱与体外循环心脏瓣膜置换术患者预后的关系,本研究选择术后1d 心肌酶谱指标行ROC 曲线分析,结果显示心肌酶谱升高对其预后具有一定影响。体外循环心脏瓣膜置换术术中可能因多种因素导致心肌出现短暂缺氧状态,心肌酶谱指标明显上升,而心肌酶谱是心肌细胞坏死后释放的各种酶,其主要代表心肌细胞受损状态,故心肌酶谱变化对患者预后具有一定的预测价值[21,22]。
本研究也存在一定局限性,因本研究为单中心研究,样本量相对较小,导致研究结果可能存在选择偏倚,无法全面反映国内实施体外循环心脏瓣膜置换术患者心肌酶谱实际情况;心肌酶谱检测方案本身也存在一定误差,且不同患者并非每日接受检查,无法准确反映其实时变化趋势,但本研究结果是对比术前基线与术后峰值间差异,故仍具有统计学效力。
综上所述,体外循环心脏瓣膜置换术患者术后心肌酶谱呈不同程度升高,于术后7~14d 逐渐降低,而心肌受损患者心肌酶谱指标术后1d 明显高于未损伤者;心肌损伤患者术后2 年生存率相对较低,且术后1d 心肌酶谱上升对其预后有一定预测价值。
