乙型肝炎慢加急性肝衰竭患者血清IL-12、VEGF、sST2、MCP-1 水平及其与肝功能的相关性分析
2022-11-26陈媛荀运浩谌翠容孙振江
陈媛 荀运浩 谌翠容 孙振江
杭州市西溪医院肝病科,浙江杭州 310023
乙型肝炎主要是由乙型肝炎病毒(hepatitis B virus,HBV)感染导致,该病可导致患者短时间内出现急性肝功能失代偿,继发慢加急性肝衰竭(acute-on-chronic liver failure,ACLF),也称作乙型肝炎病毒感染慢加急性肝衰竭(hepatitis B virus infection plus acute liver failure,HBV-ACLF)[1,2]。HBV-ACLF 患者具有起病迅速、病情进展快、病情急、治疗难度大、预后差等特点,短期病死率较高。积极了解疾病发生的危险因素,寻找和发病有相关性的预警指标,对指导疾病的临床治疗具有重要意义。目前许多研究认为,HBV 长期刺激可诱导肝脏血管炎症,对肝脏产生持续性损伤,是导致HBV-ACLF 发病的重要危险因素之一[3,4]。因此,本研究通过观察HBV-ACLF 患者血清白细胞介素-12(interleukin-12,IL-12)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、可溶性生长刺激表达基因2(soluble growth-stimulating expression gene 2,sST2)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)水平的变化,旨在探讨其临床意义及与肝功能的相关性,现报道如下。
1 资料与方法
1.1 一般资料
选择2020 年6 月至2021 年6 月杭州市西溪医院收治的50 例HBV-ACLF 患者(HBV-ACLF 组)、50 例单纯慢性乙型肝炎(chronic hepatitis B,CHB)患者(CHB 组)作为研究对象,纳入标准:①HBV-ACLF 组诊断参照《肝衰竭诊治指南(2018年版)》[5],CHB 诊断参照《慢性乙型肝炎防治指南(2015 年更新版)》[6],根据临床症状、肝组织病理学检查、实验室指标检查等确诊;②患者依从性好,可配合研究。排除标准:①其余病毒感染;②伴有药物性肝病、酒精性肝病、自身免疫性肝病等;③原发性肝癌;④伴有先天性免疫功能异常;⑤伴有其余对器官功能、生命安全有影响的重大疾病;⑥伴有精神系统、神经系统异常者。并纳入同期在杭州市西溪医院接受体检的健康人50 名作为对照组,经检查肝、肾、心功能,血尿常规均无异常。HBV-ACLF 组男29 例、女21 例;年龄34~69岁,平均(48.73±8.42)岁;病程1~9 年,平均(4.82±1.67)年;CHB 组男26 例、女24 例;年龄28~67 岁,平均(47.69±9.11)岁;病程1~8 年,平均(4.75±1.80)年;其中轻中度CHB 患者28例、重度CHB 患者15 例、CHB 肝硬化患者7 例。对照组男25 例、女25 例;年龄30~65 岁,平均(48.11±9.52)岁。3 组患者的性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究已通过杭州市西溪医院伦理委员会批准(伦理审批号:LKTZ-2020-53)。
1.2 检测指标
所有受试者纳入研究后次日晨取空腹静脉血8ml,置3500 转/min 离心机离心处理10min,取血清标本待检。肝功能各项指标检测:天门冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBiL)、白蛋白(albumin,ALB)试剂盒均购于上海科华生物技术有限公司。血清IL-12、VEGF、sST2、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)检测均选用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒进行,试剂盒购自上海江莱生物科技有限公司。
1.3 统计学方法
采用SPSS 23.0 统计学软件对数据进行处理分析,若数据符合正态分布,计量资料以均数±标准差()表示,多组比较采用单因素方差分析,组间两两比较采用最小显著差异(least significant difference,LSD)-t检验,计数资料以例数(百分比)[n(%)]表示,组间比较采用χ2检验,相关性分析采用Pearson 分析法,以P<0.05 表示差异有统计学意义。
2 结果
2.1 3 组患者肝功能各项指标比较
HBV-ACLF 组AST、ALT、TBiL 均高于CHB组与对照组,ALB 均低于CHB 组与对照组,CHB组AST、ALT、TBiL 均高于对照组,ALB 低于对照组,差异均有统计学意义(P<0.05),见表1。
表1 3 组患者肝功能各项指标比较()
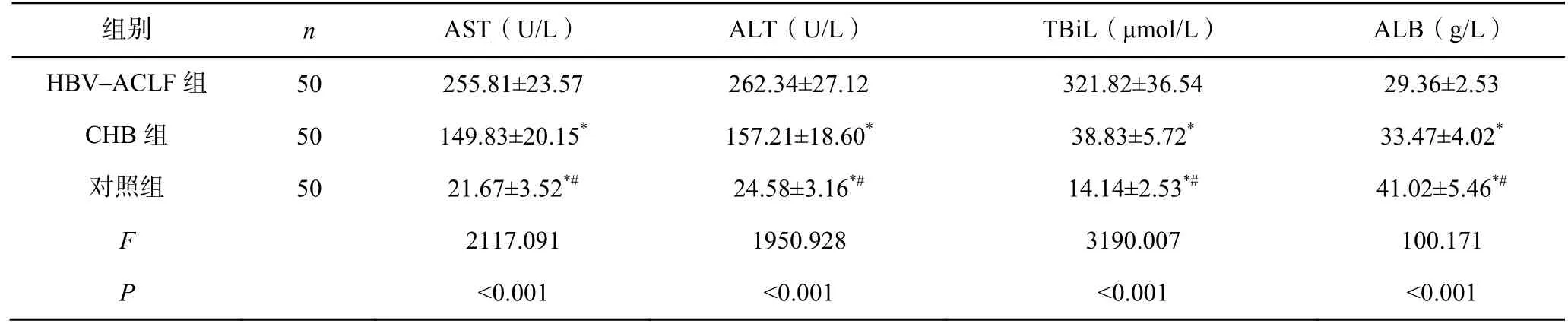
表1 3 组患者肝功能各项指标比较()
注:与HBV-ACLF 组比较,*P<0.05;与CHB 组比较,#P<0.05
2.2 血清 IL-12、VEGF、sST2、MCP-1 水平比较
HBV-ACLF 组血清IL-12、VEGF、sST2、MCP-1水平均高于CHB 组与对照组,CHB 组血清IL-12、VEGF、sST2、MCP-1 水平均高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 3 组患者血清IL-12、VEGF、sST2、MCP-1 水平比较()
注:与HBV-ACLF 组比较,*P<0.05;与CHB 组比较,#P<0.05
2.3 血清IL-12、VEGF、sST2、MCP-1 和肝功能指标的相关性分析
Pearson 相关性分析显示,血清IL-12、VEGF、sST2、MCP-1 和AST、ALT、TBiL 均呈正相关,与ALB 呈负相关(P<0.05),见表3。

表3 血清IL-12、VEGF、sST2、MCP-1 与肝功能指标的相关性分析
3 讨论
ACLF 的发病机制较为复杂,常见病因包括HBV感染、慢性酒精性肝病等,其中由于HBV 所导致的ACLF 占比可高达80%以上[7,8]。HBV-ACLF 患者发病后常出现急性黄疸加重、凝血衰竭等症状,并继发腹水、肝性脑病、感染、电解质紊乱等并发症,90d 内病死率可高达30%~60%,严重威胁患者的生命安全[9,10]。
IL-12 是一种促炎因子,主要分泌来自于Th1 细胞、树突细胞,与细胞免疫调节功能具有密切相关性[11]。有研究显示,HBV 在诱发机体免疫应答抵抗过程中,可对肝脏造成免疫性损伤,并促使Th1 细胞分泌IL-12,且IL-12 的增加可形成负反馈机制,对Th1 型细胞的免疫应答产生抑制作用,导致机体难以有效清除HBV 感染,从而引发一系列慢性损伤[12]。VEGF 目前主要应用于评价机体血管生成情况[13],本研究结果显示,VEGF 表达的高低与肝功能损伤程度也具有相关性,且VEGF 和肝硬化患者的肝功能程度密切相关[14]。另有报道指出,血清VEGF 有助于预测肝癌切除术后患者肝衰竭的发生风险[15]。sST2 主要存在于外周血之中,在机体炎症、细胞凋亡、组织坏死等刺激下,随着体内炎性反应的激活,其表达出现急剧升高[16,17]。MCP-1 来自于单核巨噬细胞、内皮细胞、平滑肌细胞等,对巨噬细胞的聚集、黏附过程可产生趋化作用[18,19]。李劲等[20]报道显示,血清sST2、MCP-1 在CHB 患者、肝衰竭患者中的表达存在明显差异,有助于患者病情的评估。
本研究通过观察发现,血清IL-12、VEGF、sST2、MCP-1 水平在HBV-ACLF 患者中明显升高,而CHB患者次之,且与肝功能指标具有显著相关性,主要原因是由于肝脏具有特殊的免疫微环境,含有丰富的Kupffer 细胞,肝脏中的Kupffer 细胞在全身单核巨噬细胞中的占比可高达80%以上,当机体遭受到HBV 感染后,其会刺激肝脏Kupffer 细胞出现大量增殖,从而刺激单核巨噬细胞释放MCP-1,增加其表达,同时当肝脏遭受到炎症、坏死等损伤后,也能导致IL-12、sST2 等大量释放,且随着肝脏损伤程度的进一步加重,各指标的升高程度也会更加明显。此外,在CHB 的进展过程中,可逐渐加重肝脏血管炎性反应,且随着肝组织破坏的加重,易出现血管阻塞等情况。肝细胞在缺氧、缺血条件下,可促使VEGF 大量合成,使血管通透性增加,进一步降低肝组织内的有效血容量,加重肝细胞的缺氧、缺血程度,从而形成一种恶性循环。
综上所述,血清IL-12、VEGF、sST2、MCP-1水平在HBV-ACLF 患者中表达明显升高,与患者的肝功能具有显著相关性,有利于疾病的诊断和治疗。
