高频rTMS 治疗rt-PA 溶栓后脑卒中后抑郁患者的疗效观察
2022-11-26赵云飞郑春美
赵云飞 郑春美
1.绍兴市第七人民医院精三病区,浙江绍兴 312000;2.绍兴市第七人民医院精神科,浙江绍兴 312000
脑卒中为神经系统的常见病、多发病,死亡率与致残率较高,且后遗症与并发症发生的概率较高[1]。脑卒中后抑郁是脑卒中常见的并发症之一,患者常伴有情感障碍、睡眠障碍,严重影响患者的生活质量,因此,对脑卒中后抑郁患者早期予以及时的抗抑郁治疗可显著提高存活率[2,3]。脑卒中后抑郁一般首选药物治疗,但起效慢、药物不良反应大、价格贵,且老年患者对药物的耐受性低,需要长期服药等[4]。高频重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一种无创的电生理治疗技术,能够显著治疗患者的抑郁症状,该技术主要利用磁信号透过颅骨对患者大脑神经进行刺激[5]。本文主要探讨高频对行阿替普酶(recombinant tissue plasminogen activator,rt-PA)对行rt-PA 溶栓后脑卒中患者的抑郁、情感障碍治疗的效果,现报道如下。
1 对象与方法
1.1 研究对象
选取2019 年4 月至2020 年4 月在绍兴市第七人民医院就诊的行rt-PA 溶栓后脑卒中后抑郁患者102 例,纳入标准:①患者均符合《各类脑血管疾病诊断标准要点》[6]中相关诊断标准;②临床表现为抑郁、焦虑;HAMD 评分>8 分。排除标准:①精神活性物质与非成瘾物质所致抑郁患者;②伴有重度失语、耳聋、痴呆及抑制障碍影响抑郁情绪表达患者;③存在癫痫病史患者;④具有精神家族史或既往抑郁症史患者;⑤无法配合本研究治疗患者。102 例患者采用数字表法随机分为两组,每组各51 例,对照组患者中男31 例,女20 例,年龄54~71 岁,平均年龄(59.4±8.1)岁;研究组患者中男29 例,女22 例,年龄52~72 岁,平均年龄(58.9±9.5)岁,两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究入选患者家属均对本研究知情同意并签署知情同意书,本研究经绍兴市第七人民医院伦理委员会批准(伦理审批号:2018-003-01)。
1.2 仪器与药物
CCY-Ⅰ型刺激仪(武汉依瑞德公司);阿戈美拉汀(法国施维雅药厂,国药准字J2011062,规格25mg/片)。
1.3 方法
1.3.1 治疗方法 对照组患者予阿戈美拉汀,每日晚上入睡前口服,最初服用剂量为25mg/d,后可以按照患者具体病情情况调整用药剂量。研究组患者在对照组的基础上予高频rTMS 治疗,由2 名主治医师采用CCY-Ⅰ型刺激仪对患者进行治疗,患者取平卧位,头部不动,全身放松,圆形线圈直径为125mm,患者的前额叶背外侧皮质处为其中性位置,调整其位置,相切于头皮。刺激仪频率10Hz。选择患者左侧前额叶背外侧区为刺激部位,每串的刺激时间4s,间隔时间20s,持续刺激20min,5 次/周。两组患者均连续治疗4 周。
1.3.2 汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评分、汉密尔顿焦虑表(Hamilton anxiety scale,HAMA)评分 HAMD 评分采用汉密尔顿抑郁量表评估,大部分项目采用0~4 分的5 级评分法,少部分项目采用0~2 分的3 级评分法,得分越高表示患者抑郁程度越严重。HAMA 评分采用汉密尔顿焦虑表评估,所有项目采用0~4 分的5 级评分法,共14 个项目。
1.3.3 脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、神经生长因子(nerve growth factor,NGF)水平、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)水平检测 取患者晨空腹静脉血5ml,置一次性真空无抗凝剂的采血管中,20~25℃环境下凝血60min,3000 转/min 的离心机离心处理10min,分离血清,-20℃环境中保存。采用酶联免疫吸附试验法检测脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、神经生长因子(nerve growth factor,NGF)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)水平,并对酶标板进行标记、对标准品进行稀释,然后分别设置标准、空白、检测孔,标准孔添加标准品,空白孔添加终止液、显色剂,检测孔添加血清标本及抗体,封膜并摇晃均匀,37℃保温箱内静置保存60min 后,予去膜清洗,将水分吸干后各孔添加显色剂并摇晃均匀,待显色后加入终止液,空白孔为基准,使用酶标分析仪(无锡华文默克仪器有限公司,型号:DR-200Bn)450nm 处测吸光值,计算BDNF、NGF、TNF-α 及IL-6 水平。
1.3.4 神经功能缺损评分表(National Institute of Health stroke scale,NIHSS)评分、睡眠障碍表(sleep dysfunction rating scale,SDRS)评分及改良Barthel指数(modified Barthel index,MBI)评分 采用神经功能缺损评分表评定,主要包括失语、视野与感觉等,其得分越高,神经功能缺损程度越严重[7]。SDRS 评分采用睡眠障碍表进行评估,共10 个条目,采用0~4 分五级评分,得分越高患者睡眠障碍越严重[8]。MBI 评分采用改良Barthel 指数评分,得分越低病情越严重[9]。
1.3.5 疗效评价 显效:HAMD 评分改善>75%,抑郁症状消失;有效:HAMD 评分改善24%~75%,抑郁症状明显改善;无效:HAMD 评分改善<24%,抑郁症状无改善。总有效率=(显效+有效)/总例数×100%[10]。
1.4 统计学方法
采用SPSS 19.0 统计学软件对数据进行处理分析。计量资料以均数±标准差()表示,组间比较行独立样本t检验;其中计数资料以[例数(百分比)][(n(%)]表示,组间比较行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后HAMD、HAMA 评分比较
治疗前两组患者HAMD 评分、HAMA 评分比较,差异无统计学意义(P>0.05)。治疗后,研究组患者HAMD 评分、HAMA 评分明显低于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后HAMD、HAMA 评分比较(,分)
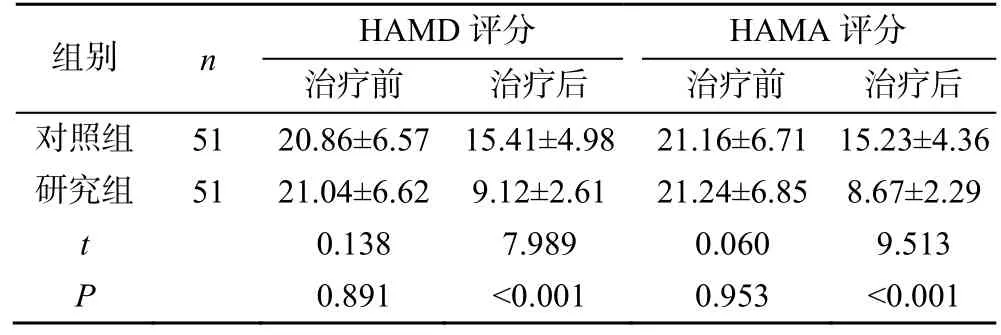
表1 两组患者治疗前后HAMD、HAMA 评分比较(,分)
2.2 两组患者治疗前后BDNF、NGF 水平比较
治疗前两组患者BDNF、NGF 水平比较,差异无统计学意义(P>0.05)。治疗后,研究组患者BDNF、NGF 水平明显高于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后BDNF、NGF水平比较(,ng/L)
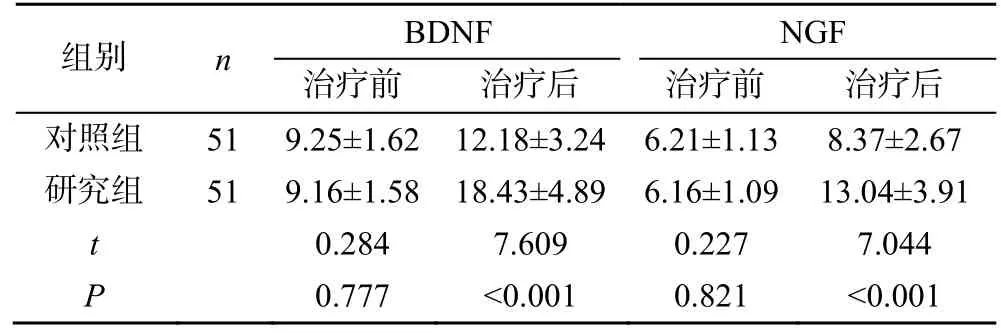
表2 两组患者治疗前后BDNF、NGF水平比较(,ng/L)
2.3 两组患者治疗前后NIHSS 评分、SDRS 评分及MBI 评分比较
治疗前两组患者NIHSS 评分、SDRS 评分及MBI评分比较,差异无统计学意义(P>0.05)。治疗后,研究组患者NIHSS 评分、SDRS 评分分别明显低于对照组,MBI 评分明显高于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后NIHSS 评分、SDRS 评分及MBI 评分比较(,分)
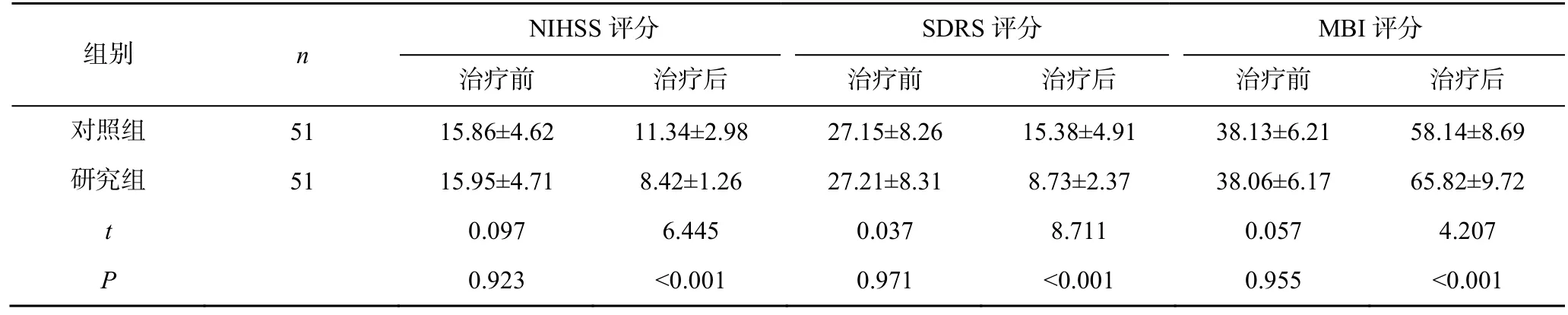
表3 两组患者治疗前后NIHSS 评分、SDRS 评分及MBI 评分比较(,分)
2.4 两组患者治疗前后TNF-α、IL-6 水平比较
治疗前两组患者TNF-α、IL-6 水平比较,差异无统计学意义(P>0.05),治疗后,研究组患者TNF-α、IL-6 水平明显低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后TNF-α、IL-6水平比较(,ng/L)
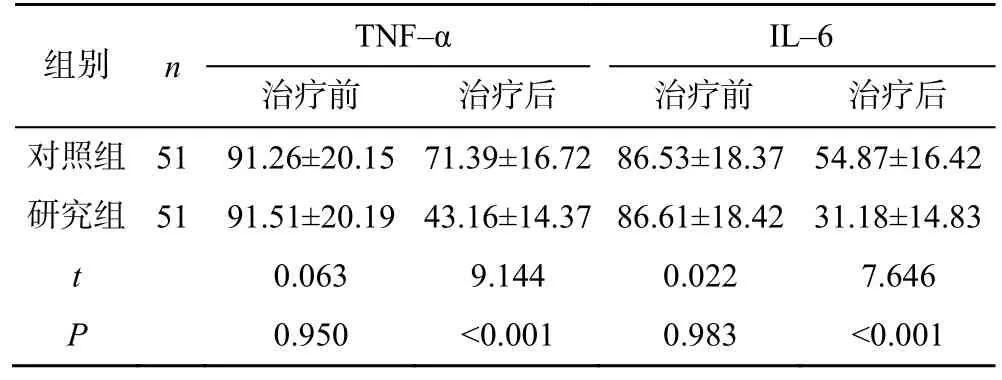
表4 两组患者治疗前后TNF-α、IL-6水平比较(,ng/L)
2.5 两组疗效比较
研究组患者治疗后的治疗总有效率明显高于对照组,差异有统计学意义(χ2=9.714,P<0.05),见表5。
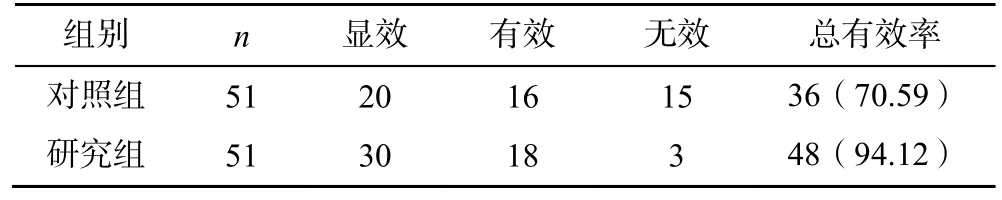
表5 两组疗效比较[n(%)]
3 讨论
近年来,急性脑卒中发病率正呈现出不断上升的趋势,同时该病还具有较高的死亡率,严重影响患者的身心健康以及生活质量[11]。相关研究表明,脑卒中患者除了躯体疼痛外,引起的较多并发症是抑郁,患者一般多表现为情感障碍、睡眠障碍及焦虑等,不利于患者病情的恢复[12]。脑卒中后抑郁是脑卒中常见的并发症,该病发病后患者出现活动能力减退、情绪低落及思维迟缓等情感障碍相关疾病[13]。脑卒中后抑郁增加了患者的死亡率,使患者的神经功能得到冥想减缓,且该病发病较为隐袭,不易被察觉,导致抑郁等症状不能被及时发现[14]。脑卒中后抑郁的发病机制较为复杂,主要包括行为心理、生物机制及社会因素,也可能与急性缺血性卒中脑细胞的损伤、脑叶皮质下功能障碍有关[15]。TMS 广泛用于神经、精神病患者的治疗,rTMS 是一种非侵入性的检查与治疗方法,利用磁电转化、在脑皮质局部形成电流刺激,用于改变神经突触与受体的功能[16]。
Towfighi等[17]研究表明,中枢神经系统5-羟色胺与去甲状腺素降低在脑卒中后抑郁的发生与发展中起重要作用。本研究结果显示,高频rTMS 可有效地改善患者的焦虑、抑郁情绪。目前有研究显示,高频rTMS 已有将其作为标准治疗抑郁症的方法。Lefaucheur等[18]研究表明,rTMS 治疗抑郁、焦虑障碍方面具有肯定的效果,主要的治疗机制为rTMS能提高脑内去甲肾上腺素、乙酰胆碱类神经递质及5-羟色胺水平,调整双侧大脑皮质兴奋性,增加局部脑血流量与代谢水平存在关联。BDNF、NGF 对神经细胞的死亡具有决定性作用,对神经细胞的维持以及分化过程均有所参与,为神经营养因子家族重要成员,主要存在于皮质与海马中,可营养、支持NE 神经元、5-羟色胺。BDNF 水平与脑卒中后抑郁的发生与预后密切相关,它可以降低谷氨酸水平,损伤神经元,明显改善神经元的可塑性,同时它还可以增强多巴胺能神经元及5-羟色胺能神经元的活性,是脑卒中后神经元再生的关键[19]。脑卒中会造成大量神经细胞坏死,导致NGF 合成减少,而神经元损害及神经细胞因子减少二者之间相互促进,导致神经细胞得不到较好的保护。NGF 是一种神经细胞生长调节因子,具有增加神经元营养及促进突起生长的作用,对神经元的发育、分化、生长、再生和功能特性的表达具有重要的调控作用[20]。本研究结果显示,高频rTMS 能限制提高 BDNF、NGF 水平,引起BDNF、多巴胺等多种神经递质改变,增加神经元兴奋性基因表达,区域性功能重建,改善抑郁障碍,促进患者神经功能的恢复[21]。本研究结果显示,高频rTMS 可改善患者的神经功能、睡眠障碍及MBI 评分。
炎性反应不仅参与动脉斑块性质的改变过程,在脑卒中病情演变过程中发挥了重要作用,还可以直接参与抑郁症的发生[22]。TNF-α、IL-6 是较为重要的炎症因子,其能够调节中枢神经系统,影响神经递质的合成、分泌及代谢等过程[23]。Chen等[24]研究表明,脑卒中后抑郁患者的血清炎症因子TNF-α、IL-6 水平明显升高,主要是通过伴有单核巨噬细胞或淋巴细胞激活。本研究结果显示,高频rTMS 可抑制患者炎性反应。高频rTMS 通过聚焦磁场变化,有效调节脑组织与神经细胞兴奋性,于情绪活动对应脑功能区发挥作用,促使患者精神活动发生改变与调整,有效调节情感与认知相关区域联结,选择左背外侧前额叶作为刺激部位,改善认知及执行功能,调整患者情绪,达到抗抑郁的目的[25]。本研究证明高频rTMS 对行rt-PA 溶栓后脑卒中后抑郁患者治疗效果显著。
综上所述,高频rTMS 对行rt-PA 溶栓后脑卒中后抑郁患者治疗效果显著,能有效改善患者的情感障碍、神经功能及睡眠障碍,值得临床推广和应用。
